早期肠内营养对ICU重型颅脑损伤患者的免疫功能和监护时间的影响
2019-02-15陈振
陈 振
蚌埠医学院第一附属医院重症医学科,安徽蚌埠 233000
重症颅脑外伤患者因机体处于应激状态,使患者组织代谢旺盛,能力消耗大,引起机体营养不良和免疫能力低下,极易造成炎性反应和感染并发症,影响患者治疗效果,甚至威胁患者生命健康[1]。因此,给予及时、合适的营养支持对重症颅脑外伤患者的康复极为重要。早期肠内营养支持(EEN)是临床常用营养支持方式,具有保护肠黏膜,防止细菌异位的作用,近年来国内外关于重症颅脑损伤患者应用ENN的相关研究较多,均证明了ENN在改善患者营养状态方面的良好效果[2]。但是,目前国内多数研究关于ENN对重症颅脑损伤患者免疫指标的影响还比较片面,不能较全面的分析ENN对患者免疫功能的影响。本研究对ICU重症颅脑损伤患者应用ENN,并从体液免疫、细胞免疫、炎症因子等方面分析其对患者免疫功能的影响,以期为患者临床治疗提供参考,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年1月~2018年6月在我院ICU治疗的80例重症颅脑损伤患者。纳入标准:(1)经CT或MRI确诊为重症颅脑外伤;(2)首诊格拉斯哥昏迷(GCS)≤8分;(3)预计生存期>3周;(4)患者年龄18~65岁,无代谢性疾病及严重胃肠疾病病史;(5)患者及家属知情同意。排除标准:(1)合并其他严重脏器损伤;(2)消化道出血、应激性溃疡、肠麻痹等消化系统功能不全的患者;(3)存在部分或完全肠梗阻、小肠缺血或孕妇;(4)康复过程中应用血制品者;(5)合并恶性肿瘤、甲状腺疾病者及免疫系统疾病者;(6)对营养液过敏者。将所有入组患者随机分为对照组和观察组,每组40例。对照组包括男23例,女17例;平均年龄(37.8±4.2)岁;开放性损伤21例,闭合性损伤19例;格拉斯哥昏迷指数评分(GCS)(6.84±1.21)分;急性生理与慢性健康(APACHEⅡ)评分(11.26±2.32)分。观察组包括男24例,女16例;平均年龄(38.1±4.1)岁;开放性损伤22例,闭合性损伤18例;GCS评分(6.79±1.24)分;APACHEⅡ评分(11.35±2.37)分。两组患者的年龄、性别、病情严重程度等一般资料差异无统计学意义(P>0.05),具有可比性,本研究经医院伦理委员会批准,家属知情并签署同意书。
1.2 营养支持方法
参照文献资料[3-4],两组患者入院后给予甘露醇脱水降颅压、手术等相应治疗措施。观察组患者在入院48h内开始进行肠内营养支持。早期肠内营养给予全营养素,根据循序渐进的原则,初始肠内营养乳剂剂量为200mL,速度为80mL/h,在后期营养支持过程中根据患者的临床症状评估耐受情况,逐渐增加营养液剂量和注入速度,并控制营养液温度在37℃左右。密切监测患者血压、心率、肠鸣音、排气及排便情况,保证患者血糖、心率在正常范围内,如出现血糖>11.1mmol/L时,则要给予胰岛素治疗。对照组患者给予脱水、降低颅内压、预防感染、控制血压、维持水电解质平衡等常规治疗措施后,采用自配营养液进行肠外营养,7d后跟进患者临床症状逐步过渡到肠内营养。
1.3 检测方法
1.3.1 T淋巴细胞亚群检测 分别于入院时、营养支持10d后取两组患者清晨静脉血2mL,3000r/min离心10min,取上清液,采用美国BD公司生产的流式细胞仪及CD4-FITC/CD8-PE双色标记单克隆抗体检测CD4+、CD8+,并计算CD4+/CD8+。
1.3.2 免疫球蛋白IgA、IgM、IgG检测 分别于入院时、营养支持10d后取两组患者清晨静脉血2mL,经2000 r /min离心后,取上清液,采用德国西门子公司生产的BNⅡ特定蛋白分析仪检测两组患者的免疫球蛋白IgA、IgM、IgG,严格按照仪器及试剂盒操作规程进行操作。
1.3.3 炎症因子 分别于入院时、营养支持14d后取两组患者清晨空腹静脉血3mL,3000r/min离心10min,取上清液,采用ELISA法检测患者白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)水平,试剂盒由深圳精美公司生产,严格按照试剂盒说明书操作执行。
1.3.4 并发症及ICU监护时间 记录两组患者在ICU监护期间并发症的情况以及ICU监护时间。
1.4 统计学处理
2 结果
2.1 两组患者T淋巴细胞亚群水平比较
治疗前,两组患者的T淋巴细胞亚群CD4+、CD8+及CD4+/CD8+水平无统计学差异(P>0.05),治疗后,两组患者的T淋巴细胞亚群指标均明显升高(P<0.05),且观察组患者的各项指标水平均高于对照组(P<0.05),见表1。
表1 两组患者治疗前后免疫指标水平比较
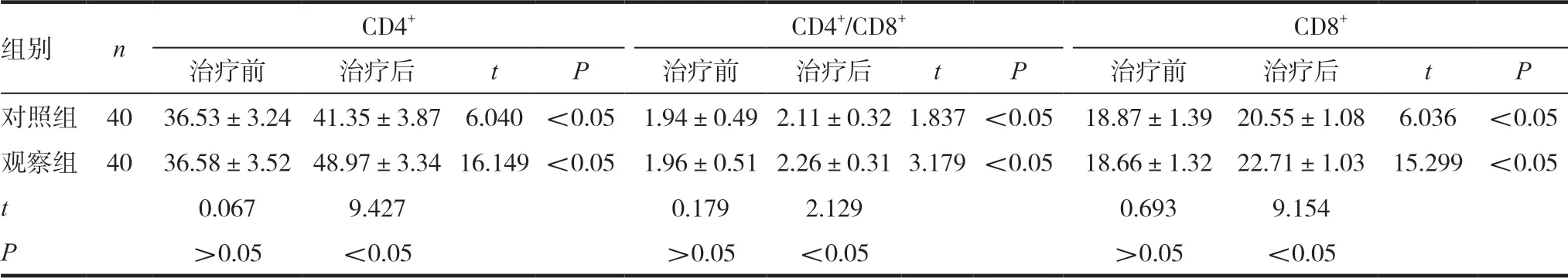
表1 两组患者治疗前后免疫指标水平比较
组别 n CD4+ CD4+/CD8+ CD8+治疗前 治疗后 t P 治疗前 治疗后 t P 治疗前 治疗后 t P对照组 40 36.53±3.24 41.35±3.87 6.040 <0.05 1.94±0.492.11±0.321.837<0.05 18.87±1.39 20.55±1.08 6.036 <0.05观察组 40 36.58±3.52 48.97±3.3416.149<0.05 1.96±0.512.26±0.313.179<0.05 18.66±1.32 22.71±1.03 15.299 <0.05 t 0.067 9.427 0.179 2.129 0.693 9.154 P>0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.2 两组患者体液免疫指标水平比较
治疗前,两组患者的体液免疫指标IgA、IgG及IgM水平无统计学差异(P>0.05),治疗后,两组患者的体液免疫指标指标均明显升高(P<0.05),且观察组患者的各项指标水平均高于对照组(P<0.05),见表2。
表2 两组患者体液免疫指标水平比较
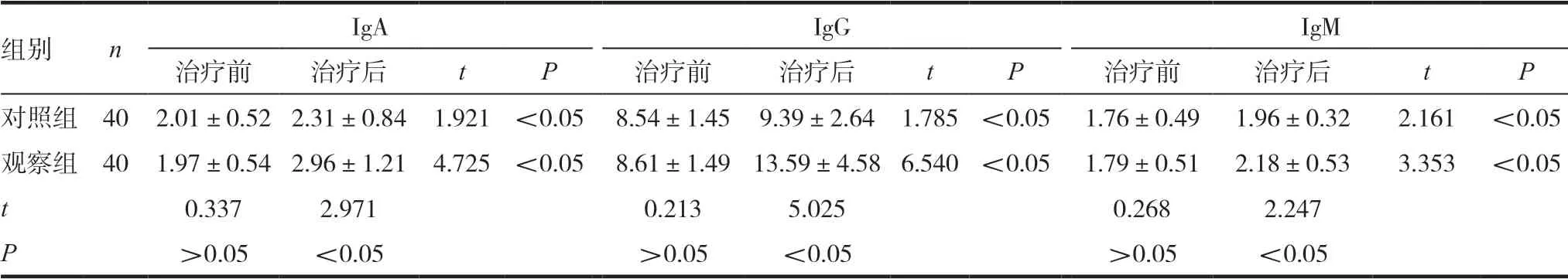
表2 两组患者体液免疫指标水平比较
组别 n IgA IgG IgM治疗前 治疗后 t P 治疗前 治疗后 t P 治疗前 治疗后 t P对照组 40 2.01±0.52 2.31±0.84 1.921 <0.05 8.54±1.45 9.39±2.64 1.785 <0.05 1.76±0.49 1.96±0.32 2.161 <0.05观察组 40 1.97±0.54 2.96±1.21 4.725 <0.05 8.61±1.49 13.59±4.58 6.540 <0.05 1.79±0.51 2.18±0.53 3.353 <0.05 t 0.337 2.971 0.213 5.025 0.268 2.247 P>0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.3 两组患者炎性因子水平比较
治疗前,两组患者的炎性因子水平无统计学差异(P>0.05),早期肠内营养10d后,两组患者血清IL-6、IL-8及TNF-α均较治疗前明显降低(P<0.05),且观察组患者各炎性因子指标水平均明显低于对照组(P<0.05),见表3。
表3 两组患者治疗前后炎性因子水平比较
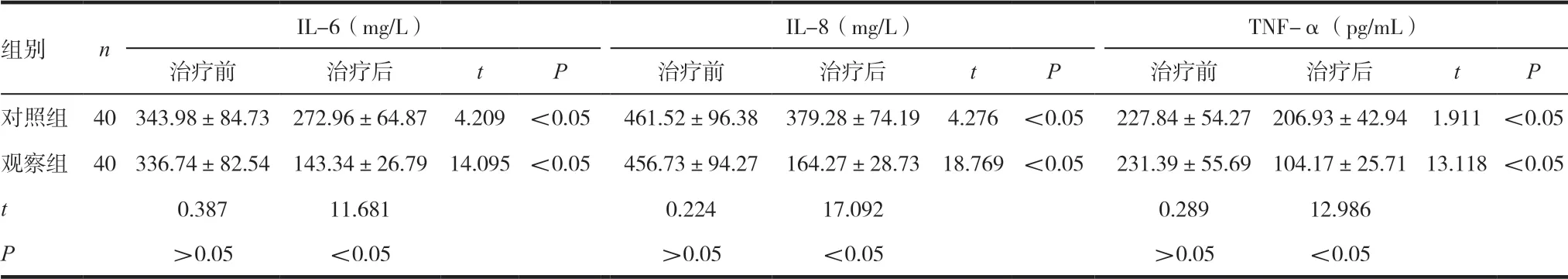
表3 两组患者治疗前后炎性因子水平比较
组别 n IL-6(mg/L) IL-8(mg/L) TNF-α(pg/mL)治疗前 治疗后 t P 治疗前 治疗后 t P 治疗前 治疗后 t P对照组 40 343.98±84.73 272.96±64.87 4.209 <0.05 461.52±96.38 379.28±74.19 4.276 <0.05 227.84±54.27 206.93±42.94 1.911 <0.05观察组 40 336.74±82.54 143.34±26.79 14.095 <0.05 456.73±94.27 164.27±28.73 18.769 <0.05 231.39±55.69 104.17±25.71 13.118<0.05 t 0.387 11.681 0.224 17.092 0.289 12.986 P>0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.4 两组患者并发症及ICU住院时间比较
观察组患者的并发症发生率明显低于对照组(P<0.05),观察组患者的ICU住院时间明显少于对照组(P<0.05),见表4。

表4 两组患者并发症及ICU住院时间比较
3 讨论
重症颅脑外伤后会在短时间内出现大量失血、失液及组织创伤等一系列病理生理变化,机体处于氧化应激状态,因茶酚胺、胰高血糖素等激素分泌水平急剧升高,导致机体处于高代谢反应状态,能力消耗增加[5-6]。但是患者在创伤后往往需要禁食,营养物质摄入量不足,导致低蛋白血症和高糖血症,成为引发不良后果的重要诱因。因此,采用正确的营养支持减少蛋白质丢失,抑制高分解代谢,对改善重症颅脑外伤患者营养不良状况,促进康复具有重要意义。目前,临床上常用的营养支持方式主要包括肠外营养和肠内营养两种。相较于肠外营养支持,肠内营养支持更符合生理需求,通过肠内营养科改善肠道血液灌注,促进肠蠕动,改善肠道黏膜的通透性,维持肠道黏膜细胞结构和功能的完整性,从而避免肠道菌群移位,维持肠道黏膜的屏障功能;同时还可将营养物质经门静脉吸收进入肝脏,促进蛋白合成,调节高代谢反应[7-8]。因此本研究在患者入院48h内给予早期肠内营养支持,及时改善患者营养状况,为重症颅脑外伤患者康复提供足够的营养支持。
免疫系统通过协调各个器官、系统活动,可形成适度的免疫应答,起到预防控制感染的作用。
ICU重症颅脑损伤患者机体各系统器官均处于较差的状态,其中细胞免疫和体液免疫是研究患者免疫功能较为常见的两大类免疫指标。其中细胞免疫主要是指T淋巴细胞在受到抗原刺激后的增殖、分化和转换情况,有效的清除抗原异物,是机体抗感染和抗炎症反应的主要力量,具有较强的免疫防护作用[9]。其中CD4+具有辅助T淋巴细胞免疫应答的作用,而CD8+则是抑制T淋巴细胞免疫应答的作用,两者相互制约,共同维护免疫功能平衡[10]。本研究结果显示,在入住ICU时两组患者的CD4+、CD8+及CD4+/CD8+水平均处于较低水平,而经过肠内营养支持10d后,两组患者的CD4+、CD8+及CD4+/CD8+水平均明显上升,且观察组患者的各项指标水平明显高于对照组,这与王艺萍等[11]研究结果一致。体液免疫则是主要通过B细胞产生抗体起到免疫调节的作用,IgM 是体液免疫中最早出现的抗体,其具有溶血、溶菌以及激活补体的作用,IgA 具有抗病毒、抗菌、抗毒素作用,IgA、IgG及IgM通过感应、反应及效应三个阶段发挥出免疫调节的作用,有效预防出现感染等并发症情况[12]。本研究结果表明,重症颅脑损伤患者在入住ICU时IgA、IgG及IgM水平较低,免疫功能低下,经营养支持后两组患者的体液免疫指标指标均明显升高(P<0.05),且观察组患者的各项指标水平均高于对照组(P<0.05),这与李俊蕾等[13]研究结果一致。这表明了EEN更好的提高了患者的细胞免疫水平,这对于增强患者的免疫能力具有积极作用。
IL-6、IL-8和TNF-α是炎性反应的重要递质,炎性因子水平越高,炎性反应越强,是影响患者治疗、转归和预后的重要因素。当机体出现重度损伤时,使中性粒细胞产生大量的IL-6、IL-8和TNF-α等炎性因子,促使机体产生多种介导炎性物质,同时由于组织创伤修复需要大量营养物质,双重因素影响下导致患者免疫功能下降,极易出现炎性反应。IL-6是由淋巴T细胞分泌的炎症因子,主要起介导氧化反应的作用;IL-8可促使炎性细胞趋化,诱导细胞增殖,有一定的促炎作用;TNF-α由巨噬细胞、T淋巴细胞产生,通过激活、趋化、聚集血液细胞促使白细胞进入血液循环中,引起炎性反应[14-15]。本研究表明,重症颅脑损伤患者在入住ICU时,炎性因子水平处于较高水平,这表明患者机体内存在严重的应激炎性反应。在机体内炎性因子过度表达的同时,患者的免疫功能持续下降,形成恶性循环,加重患者病情。因此,在控制颅脑损伤患者炎性反应,给予充足的营养物质的同时,还要改善患者的免疫功能。通过EEN促进肠蠕动,刺激免疫细胞,增强免疫应答,减轻过度炎性反应,提高免疫功能,遏制恶性循环,形成改善免疫功能,抑制炎性反应的良性机制,促进患者康复。
在重症颅脑损伤患者康复过程中,观察组患者的并发症发生率明显低于对照组,ICU住院时间明显短于对照组。这表明,重症颅脑损伤患者实施EEN能够改善患者的免疫功能,降低炎性反应,降低感染并发症的发生率,有效促进患者康复。但是,在初始给予重症颅脑外伤患者EEN治疗时,营养液剂量不应过多,这会导致患者出现EEN不耐受性,加重脏器功能衰竭,因此本研究在EEN治疗时遵从循序渐进的原则,早期适当降低营养液剂量和注入速度,避免对肠道的过度刺激,逐渐提高胃肠道耐受性,更好的保护了肠道功能[12]。
综上所述,ICU重症颅脑外伤患者采用EEN治疗能够有效改善患者机体免疫力,抑制炎性因子水平,减少感染并发症发生率,利于患者早日康复,值得推广应用。
