miR-139在Aβ25-35诱导Neuro-2a细胞损伤中的机制研究
2019-02-15孙林琳杨松林段淑荣
孙林琳, 杨松林, 王 晔, 段淑荣
阿尔茨海默病(Alzheimer’s disease,AD)是一种与年龄相关的神经退行性疾病[1]。典型的AD临床表现包括记忆障碍、失语、失用、失认、视空间能力损害、抽象思维和计算力损害、人格和行为改变等[2]。流行病学调查显示,65岁以上老年人AD患病率在我国约为3%~7%,女性高于男性[3]。随着年龄的增长,AD患病率逐渐上升,目前我国人口平均预期寿命逐渐增加,AD已经成为重要的健康问题及社会问题。
β-淀粉样蛋白(β-amyloid,Aβ)的生成与清除失衡是导致AD发生的起始事件[4]。microRNAs(miRNAs)是一类内源性非编码的RNA分子,通过与靶基因mRNA的3′-非翻译区(3’BUTR)结合而导致翻译抑制或mRNA降解进而调节疾病的发生、发展[5,6]。以往的研究中观察到AD患者和动物模型中存在多种miRNAs异常表达[7,8]。同时,越来越多的证据表明,miRNAs通过调节抗体的产生和炎症反应参与AD的发生及发展[9]。miR139是一种脑功能调节的重要因子,参与多种神经、精神疾病的病理过程[10,11],Noh等报道miR-139在AD小鼠大脑组织中表达上调[12]。然而,miR139在AD发病机制中的具体作用和潜在分子机制还不十分清楚。
1 材料和方法
1.1 主要材料 小鼠来源神经瘤母细胞系Neuro-2a购自于美国American type culture collection公司。Aβ25-35购自于美国Sigma公司。miR-139-mimics(No. miR20004552-1-5),miR-NC-mimics,miR-139 inhibitor(No. miR10000250-1-5)以及miR-NC-inhibitor试剂盒均购自于广州Ribobio公司。逆转录试剂盒购自大连宝生物工程有限公司。FOXO1和β-actin抗体购自美国Cell Signaling Technology。
1.2 实验方法
1.2.1 细胞培养 小鼠来源神经瘤母细胞系Neuro-2a在含10%胎牛血清的1640培养基中于37 ℃,5%二氧化碳浓度条件下培养。Aβ25-35溶于DMSO,保持在37℃ 备用[13]。利用不同培养浓度(0 μmol/L、5 μmol/L、10 μmol/L以及20 μmol/L)Aβ25-35 诱导Neuro-2a细胞24 h,随后留取细胞进行相关实验。
1.2.2 细胞转染 通过Lipofectaminetm 2000(Invitrogen公司,卡尔斯巴德,CA,美国)分别将50 nM miR-139-mimics,miR-NC-mimics,miR-139 inhibitor以及miR-NC-inhibitor转染到Neuro-2a细胞中,48h后提取RNA。
1.2.3 RNA提取与实时PCR 从Neuro-2a细胞中提取总RNA。通过逆转录试剂盒进行转录。通过ABI7900实时PCR系统(应用生物系统公司,福斯特城,CA,美国)进行检测。比较2-ΔΔCt法进行相对定量,引物序列如下:FOXO1-F:5’-GCTTAGAGCAGAGATGTTCTCACATT-3’;FOXO1-R:5’-CCAGAGTCTTTGTATCAG GCAAATAA-3-3’;GAPDH-F:5’-AGCCTCCCGCTTCGCTCTCT-3’;GAPDH-R:5’-GCGCCCAATACGACCAAATCCGT-3’;miR-139-F:5’-UGGAGACGCGGCCCUGUUGGAG-3’;miR-139-R:5’-CAAACCAAAGATAAACGTGGATT-3’;U6-F:5’-GCTTCGGCAGCACATATACTAAAAT-3’;U6-R:5’-CGCTTCACGAATTTGCGTGTCAT-3’;GAPDH为检测FOXO1表达的内参,U6为检测miR-139表达的内参。
1.2.4 Western blot分析 所有的蛋白来自Neuro-2a细胞,采用RIPA和PI(蛋白抑制剂,1∶100)提取蛋白。由10%的SDS-PAGE分离并转移到醋酸纤维素膜上。膜用5%脱脂牛奶封闭2 h后,孵育其特异性抗体FOXO1抗体和β-actin抗体。拍照并用图像分析软件(Odyssey)进行光密度积分值分析。
1.2.5 荧光素酶报告基因分析 miRNA靶标预测软件(www. TargetScan. org)分析结果显示,FOXO1与miR139有潜在的结合位点(见图2A)。因此,我们用荧光素酶报告法检测miR-139是否能直接与FOXO1的3’BUTR区结合。利用PCR将预期作用位点及其附近序列重组入pmirglo载体,命名为pmirglo-FOXO1-wt。同时,我们构建了删除作用位点的FOXO1 3’-UTR序列,并重组入pmirglo载体,命名为pmirglo-FOXO1-mut。
为了分析miR-139与FOXO1的3’-UTR预测作用位点的直接作用,我们将5×103个Neuro-2a细胞接种于96孔板,24 h后,通过Lipofectamine 2000共转染pmirglo-FOXO1-wt或pmirglo-FOXO1-mut。48 h后收集细胞,按照实验流程,通过Luciferase报告检测系统检测荧光素酶活性(Promega,USA)。
1.2.6 caspase-3活性测定 利用不同培养浓度(0 μmol/L、5 μmol/L、10 μmol/L以及20μmol/L)Aβ25-35处理24 h后,收集Neuro-2a细胞。按照说明书中操作流程通过caspase-3比色分析仪(KeyGEN,南京)在405 nm的吸光度下检测caspase-3活性。
1.2.7 NF-κB活性测定 利用不同培养浓度(0 μmol/L、5 μmol/L、10 μmol/L以及20μmol/L)Aβ25-35处理24 h后,收集Neuro-2a细胞。按照说明书中操作流程通过NF-κB比色分析仪(碧云天,北京)在570 nm的吸光度下检测NF-κB活性。
2 结 果
2.1 Aβ25-35对Neuro-2a细胞miR-139和FOXO1表达的影响 应用不同浓度Aβ25-35(0 mmol/L、5 mmol/L、10和20 mmol/L)培养Neuro-2a细胞24 h,通过qRT-PCR以及Western blot方法检测Aβ25-35对Neuro-2a细胞中miR-139和FOXO1的表达。结果显示,Neuro-2a中miR-139的表达呈Aβ25-35剂量依赖性显著上升(P<0.05,见图1A),FOXO1的mRNA及蛋白表达呈Aβ25-35剂量依赖性显著降低(P<0.05,见图1B、图1C),表明miR-139和FOXO1参与Aβ25-35诱导的神经毒性,两者表达呈负相关。
2.2 miR-139对Neuro-2a细胞FOXO1的调控作用 荧光素酶报告试验结果表明(见图2B),相对于阴性对照组,过表达miR-139能够显著抑制FOXO1荧光素酶的活性;删除预测的miR-139作用位点后,FOXO1的荧光素酶活性不能被抑制,印证之前预测的miR-139可直接作用于FOXO1的3’BUTR区。
进一步,通过qRT-PCR以及Western blot方法检测转染miR-139 mimic、miR-139 inhibitor以及其阴性对照物到Neuro-2a细胞后FOXO1的表达。结果显示,过表达miR-139能够明显降低Neuro-2a细胞中FOXO1的mRNA及蛋白表达水平(P<0.05,见图2C、图2D),而低表达miR-139的作用与其相反。以上结果从多水平证明FOXO1是miR-139在Neuro-2a细胞中的直接作用靶点。
2.3 miR-139对Aβ25-35介导的Neuro-2a细胞增殖及凋亡的影响 分别将miR-139抑制物及阴性对照物转染到Neuro-2a细胞,各称为静默组及对照组。随后将转染的Neuro-2a细胞暴露于不同浓度Aβ25-35下24h,应用CCK-8法检测细胞活力、caspase-3活性检测细胞凋亡、ELISA方法检测NF-κB浓度。
qRT-PCR实验证实,与对照组相比,静默组Neuro-2a细胞miR-139的表达显著降低(P<0.05,见图3A),miR-139抑制物在Neuro-2a细胞中可发挥作用。接下来CCK-8法显示,与对照组相比,静默组Neuro-2a细胞存活率高,在Aβ25-35较高浓度(10 mmol/L和20 mmol/L)时差异显著(P<0.05,见图3B、图3C)。caspase-3活性检测证实,与对照组相比,静默组Neuro-2a细胞caspase-3活性降低,在Aβ25-35较高浓度(10和20 mmol/L)时差异显著(P<0.05,见图3D)。
NF-κB介导的细胞凋亡作用在AD发病机制中起重要作用[14]。我们通过观察NF-κB的活性来研究miR-139对Aβ25-35诱导的Neuro-2a细胞凋亡的影响。ELISA检测显示,Aβ25-35处理Neuro-2a细胞后,与对照组相比,静默组NF-κB浓度降低,在Aβ25-35较高浓度(10 mmol/L和20 mmol/L)时差异显著(p<0.05,见图3E)。
以上结果表明,抑制miR-139表达减弱了Aβ25-35诱导的细胞毒性和NF-κB途径的细胞凋亡,且具有Aβ25-35剂量依赖性。

A:应用不同浓度Aβ25-35(0 mmol/L,5 mmol/L,10 and 20 mmol/L) 孵育 Neuro-2a细胞,qRT-PCR检测miR-139表达情况;B:应用不同浓度Aβ25-35(0 mmol/L,5 mmol/L,10 mmol/L and 20 mmol/L) 孵育 Neuro-2a细胞,qRT-PCR检测FOXO1 mRNA表达情况;C:应用不同浓度Aβ25-35(0 mmol/L,5 mmol/L,10 and 20 mmol/L) 孵育 Neuro-2a细胞,Western blot检测FOXO1蛋白表达情况*P<0.05

A:预测的 miR-139与FOXO1 3’UTR区结合位点;B:Luciferase分析报告;C:qRT-PCR检测转染miR-139 mimic、miR-139 inhibitor以及其阴性对照到Neuro-2a细胞后FOXO1 mRNA的表达;D:Western blot方法检测转染miR-139 mimic、miR-139 inhibitor以及其阴性对照到Neuro-2a细胞后FOXO1蛋白的表达*P<0.05
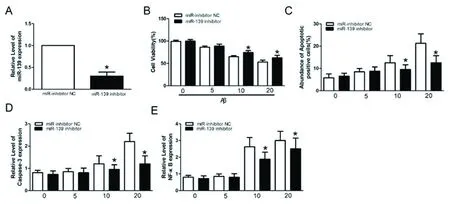
A:qRT-PCR方法检测转染miR-139 inhibitor及阴性对照物后Neuro-2a细胞中miR-139的表达;B-C:应用不同浓度Aβ25-35(0 mmol/L,5 mmol/L,10 mmol/L and 20 mmol/L) 孵育转染 miR-139 inhibitor及阴性对照物的Neuro-2a细胞24 h,CCK-8法检测细胞增殖能力;D:应用不同浓度Aβ25-35(0 mmol/L,5 mmol/L,10 mmol/L and 20 mmol/L) 孵育转染 miR-139 inhibitor及阴性对照物的Neuro-2a细胞24 h,caspase-3 法检测细胞凋亡;E:应用不同浓度Aβ25-35(0 mmol/L,5 mmol/L,10 mmol/Land 20 mmol/L) 孵育转染 miR-139 inhibitor及阴性对照物的Neuro-2a细胞24 h,ELISA法检测NF-κB水平*P<0.05
3 讨 论
Aβ诱导的神经毒性包括炎症和神经元凋亡,在AD的发病过程中起重要作用[13]。Aβ25-35被广泛用于体外和体内AD模型的诱导[15]。本研究中,我们证明Aβ25-35可引起小鼠Neuro-2a细胞中miR-139表达升高、FOXO1表达降低。并证实FOXO1是miR-139的直接作用靶点。此外,我们发现miR-139通过激活NF-κB通路,参与Aβ25-35诱导的神经细胞毒性及凋亡作用。
miR-139是一种广泛存在于人体并发挥重要作用的一种miRNA[16]。以往对miR-139的研究多集中于肿瘤领域[17]。近年来发现其在多种神经、精神系统疾病中发挥作用。Tang等研究发现,在快速老化痴呆模型小鼠SAMP8海马中,mir-139的表达明显高于对照组,海马内注射miR-139也可损害海马依赖性学习和记忆的形成。相反,在小鼠海马中下调miR-139可改善小鼠的学习和记忆功能[18]。在本研究中,我们证明Aβ25-35以剂量依赖的方式升高了Neuro-2a细胞中miR-139的表达。抑制miR-139功能减弱了Aβ25-35诱导的细胞毒性和细胞凋亡。与Tang等观察到的miR-139促进AD发生结果相一致。
在脑肿瘤的研究中发现,miR-139可直接作用于胰岛素样生长因子、过氧化物酶体增殖物激活受体γ等多个靶点参与胶质瘤的发生发展,并影响脑功能网络[19]。FOXO1基因敲除小鼠随着年龄的增长,神经元分化、增殖、存活、自我更新受损[20]。本实验发现在Neuro-2a细胞中,miR-139可直接靶向作用于FOXO1,调节后者的mRNA及蛋白表达。提示FOXO1可能是miR-139参与Aβ25-35细胞毒性作用的重要通路,miR-139通过抑制FOXO1进而影响神经元内相关基因的表达,参与AD的发生发展。接下来的功能增益实验表明,miR-139过表达还可引起Aβ25-35诱导Neuro-2a细胞NF-κB表达上调,发挥Aβ25-35介导的胞毒性和凋亡作用,说明miR-139可通过多种途径参与AD的发生及发展。
总之,我们证明Aβ25-35显著上调小鼠Neuro-2a细胞中的miR-139表达、下调FOXO1表达。此外,miR-139可分别通过直接抑制FOXO1、间接激活NF-κB发挥Aβ25-35诱导的神经毒性,从而阐明了miR-139神经毒性的分子机制。探讨miR-139作为治疗AD的潜在治疗靶点的可能性,为预防、诊断以及治疗AD提供了新的思路。
