SPAC1006.01基因敲除对裂殖酵母生长及产孢的影响
2019-02-15袁荣美丁祥谭秀梅侯怡铃
袁荣美,丁祥,谭秀梅,侯怡铃
SPAC1006.01基因敲除对裂殖酵母生长及产孢的影响
袁荣美1,丁祥2,谭秀梅1,侯怡铃1
(1.西华师范大学生命科学学院,西南野生动植物资源保护教育部重点实验室,四川 南充 637009; 2.西华师范大学环境科学与工程学院,四川 南充 637009)
为研究SPAC1006.01基因对裂殖酵母(Schizosaccharomyces pombe)生长以及孢子数目和形态的影响,将野生型与SPAC1006.01基因敲除突变株在常温及高温胁迫下培养,通过测量OD595绘制生长曲线图,看其生长是否受到影响;同时将基因敲除突变株的h+和h-菌株结合,观察其产生的孢子与野生型菌株接合产生的孢子的差异性。结果显示,在25 ℃下,野生型菌株正常生长,基因敲除突变株比野生型生长缓慢;在37 ℃下,野生型菌株生长速度加速,但基因敲除突变株仍然比野生型生长缓慢,尤其在12 h后,差别明显。产孢实验结果表明,野生型100%产生4个孢子,在基因敲除突变菌株中,有10%的菌接合产生1个孢子;30%的菌接合产生2个孢子;15%的菌接合产生3个孢子;只有45%的菌产孢正常,产生4个孢子。但两者所产孢子形态正常。实验结果表明SPAC1006.01基因能影响裂殖酵母的生长和产孢数目。
裂殖酵母;基因敲除;生长曲线;子囊孢子
SPAC1006.01基因也叫psp3,在裂殖酵母中它的表达产物为液泡丝氨酸蛋白酶psp3(预测),由451个氨基酸组成,分子量为48.73 kDa。
液泡丝氨酸蛋白酶psp3具有丝氨酸型内肽酶活性[1],可通过丝氨酸亲核体组成的催化三联体机制催化多肽链中内部α-肽键的水解;具有肽酶活性[2],在液泡中起作用,可以催化肽键的水解,参与液泡蛋白的水解加工[3]。
科学家研究发现,在psp3Δ中,由于psp3基因的缺失,会影响cnx1基因(cnx1是酵母中蛋白质编码的基因)的表达,可能影响所有蛋白质或一种或多种特定蛋白质的加工[4]。psp3Δ在营养生长期间,细胞的体积、大小和形状均是正常的,但其对化学品的敏感性增加。在野生型菌株能够生长的硼替佐米浓度下,突变株psp3Δ对硼替佐米的敏感性增加,具体表现为细胞停止生长(并可能死亡)[5]。最近的科学研究发现,psp3基因与SPAC4A8.04基因具有很高的同源性,SPAC4A8.04基因在裂殖酵母中的功能是诱导裂殖酵母孢子的形成,为进一步探究psp3基因是否也对裂殖酵母产孢有影响,本研究以突变株psp3Δ为材料,对其进行生长曲线测定和产孢实验。
1 材料与方法
1.1 材料
1.1.1 酵母菌株
本研究所使用的裂殖酵母(Schizosaccharomyces pombe)野生型和突变株psp3Δ保存于西华师范大学生命科学学院西南野生动植物资源保护教育部重点实验室,如表1所示。
表1 本研究所使用的酵母菌株
菌株敲除基因雌雄来源 PT286野生型h-实验室保存 PT287野生型h+实验室保存 108SPAC1006.01h+实验室保存
1.1.2 裂殖酵培养基及药品
裂殖酵母完全培养液YES(1 L):5 g酵母提取物(Thermo Fisher Scientific 公司),30 g葡萄糖(Thermo Fisher Scientific 公司),225 mg组氨酸(本实验所使用的氨基酸、嘌呤、嘧啶均购自Sigma公司),225 mg腺嘌呤,225 mg赖氨酸,225 mg亮氨酸,225 mg尿嘧啶,如果为固体培养基则加入17 g琼脂[6](Thermo Fisher Scientific公司)。
裂殖酵母产孢培养基EMM-N(1 L):7.32 g脱水EMM-N培养基粉末(生物风资源技术服务公司),20 g葡萄糖,20 g琼脂,225 mg亮氨酸,225 mg腺嘌呤,225 mg尿嘧啶,225 mg组氨酸,225 mg赖氨酸。
药品:PBS缓冲液(pH 4.4)、纤维素酶(阿拉丁公司)。
1.1.3 主要仪器
主要仪器:LDZX-30FA全自动压力蒸汽灭菌锅(上海申安医疗器械厂),SE-CJ-1F型超净工作台(苏州安泰空气技术有限公司),THZ-Q恒温摇床(上海百典仪器设备有限公司),Epoch酶标仪(美国基因有限公司),DPX-9272B-1电热恒温培养箱(上海福玛实验设备有限公司),AR2130电子分析天平(上海奥豪斯仪器有限公司),BCD-208K/A型﹣80 ℃冰箱(青岛海尔股份有限公司),Eppendorf移液枪(艾本德(上海)国际贸易有限公司),HHS型水浴锅(上海光地仪器设备有限公司),LD4-2A型离心机,MD50光学显微镜(OLYMPUS公司)。
1.2 实验方法
1.2.1 菌种复苏
将用无菌甘油保存于﹣80 ℃的108、PT287和PT286菌种取出;挑一小块菌液冰块,均匀涂布到YES固体培养基上,置于25 ℃恒温培养箱培养(约48 h)。
1.2.2 菌种活化
从YES固体培养基上刮取PT286和108菌体,接种至4 mL完全培养液中,置于25 ℃,120 r/min恒温摇床振荡培养过夜(约24 h);测得OD595(酶标仪)为0.5~0.8,表示菌种已经活化好。
1.2.3 生长曲线的测定
将活化好的裂殖酵母菌液稀释到OD595为0.1左右;分别置于25 ℃和37 ℃恒温摇床中培养,每2 h取200 uL菌液用酶标仪检测OD595,重复3次;收集数据,并用Excel进行处理,以培养时间为横坐标,OD595为纵坐标,绘制生长曲线[7]。
1.2.4 突变株108 h-菌株的构建
挑取活化好的PT286和108菌种,充分混合均匀后涂布在EMM-N培养基上;置于25 ℃的恒温培养箱中培养(约24 h);24 h后镜检,观察有无孢子产生。确定有子囊孢子产生后,从EMM-N固体培养基上收集子囊孢子,加入1 mL纤维素酶工作液(PBS缓冲液配制),置于37 ℃水浴锅中裂解过夜(24 h左右);镜检,观察细胞壁是否裂解完全; 3 000 r/m离心10 min,收集菌体;加入1 mL蒸馏水重悬菌体进行洗涤,3 000 r/m离心10 min,收集菌体,重复洗涤一次;将收集到的菌体均匀涂布在YES培养基上,挑取单克隆,扩大培养,再与野生型PT286接合,如果产孢,则确定其配型为h+;如果不产孢,则为h-。
1.2.5 裂殖酵母产孢及孢子形态观察
将108菌株的h+与h-接合作为实验组,野生型PT286与PT287接合作为对照组,置于25 ℃恒温培养箱培养过夜(约24 h);制片,使用光学显微镜选取不同视角观察并统计20个产孢酵母的孢子数,截取典型孢子形态图。
2 结果与分析
2.1 野生型及基因敲除突变株在25 ℃条件下的生长曲线
野生型和基因敲除突变株在25 ℃条件下生长曲线如图1所示,25 ℃条件下,0~6 h野生型和突变株108生长速度差别不明显;6 h后,野生型生长速度加快,而突变株108一直较为平缓,在12 h后,野生型OD595已经达到0.623,而突变株108仅有0.398,与野生型差别较大。
实验结果表明,在温度条件为25 ℃时,SPAC1006.01基因以及其编码的蛋白质与裂殖酵母的生长相关,基因敲除后,导致菌株生长缓慢。
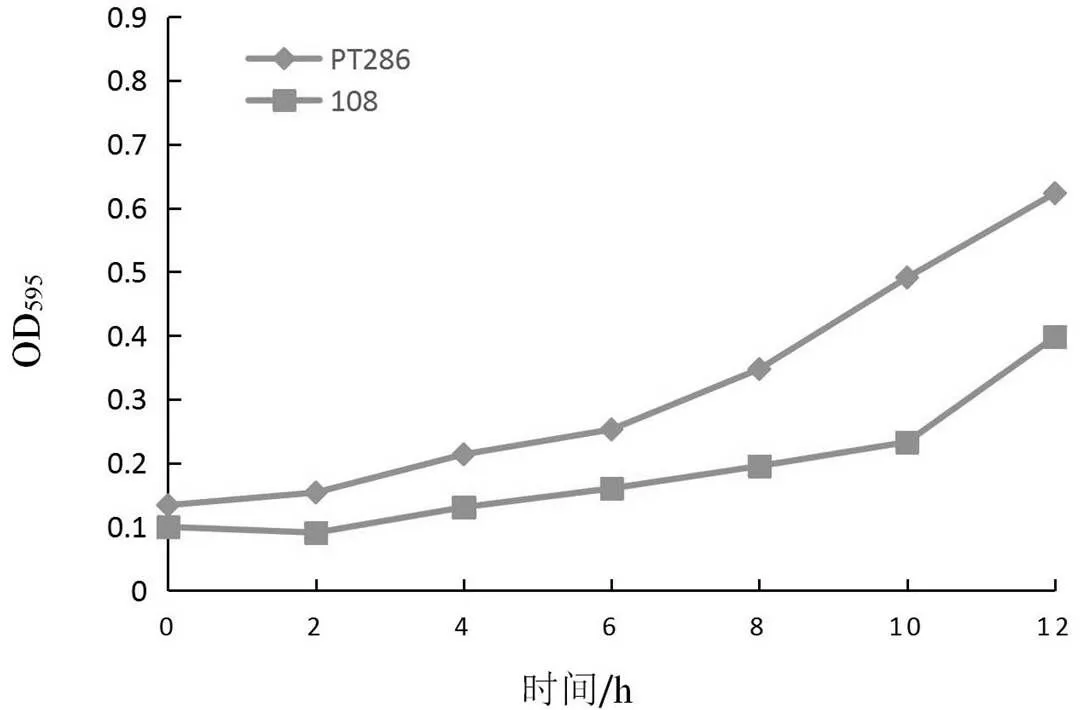
图1 野生型和基因敲除突变株在25 ℃条件下生长曲线
2.2 野生型及基因敲除突变株在37 ℃条件下的生长曲线
野生型和基因敲除突变株在37 ℃条件下生长曲线由图2所示,温度为37 ℃时,0~6 h内野生型与突变株生长趋势基本一致,6 h后野生型生长速度陡增,而突变株108生长速度一直较为平缓。尤其在12 h后,野生型菌株OD595达到了0.843 4,突变株108在12 h后OD595为0.373,与25 ℃条件下基本没有差别。
由此可知,无论是在25 ℃条件下还是在37 ℃条件下,SPAC1006.01基因及其编码的蛋白质都会影响裂殖酵母的生长,且基因敲除后,导致菌株对温度不敏感。但其具体的分子机制尚不清楚,有待进一步研究。
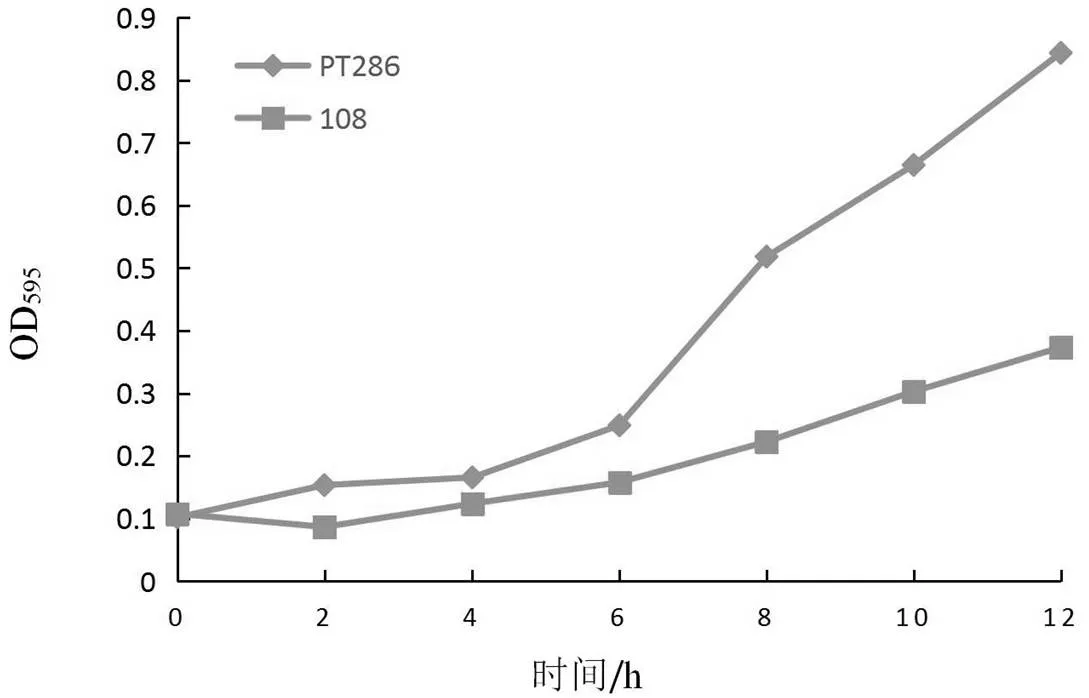
图2 野生型和基因敲除突变株在37 ℃条件下生长曲线
2.3 野生型与基因敲除突变株的子囊孢子数目及形态比较
野生型与基因敲除突变株108产生的子囊孢子数量对比如图3所示。
由图3可知,野生型菌株100%都会产生4个大小均匀的子囊孢子,而突变株108产生子囊孢子的菌中有10%产生1个孢子、30%产生2个孢子、15%产生3个孢子,只45%的菌能够正常产生4个孢子。
野生型与突变株的产孢数目对比如图4所示,野生型PT286和突变株108产生的子囊孢子形态并没有差别。实验结果说明,sps基因及其编码的蛋白质会影响裂殖酵母产生子囊孢子的数量,但不影响孢子形态。
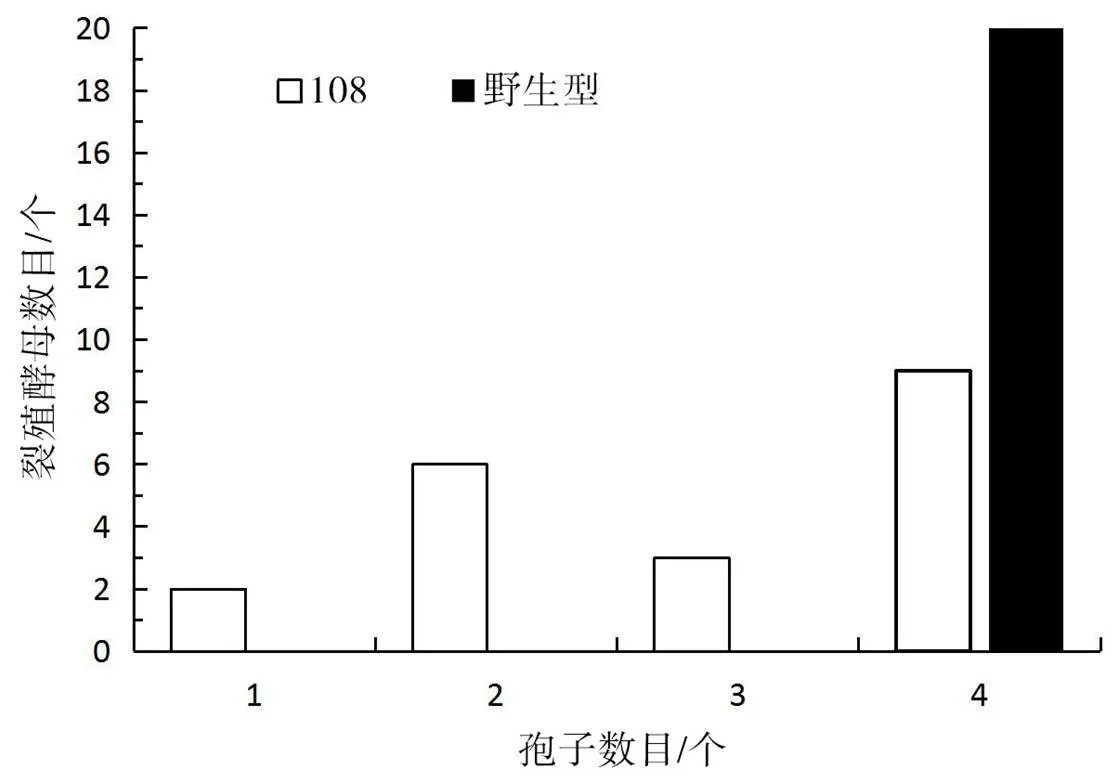
图3 野生型与突变株的产孢数目对比
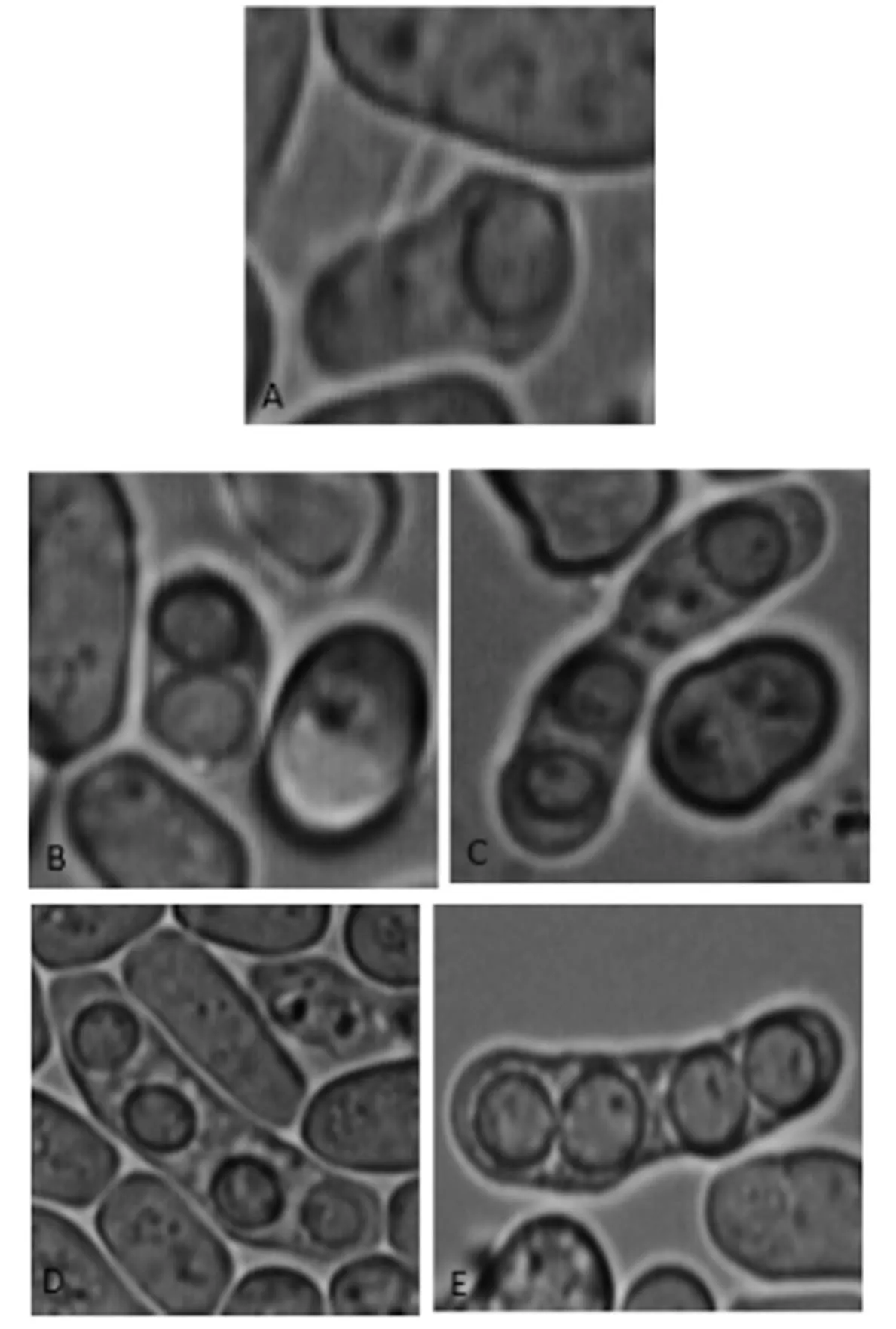
图4 野生型与突变株的孢子形态图(100×10)
注:A、B、C、D为突变株108的孢子;E为野生型的孢子
3 结论
本研究将裂殖酵母野生型的SPAC1006.01基因敲除,通过观察生长曲线,发现12 h后野生型在37 ℃的OD595比25 ℃时更高;突变株108在25 ℃和37 ℃的OD595基本没有差别,但都比野生型低。该实验结果表明,基因敲除不仅会影响菌株的生长速度,导致突变株生长缓慢,同时导致突变株对温度不敏感。在观察子囊孢子的数目和形态实验中,发现产孢菌株中有10%的菌产生1个孢子、30%产生2个孢子、15%产生3个孢子,只有45%的菌能够正常产生4个孢子,但孢子的形态没有差异。本实验结果为进一步深入研究SPAC1006.01基因影响裂殖酵母生长和产孢的具体分子机制提供了理论依据和技术支持。
[1]Ladds G,Davey J.Identification of proteases with shared functions to the proprotein processing protease Krp1 in the fission yeast Schizosaccharomyces pombe[J].Mol Microbiol,2000(4).
[2]Mukaiyama H,Iwaki T,Idiris A,et al.Processing and maturation of carboxypeptidase Y and alkaline phosphatase in Schizosaccharomyces pombe[J].Applied Microbiology & Biotechnology,2011,90(1):203-213.
[3]Núñez Andrés,Dominic D,Mehdi J,et al.Calnexin Is Essential for Survival under Nitrogen Starvation and Stationary Phase in Schizosaccharomyces pombe[J].PLoS one,2015,10(3).
[4]Kojiro T,Ayaka M,Mitsuhiro Y,et al.Identification of Genes Affecting the Toxicity of Anti-Cancer Drug Bortezomib by Genome-Wide Screening in S.pombe[J].PLoS one,2011,6(7).
[5]王文超.裂殖酵母表现遗传调控产孢及异染色质沉默的研究[D].上海:复旦大学,2014.
[6]成少宁,许先猛,马欣,等.一株优良果脯加工废糖液酒精发酵酵母菌生长条件的研究[J].漯河职业技术学院学报,2016,15(2):12-15.
2095-6835(2019)01-0001-03
Q933
A
10.15913/j.cnki.kjycx.2019.01.001
〔编辑:严丽琴〕
