泊洛沙姆188修饰聚乙烯亚胺作为基因载体的体外评价*
2019-02-14鄂晓游庆霞陈效尹东锋
鄂晓,游庆霞,陈效,尹东锋
(新疆军区总医院药剂科,乌鲁木齐 830000)
基因治疗是将外源性的功能性治疗基因递送至靶细胞,取代缺陷、突变的基因,或调节目的蛋白的表达的一种疗法。基因治疗近二十年来得到广泛的关注,据统计超过1800个基因治疗的临床实验被批准[1]。基因治疗为癌症、人获得性免疫缺陷综合征、遗传性疾病的有效治疗带来希望[2-4]。如何安全有效地将治疗基因导入到目的细胞或组织是基因治疗的关键。基因载体分为病毒载体和非病毒载体两类。病毒载体具有很高的转染效率,由于安全性的原因,包括免疫原性、插入突变性等问题,限制了病毒载体的临床应用[5]。非病毒载体的转染效率虽不及病毒载体,但具有易于制备、成本低、免疫毒性低等优势,2004—2013年,使用非病毒载体的临床实验逐年增加,而使用病毒载体的却显著下降[6]。聚乙烯亚胺(polyethyleneimine,PEI)是最常用的非病毒载体之一,分子中含有高密度的胺基基团,可产生“质子海绵”作用,使PEI与DNA所形成的复合物从内涵体中逃逸出来,进入细胞核,表现出较高的转染效率。PEI的转染与其相对分子质量密切相关,随着相对分子质量的增加,其转染效率也增高,但其细胞毒性也随之增大,同时PEI/DNA复合物胶体稳定性较差,易在体液环境中发生聚集,被网状内皮系统所清除,限制PEI的临床应用[7]。笔者在本研究使用泊洛沙姆188(poloxamer 188,P188)修饰高相对分子质量PEI,P188是两亲性嵌段共聚物,平均相对分子质量为8350,包含亲水性的聚氧乙烯基团和疏水性的聚氧丙烯基团,毒性很低,作为乳化剂可静脉使用,并显著提高胶体的稳定性。文献[8]报道采用平均相对分子质量为11 500的泊洛沙姆407,但P188相对分子质量小,与细胞亲和力好,转染相率相对较高,因此将P188末端羟基活化后,化学联接到PEI分子上,考察其作为基因载体的可行性。
1材料与仪器
1.1细胞 MCF-7细胞(批号:161110)、HeLa细胞(批号:170122)、HepG2细胞(批号:160611)均购自南京凯基生物科技发展有限公司。于含有10%胎牛血清、100 U·mL-1青霉素和100 μg·mL-1链霉素的达尔伯克改良伊格尔培养基(Dulbecco's modified eagle's medium,DMEM)中培养,培养基置于37 ℃、相对湿度90%、5%二氧化碳(CO2)的培养箱中。
1.2药品与试剂 泊洛沙姆188(P188,德国BASF公司,批号160323);PEI(美国Sigma-Aldrich公司,批号:171023);4-甲氧基氯化三苯甲烷(上海韶远科技有限公司,批号:R1411185);三光气(上海韶远科技有限公司,批号:R1502028);N-羟基琥珀酰亚胺(上海韶远科技有限公司,批号:R1412263);质粒DNA(KD,批号:170912);噻唑蓝(MTT,上海碧云天生物技术有限公司,批号:170628);DMEM(Thermo公司,批号:171011)、磷酸盐缓冲液(Thermo公司,批号:170818);胎牛血清(Gibco公司,批号:170526);胰蛋白酶(Thermo公司,批号170628);二甲亚砜(DMSO,美国Sigma-Aldrich公司,批号:161223);质粒pGL3(美国Promega公司,批号:170306)。
1.3仪器与设备 旋转蒸发器(RE2000B,上海亚荣生化仪器厂);纳米粒度电位仪(Zetasizer Nano ZS90,英国马尔文公司);CO2培养箱(BC-J80S,上海博迅实业有限公司);DNM-9602酶标分析仪(北京普朗新技术有限公司);磁共振波谱仪(型号:Mercury Plus 300MHz,美国Varian公司);化学发光检测仪(型号:GloMax 96,美国Promega公司);凝胶成像分析系统(型号:Tanon 2500R,上海天能科技有限公司)。
2 方法与结果
2.1方法
2.1.1PEI的修饰 P188约1 mmol(8.350 g)在50 ℃下真空干燥,溶解在无水吡啶40 mL中,加入4-甲氧基三苯基氯甲烷0.308 g(1 mmol),在氮气保护、25 ℃下磁力搅拌反应4 h,反应液旋转蒸发后以二氯甲烷20 mL溶解,经硅胶柱纯化,蒸干洗脱液得到淡黄色产物(收率78.3%)。
将上述产品(4.310 g,约0.5 mmol)以甲苯-二氯甲烷(3:1)混合溶剂40 mL溶解,加入三光气0.149 g(0.5 mmol),25 ℃下磁力搅拌,反应液经旋转蒸发后以甲苯和二氯甲烷(2:1)的混合溶剂30 mL溶解,加入N-羟基琥珀酰亚胺0.060 g (0.5 mmol)和无水三乙胺0.071 mL(0.5 mmol),磁力搅拌反应4 h,反应液滤过后,旋转蒸发,再以二氯甲烷10 mL溶解,经过硅胶柱纯化,得到产物(收率83.6%)。
将6份PEI 0.250 g(0.01 mmol)以10%乙醇溶液溶解,分别加入上述活化后的P188(0.01,0.02,0.05,0.1,0.2 mmol),25 ℃下磁力搅拌,脱去保护基团,将反应液pH值调至中性,采用葡聚糖凝胶色谱柱分离纯化产物,再使用超滤管(MWCO=10000)进一步纯化,纯化后的产物(收率52.7%)经冷冻干燥后置于-20 ℃下备用。将纯化后的最终产物溶解到D2O中,进行1H-NMR分析。合成的新聚合物命名为(P188)1-PEI,(P188)2-PEI、(P188)5-PEI、(P188)10-PEI、(P188)20-PEI,其中下标数字1,2,5,10,20代表该聚合物中每个PEI联接的P188的数目。
2.1.2凝胶电泳分析 取适量质粒DNA和PEI以及(P188)n-PEI分别以5%葡萄糖溶液(pH值7.5)溶解,配制成适当浓度,将聚合物溶液逐滴加入到等体积DNA溶液中,室温孵育20 min,制成不同N/P值的复合物。将上述制得复合物分别上样,进行电泳分析,电泳条件:1.0%琼脂糖,1×TAE缓冲液,电压100 V,电泳时间60 min。紫外透射仪观察并摄像。
2.1.3复合物粒径和Zeta电位测定 取上述制备的不同N/P值的复合物适量,加入超纯水稀释,使用纳米粒度电位仪测定复合物的粒径和Zeta电位。
2.1.4细胞毒性测定 分别将对数生长期的MCF-7细胞、HeLa细胞、HepG2细胞以每孔1.2×105个的密度接种到96孔板中,加入DMEM,每孔 1 mL,培养24 h,使细胞汇合度达到70%~80%。实验前,吸去培养基,每孔加入不同N/P值为3,6,12,24,48的复合物20 μL,孵育6 h后换含有10%胎牛血清的DMEM,继续培养24 h,吸去培养基,加入0.5 mg·mL-1MTT 100 μL,37 ℃孵育4 h。吸取上清液,加入DMSO200 μL,振荡10 min,492 nm波长处测定吸收值(A)。以未经处理的细胞作为对照(100%)。细胞相对活性的计算公式为:细胞活性 (%)=A实验/A对照×100%。
2.1.5体外转染实验 转染前一天用0.25%胰酶消化HeLa细胞,均匀接种在24孔板上,每孔加入DMEM 1 mL,培养24 h,使HeLa细胞汇合度达到70%~80%。转染前,换上无血清DMEM,加入新鲜配制的复合物100 μL,含pGL3-Control质粒3 μg,每种复合物平行实验3次,轻轻摇动24孔板使复合物铺匀,孵育4 h后换含有10%胎牛血清的DMEM,继续培养。细胞转染后48 h,弃去培养基,PBS漂洗2次,加冰浴的CCLR细胞裂解液100 μL覆盖细胞,温和振摇培养液15 min,收集裂解液,14 000 r·min-1离心5 min。取上清液5 μL,加入虫荧光素测定液100 μL于化学发光测定小杯中,混匀,用虫荧光素酶分析系统立即测定10 s内虫荧光素酶活性的计数,其中计数用相对光单位(relative light unit,RLU)表示。BCA法测定裂解液中细胞蛋白总量,以此校正由于每孔细胞之间密度不同而导致的虫荧光素酶表达量的差异,最终以每毫克细胞蛋白的相对光单位来表示虫荧光素酶的活性。

2.2结果
2.2.1聚乙烯亚胺的修饰 P188修饰PEI时,首先将P188一端羟基使用4-甲氧基三苯基氯甲烷保护,再将另一端未保护的羟基活化成琥伯酰亚胺碳酸酯,与PEI的胺基端联接,再经脱保护和凝胶色谱纯化,得到新的阳离子聚合物,反应路线见图1。新聚合物的典型1H-HMR谱见图2。-CH2CH2O-的质子峰在δ3.5~3.9 ppm,-CH2CH2NH-的质子峰在δ2.8~3.5 ppm,-CH3的质子峰在δ1.2~1.3 ppm。根据1H-NMR谱中-CH2CH2O-(P188)和-CH2CH2NH-(PEI)的质子峰面积,计算新聚合物中两者比例,结果见表1。
2.2.2凝胶电泳分析 带有负电荷的DNA分子在电场作用和中性pH缓冲液条件下,可通过琼脂糖凝胶从负极向正极泳动,当阳离子聚合物与DNA分子通过电荷作用牢固结合后,可阻滞DNA分子在凝胶中的迁移。图3为不同N/P值时复合物的凝胶电泳阻滞图,随着PEI修饰度的增加,即每个PEI分子联接P188数目的增多,(P188)n-PEI与DNA完全结合的N/P值也随之增大。PEI/DNA,(P188)1-PEI/DNA和 (P188)2-PEI/DNA复合物在N/P值为3时,聚合物即可以完全结合DNA。而(P188)5-PEI/DNA,(P188)10-PEI/DNA,(P188)20-PEI/DNA复合物分别在N/P值为6,8,18时,P188-PEI才可以完全结合DNA,阻止其在琼脂糖凝胶中的迁移。
2.2.3复合物粒径和Zeta电位 复合物的粒径及Zeta电位测定结果见表2和表3。随着复合物N/P值的增加,复合物的粒径有减小的趋势,这是因为随着PEI量的增加,对DNA的压缩能力增强。高修饰度的(P188)n-PEI(n=5,10,20)所形成的复合物粒径偏大,可能是因为对DNA的压缩能力有所下降所致。未经修饰的PEI与DNA形成的复合物在N/P值为48时,可以观察到明显的聚集现象。复合物Zeta电位随N/P值的增加而增加,这是因为随着PEI量的增加正电荷增加所致。相同N/P值复合物的Zeta电位随着P188修饰量的增加而减小,这是由于P188遮蔽PEI的正电荷所致。
2.2.4细胞毒性 复合物对细胞的毒性与细胞株有一定的依赖性,对MCF-7细胞毒性最大,HeLa细胞次之,HepG2细胞最小。随着N/P值增加,复合物对3种细胞的毒性也增加。(P188)n-PEI与PEI相比,在低N/P值时即可显著降低对3种细胞的毒性;高N/P N/P值时,高修饰的(P188)n-PEI(n=5,10,20)可显著地降低细胞毒性。随着(P188)n-PEI相对分子质量和亲水性的增加,可以大大降低细胞毒性,特别是MCF-7细胞。P188对PEI的修饰可以显著地降低其细胞毒性,这是因为使用表面活性剂P188对PEI修饰后可以屏蔽PEI表面的正电荷,可以降低细胞膜表面的电荷密度,避免细胞死亡。但是这种屏蔽作用会使复合物对细胞的亲合力下降,可能会引起转染效率降低。见图4。
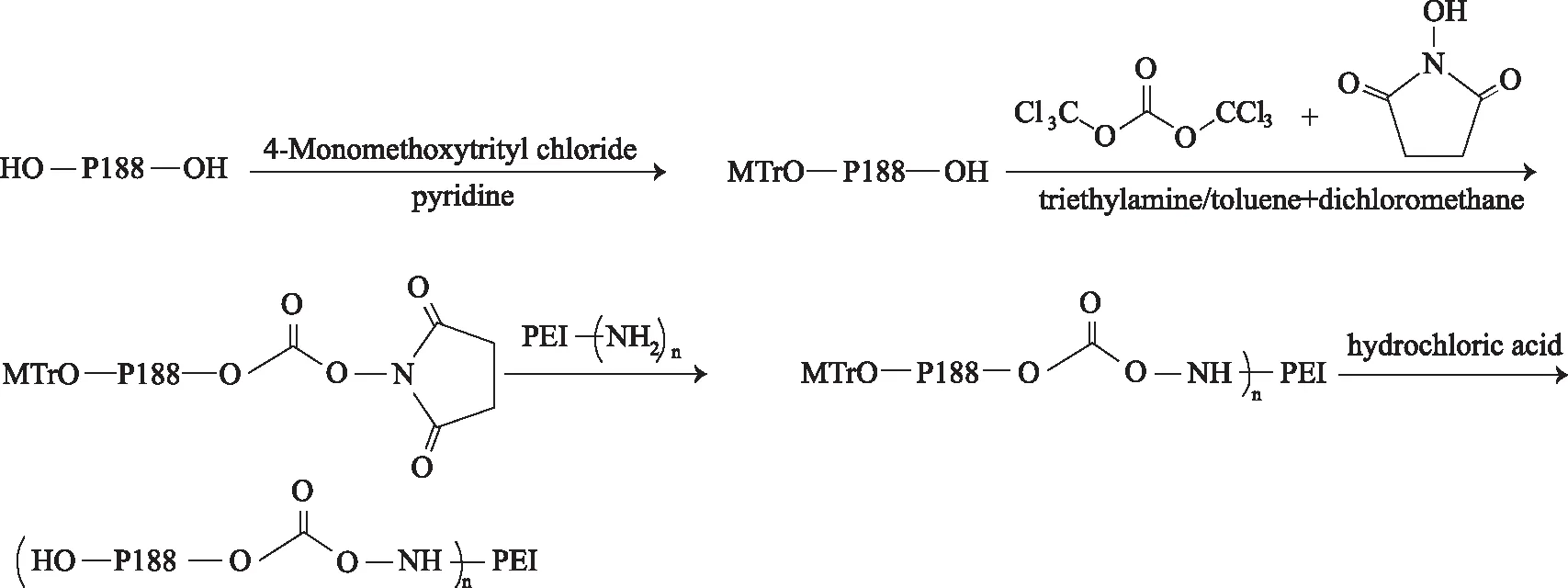
图1 反应路线图(n=1,2,5,10,20)
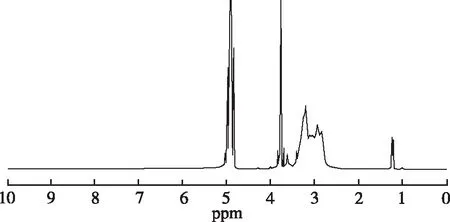
图2 聚合物的1H-NMR谱
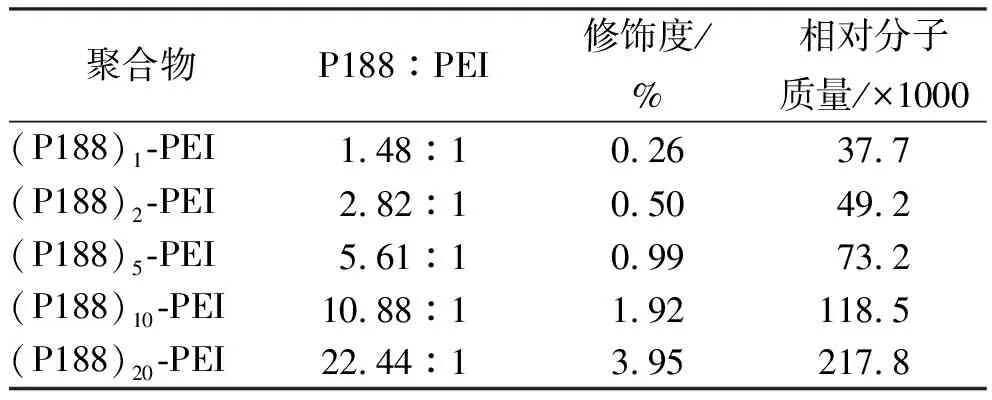
表1 聚合物的性质
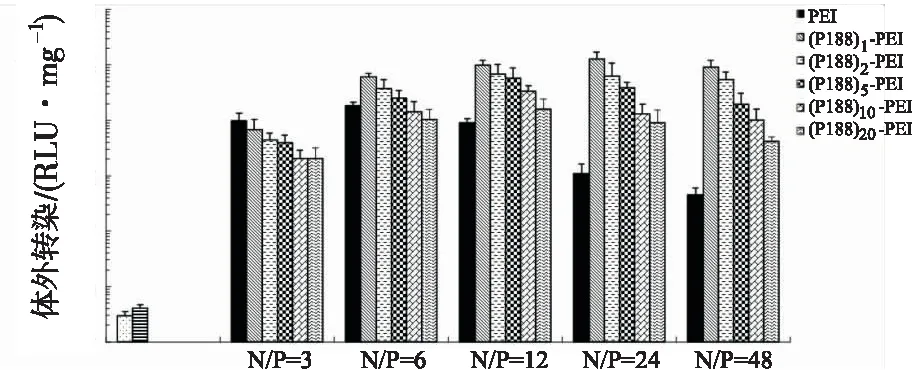
2.2.5体外转染实验转染实验结果 见图5,未经修饰的PEI在N/P=6时其转染效率最佳,随着N/P值的提高(N/P≥6),PEI的转染效率逐渐降低,特别是N/P=48时,转染效率只有最佳转染效率的2.5%。而(P188)n-PEI在N/P=3值时,转染效率显著较低;在N/P=12和N/P=24时,可以保持较高的转染效率,特别是(P188)1-PEI其最佳转染效率(N/P=24时)显著高于PEI的最佳转染效率(P<0.01)。特别是在高N/P值(N/P=48)时,(P188)n-PEI都显现出较好转染效率。
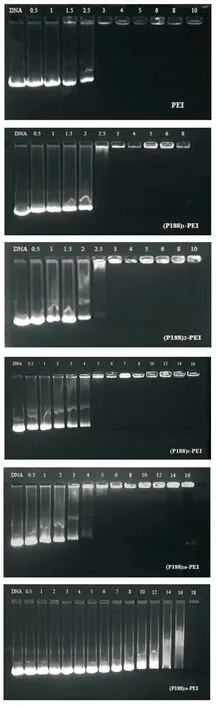
图3PEI/DNA和(P188)n-PEI/DNA复合物不同N/P值时凝胶电泳图
Fig.3GelelectrophoresisofPEI/DNAand(P188)n-PEI/DNAcompoundatvariousN/Pratio
表2 复合物在不同N/P值时的粒径
Tab.2 Particle sizes of the compound of various N/P ratios
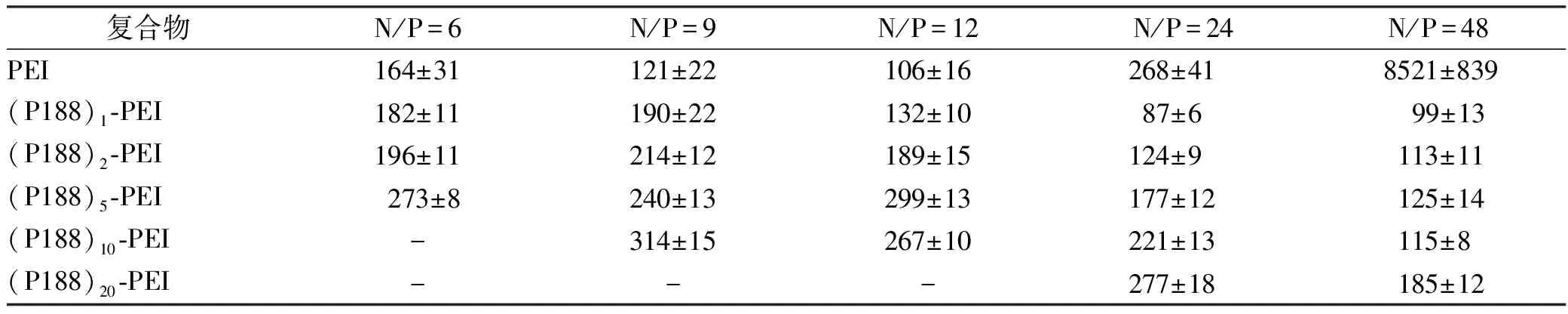
表2 复合物在不同N/P值时的粒径
复合物N/P=6N/P=9N/P=12N/P=24N/P=48PEI164±31121±22106±16 268±41 8521±839(P188)1-PEI182±11190±22132±10 87±6 99±13(P188)2-PEI196±11214±12189±15 124±9 113±11(P188)5-PEI273±8240±13299±13 177±12 125±14(P188)10-PEI-314±15267±10 221±13 115±8(P188)20-PEI--- 277±18 185±12
“-”由于阴离子聚合物和DNA结合率低未检测出
“-” not determined due to low binding of cationic polymer to DNA
表3 复合物在不同N/P值时Zeta电位
Tab.3 Zeta-potential of the compound at various N/P ratios
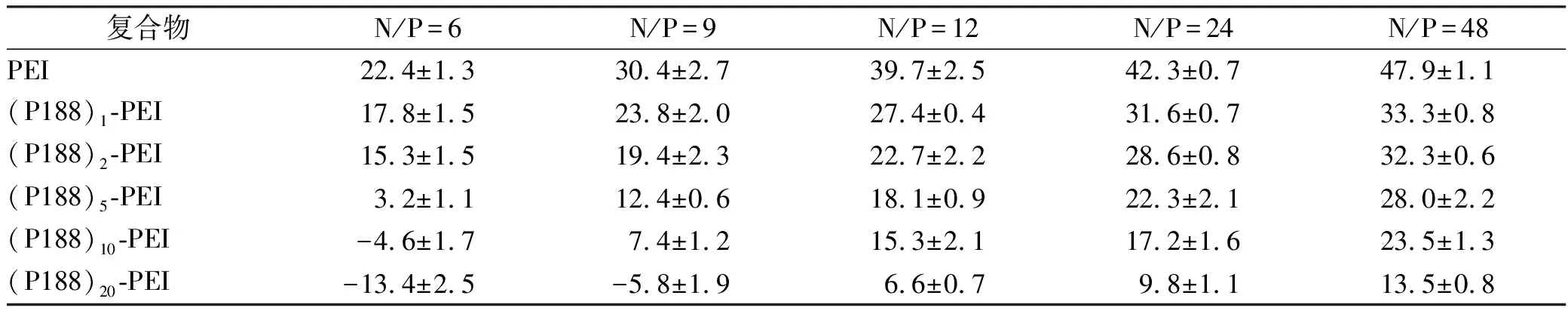
表3 复合物在不同N/P值时Zeta电位
复合物N/P=6N/P=9N/P=12N/P=24N/P=48PEI22.4±1.330.4±2.739.7±2.542.3±0.747.9±1.1(P188)1-PEI17.8±1.523.8±2.027.4±0.431.6±0.733.3±0.8(P188)2-PEI15.3±1.519.4±2.322.7±2.228.6±0.832.3±0.6(P188)5-PEI3.2±1.112.4±0.618.1±0.922.3±2.128.0±2.2(P188)10-PEI-4.6±1.77.4±1.215.3±2.117.2±1.623.5±1.3(P188)20-PEI-13.4±2.5-5.8±1.96.6±0.79.8±1.113.5±0.8
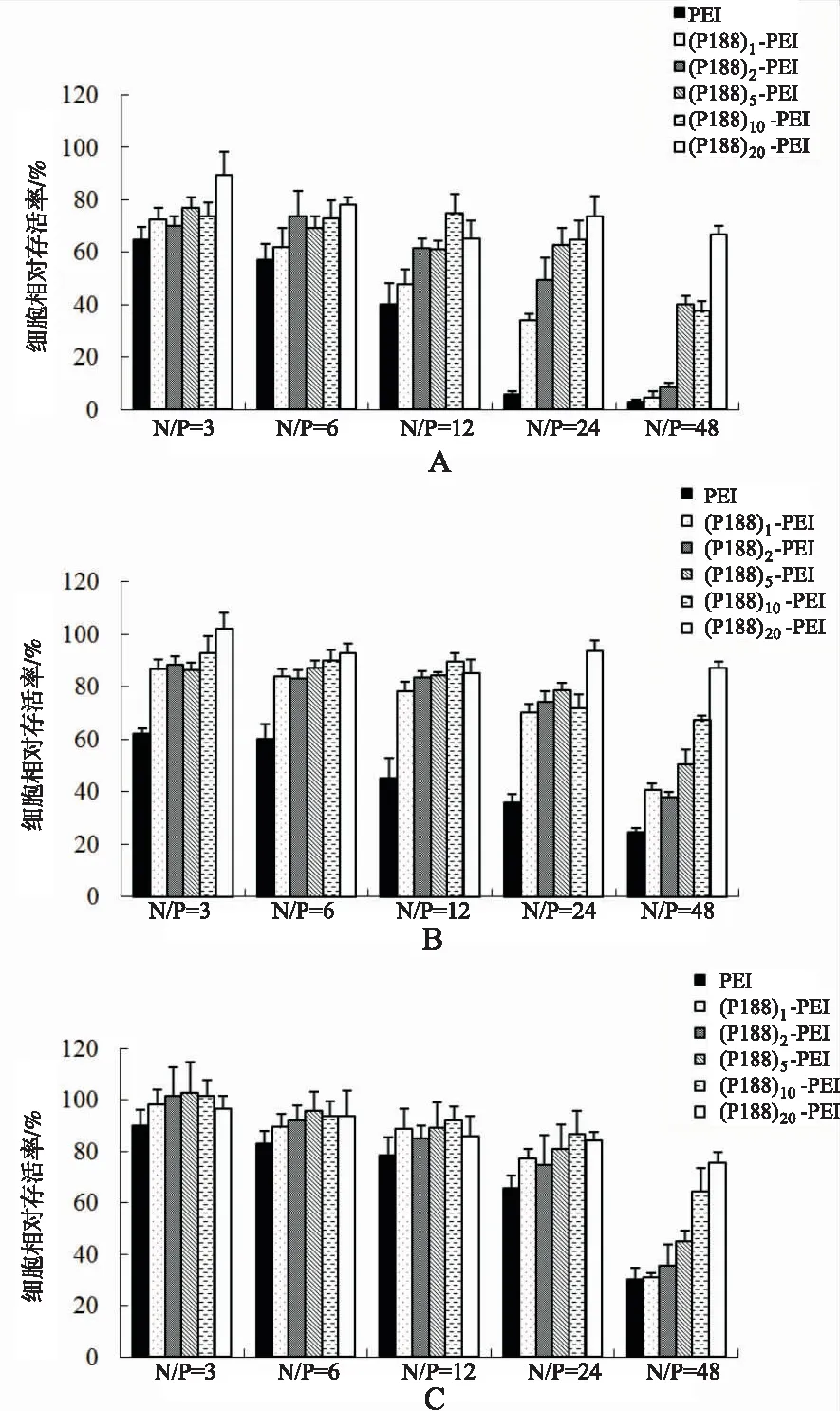
A.MCF-7细胞;B.HLa细胞;C.HepG2细胞
A: MCF-7 cells; B: HeLa cells; C: HepG2 cells
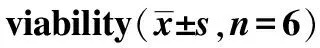
3 讨论
笔者在本实验先将非离子表面活性剂P188的一端羟基保护,采用琥珀酰亚胺酯法将另一端羟基进行活化,活化后的产物可以在温和的条件下与PEI的氨基快速和充分地反应,最后脱去保护基团,得到新的聚合物(P188)n-PEI(n=1,2,5,10,20),其在生理条件下比较稳定,不易发生水解。

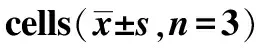
本实验制备的复合物的粒径大多都在60~400 nm范围内,大部分文献所报道用于体内外转染实验的复合物粒径均在此范围[9-10]。复合物Zeta电位随着N/P值的增加而增加,这是因为随着阳离子聚合物用量的增加,复合物所带正电荷也相应增加;在相同N/P值时,复合物Zeta电位随着P188修饰量的增加而减小,这是因为较多的P188遮蔽PEI的正电荷。高的Zeta电位会造成较强的细胞毒性,这是因为复合物表面的正电荷聚集在细胞膜表面,引起细胞膜破裂。随着N/P值的提高,复合物的细胞毒性随之增加,PEI表现尤为明显,而 (P188)n-PEI由于P188遮蔽了复合物的正电荷,其毒性显著减小,特别是高修饰度的(P188)n-PEI(n=10或20)。
体外转染实验表明,PEI/DNA复合物在高N/P值(N/P=24,48)时,由于较高的细胞毒性,造成细胞的大量死亡,其转染效率很低,而(P188)n-PEI /DNA复合物则在高N/P值时可以保持较高的转染效率。对PEI的修饰,必须做好细胞毒性和转染效率之间的平衡,修饰物可以遮蔽PEI表面的正电荷,降低复合物的Zeta电位,减小细胞毒性,同时减少了复合物被细胞的摄取,降低了转染效率[11-12]。本实验制备的(P188)1-PEI既降低了PEI细胞毒性又在高N/P值保持了很高的转染效率,预期(P188)1-PEI可以携带更多量的基因进行体内转染。
