坏疽性脓皮病伴溃疡性结肠炎继发肛瘘一例
2019-02-14杜小燕李玲
杜小燕,李玲
坏疽性脓皮病(PG)是中性粒细胞聚集的溃疡性皮肤病,多与系统性疾病有关,最常见的是炎性肠病、关节炎、恶性肿瘤。PG在炎性肠病的肠外表现中比较罕见,占0.4%~2%[1-2]。目前,有关PG的病因及发病机制尚不明确。治疗上多采用糖皮质激素联合免疫抑制剂。本文报告1例坏疽性脓皮病伴溃疡性结肠炎继发肛瘘的患者,糖皮质激素联合免疫抑制剂治疗效果不明显,改用生物制剂后反应良好,随访6个月无复发。
1 病例报告
患者 男,59岁。主因间断发热伴全身散在脓疱1周,于2016年9月27日入院。患者入院前1周无明显诱因出现间断发热,发热无规律性,无典型热型,体温波动在38~39℃,伴全身散在脓疱(主要累及头面部、背部及四肢)且不随体温变化增减,伴腰痛,无寒战、关节肿痛等表现,无咳嗽、咳痰,无胸闷、憋气,无腹胀腹痛,无尿急、尿频、尿痛,就诊于当地诊所,予退热治疗(具体不详),仍间断发热,未予重视。患者自发病以来大便次数多,3~4次/d,量少,不成形,为黏液血便,体质量减轻5 kg。既往史:溃疡性结肠炎3年,未规律服药。高血压1年,口服替米沙坦、罗布麻叶治疗,血压控制可。否认家族遗传病史。
入院查体:神志清,体温38℃,心率80次/min,血压140/80 mmHg(1 mmHg=0.133 kPa)。头面部、后背及四肢散在脓疱,无破溃流脓;心肺未见异常;腹平软,无压痛、反跳痛,未触及包块;脊柱无压痛、叩击痛。右脚面略肿,压痛,四肢肌力正常,生理反射存在,病理反射未引出。血常规:白细胞计数(WBC)12.9×109/L,中性粒细胞0.827,血红蛋白浓度 119 g/L,血小板计数527×109/L。尿常规正常。大便常规:潜血阳性,红细胞>40个/HP。生化:葡萄糖6.66 mmol/L,白蛋白35.1 g/L,谷氨酰转移酶(GGT)265 U/L,碱性磷酸酶(ALP)170 U/L,丙氨酸转氨酶(ALT)72 U/L,天冬氨酸转氨酶(AST)29 U/L。肾功能正常。血凝检测:血浆纤维蛋白原5.26 g/L,D-二聚体定量1.22 mg/L;抗核抗体(ANA)、抗核抗体谱(ENA)、抗中性粒细胞胞浆抗体谱(ANCA)均阴性;免疫球蛋白、补体C3、C4正常;HLA-B27(-);红细胞沉降率(ESR)54 mm/1 h;C反应蛋白(CRP)125.4 mg/L;三次血培养、咽拭子培养+药敏、脓液培养+药敏未见异常,降钙素原检测定量0.06 ng/L;甲、乙、丙、戊型肝炎未见异常,结核感染T细胞培养、艾滋病、梅毒、快速血浆反应素均未见异常;嗜肺军团菌血清Ⅰ型IgM(+);肿瘤标志物正常。胸部CT示双侧胸膜肥厚。腹部、盆腔CT示直肠肠壁增厚、轻度脂肪肝、肝左外叶小囊肿、腹膜后淋巴结肿大;双侧骶髂关节CT示双侧骶髂关节退行性变。结肠镜示(图1)直肠肿物最大直径6 cm,性质待查;肠镜病理活检(图2a):黏膜大量中性粒细胞和淋巴细胞浸润,淋巴组织增生,伴坏死和肉芽组织形成;Masson染色示黏膜肌;免疫组化:Ki-67阳性率46%,CD20(+),CD3(+),CK(腺上皮阳性),CD21(FDC网阳性)。初步诊断:(1)感染性发热。(2)结缔组织病?(3)溃疡性结肠炎。
治疗经过:予哌拉西林他唑巴坦4.5 g静脉输液,每8 h 1次(q8h)抗感染,美沙拉嗪1 g口服,每天3次(three times daily,tid),联合沙利度胺50 mg口服,每晚1次(quaque nocte,qn)等治疗。患者仍间断发热,体温最高40℃,皮损未见改善,有黏液血便,10月2日夜间,患者突发便血400 mL,血压87/47 mmHg,心率80次/min,急测血常规:白细胞计数14.08×109/L,中性粒细胞0.807,血红蛋白84 g/L,红细胞压积0.249,血小板计数470×109/L。生化:肌酐66µmol/L,白蛋白25.5 g/L,GGT 267 U/L,ALP 163 U/L,ALT 73 U/L,AST 19 U/L,予局部纱布填塞压迫止血,对症补液。患者仍间断发热,体温最高38.9℃,下腹部、臀部新生脓疱,头面部、背部脓疱明显扩大,破溃,局部分泌物多,考虑覆盖Pseudomonas菌(MASA),改用利奈唑胺0.6 g静脉输液,每12 h 1次(every 12 hours,q12h)抗感染,甲泼尼龙40 mg静脉输液,q12h抗炎。1周后患者无发热,停利奈唑胺。患者全身散在脓疱,破溃,周缘红晕,有脓性分泌物,新鲜皮损取活检,病理示:急性炎性渗出坏死,脓肿形成,鳞状上皮假上皮瘤样增生显著,伴不典型增生(图2b)。免疫组化:P53零星阳性,P16部分阳性。加用甲氨蝶呤10 mg口服,每周1次(once a week,qw),沙利度胺加量50 mg,每天2次(two times daily,bid),甲泼尼龙改为20 mg静脉输液,q12h。10月17日患者再次出现脓血便,约100 mL,腹部、腰部新生红色皮疹,复查肠镜示直肠炎性改变伴多发假性息肉形成(克罗恩病待除外);病理示黏膜慢性炎症伴糜烂,局灶肉芽组织及急性渗出物,局部淋巴组织增生(图2c);免疫组化示CD20部分阳性,CD3部分阳性。CD21显示FDC网,Ki-67阳性细胞分布基本正常。患者黏液血便减少,皮损较前好转,激素改为甲泼尼龙32 mg口服,qd,其余治疗不变。10月22日患者肛周出现大小约3 cm×2 cm包块,查腔内超声示肛周脓肿;盆腔磁共振示肛周脓肿,伴周围感染性病变,直肠壁弥漫性环形增厚,考虑炎性肠病。10月26日予肛周脓肿切开引流,比阿培南0.6 g静脉输液,q12h抗感染,局部伤口换药联合甲泼尼龙抗炎,免疫抑制剂调节免疫治疗。1周后复查血常规:白细胞计数9.83×109/L,中性粒细胞百分比0.802,血红蛋白101 g/L;CRP 20.2 mg/L,治疗有效,停比阿培南,调整激素20 mg,qd;美沙拉嗪1 g,tid;沙利度胺50 mg,bid;甲氨蝶呤10 mg,qw。11月9日患者好转出院,嘱其继续口服上述药物治疗并定期肛周换药。
预后:激素联合免疫抑制剂持续治疗2个月,患者周身散在脓疱未见继续减少,皮损处愈合较慢,复查直肠彩超示多发肛瘘,预后不良,2017年1月23日患者再次住院,予静脉注射英夫利西单抗5 mg/kg,皮肤脓疱消失,肛周症状明显改善后出院,激素减量,并继续口服其他药物。于出院后2周、6周及8周间断英夫利西单抗5 mg/kg治疗,患者皮肤、肠道异常表现逐渐消失。电话随访半年未复发。

Fig.1 Colonoscopy of a patient with gangrenous pyoderma and ulcerative colitis图1 坏疽性脓皮病伴溃疡性结肠炎患者肠镜图像
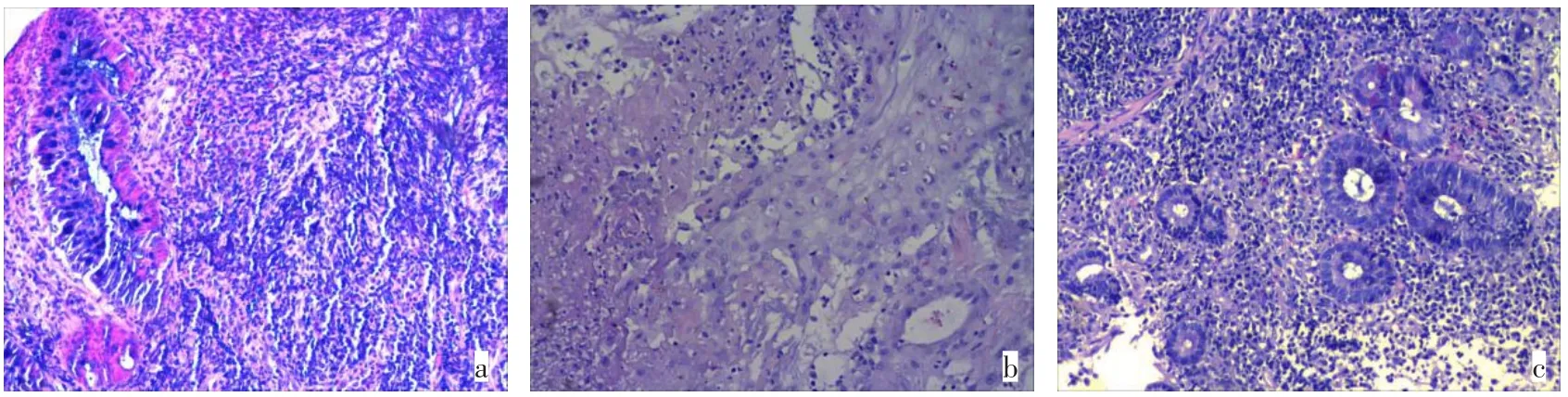
Fig.2 Pathological image of the patient(HE,×100)图2 患者病理图像(HE,×100)
2 讨论
PG诊断的主要依据是临床表现,典型皮损初起为无菌性丘疹、脓疱、水疱或结节,可很快发展成疖肿样损害,中心发生坏死,且坏死灶迅速增大,最终形成坏死性和黏液脓性溃疡,伴有弧型或不规则型、淡紫色、呈潜行性破坏的溃疡边缘。血清学检查无特异性,一般炎症指标会升高;皮肤病理活检包括中性粒细胞、单核巨噬细胞浸润、溃疡、出血、坏死及纤维化,但需排除其他疾病,如皮肤结核、深部真菌病、血管炎等[3-5]。本例患者初起发热伴周身散在脓疱,后逐渐扩大破溃、周缘红晕,有脓性分泌物,3次血培养阴性,皮肤分泌物培养阴性,未见感染灶,故排除感染相关皮损;患者未见上、下呼吸道受累表现,无肾脏损害,未闻及血管杂音,ANA、ENA、ANCA均阴性,肿瘤标志物未见异常,结合影像学检查排除系统性血管炎、肿瘤相关病变;结合患者溃疡性结肠炎(Ulcerative colitis,UC)病史,皮肤病理活检结果,确诊为PG。
目前,临床认为糖皮质激素是治疗PG最有效的药物,因其易于复发,多联合免疫抑制剂。Bister等[6]研究显示,PG皮肤活检样本中有肿瘤坏死因子-α(Tumour necrosis factor-α,TNF-α)在纤维母细胞、巨噬细胞和中性粒细胞中表达情况,这为生物制剂用于PG提供了依据。Brooklyn等[7]一项随机对照研究比较了生物制剂与安慰剂治疗PG的疗效,PG对生物制剂与安慰剂的反应率分别为69%、21%,PG对于生物制剂反应良好。对中重度UC及克罗恩病(Crohn`s disease,CD)患者,生物制剂可起到诱导和维持缓解作用、减少或减停激素的应用、促进黏膜愈合及提高患者生活质量的目的。抗TNF-α单克隆抗体治疗炎性肠病专家共识(2017)指出,CD合并肠皮瘘、肛瘘或直肠阴道瘘经传统治疗无效者,复杂肛瘘经充分外科引流和抗感染治疗,建议早期应用抗TNF-α药物;活动性UC伴突出肠外表现(如关节炎、PG、结节性红斑等)者可应用抗TNF-α药物[8]。
UC合并PG患者的治疗以糖皮质激素联合免疫抑制剂为首选方案,如果不能快速缓解病情,建议使用英夫利西[4-5,9]。Regueiro等[10]进行了一项多中心回顾性分析,结果证实英夫利西治疗炎性肠病相关的PG是一种安全、有效的治疗方案。Agarwal等[11]对生物制剂治疗炎性肠病伴随PG进行的研究发现,患者对英夫利西和阿达木单抗的反应率达92%,生物制剂治疗UC合并PG疗效佳。国内关于英夫利西治疗PG合并UC的报道不多,李芸等[12]成功治疗1例PG伴UC的患者,该患者激素减停过程中UC反复发作伴PG,应用英夫利西4次后肠道症状、皮损均改善。徐定婷等[5]成功治疗1例UC合并PG的患者,该患者初起应用糖皮质激素好转出院,复发后再用激素创面改善不理想,应用英夫利西后创面愈合,未见复发。江燕云等[13]在8例UC并发PG的研究中发现,2例应用英夫利西病情好转。以上研究表明英夫利西在UC合并PG患者的治疗中具有重要作用。
本例患者PG伴UC,初期治疗方案为糖皮质激素联合免疫抑制剂,持续治疗2个月余,患者症状曾一度好转,但并未持续缓解,后期出现多发肛瘘,说明激素联合免疫抑制剂效果不佳,查阅相关文献,结合“抗TNF-α单克隆抗体治疗炎性肠病专家共识”意见,综合评估患者病情后,改用英夫利西治疗,第1次治疗后效果明显,经间隔第2、6、8周治疗患者皮肤、肠道症状完全消失,随访半年无复发。
据笔者所查,本例患者可能为国内首次报道的应用英夫利西成功治疗PG伴UC继发肛瘘的患者,与之前报道相比,本例患者初期激素联合免疫抑制剂治疗皮损有所改善,但持续治疗皮损未见继续减少,并出现多发肛瘘,提示传统治疗效果不佳,改用英夫利西后效果显著。若本例患者在病情稳定后就改用生物制剂,那么患者是否会被治愈,不出现肛瘘,现已无从考证,提示临床医生在遇到难治性PG伴UC患者时,应及早考虑应用生物制剂。
