首发抑郁症患者CYP2D6基因位点rs1065852多态性、炎症因子和单胺类神经递质变化临床意义
2019-02-13
抑郁症是一种常见的疾病,临床调查显示其发病率呈不断上升趋势,严重影响人们生活质量,早期诊断和治疗抑郁症尤为重要[1,2]。CYP2D6是被广泛研究的一种具有多态性的药物代谢酶,很多抗精神病药物均为CYP2D6的作用底物。近年来研究发现,炎症因子与抑郁症发生、发展具有一定的相关性,抑郁症患者炎症通路被激活,如细胞因子、黏附分子和趋化因子等,可作为抑郁症的生物标志物,越来越受到研究者关注[3,4]。研究发现,大脑皮质、海马、下丘脑等均为调节情感的主要脑区,这些脑区会产生大量的5-羟色胺(5-HT)、P物质(SP)和神经肽Y(NPY),与单胺类神经递质相互作用,从而完成生物节律的调控,故而认为5-HT、SP和NPY紊乱可能参与抑郁症发病机制[5,6]。因此,本研究通过探讨首发抑郁症患者CYP2D6基因位点rs1065852多态性、炎症因子和单胺类神经递质变化,旨在为首发抑郁症预防和治疗提供依据。
1 对象与方法
1.1对象 选择泸州市精神病医院于2018年1月~2019年1月期间收治的首发抑郁症患者97例作为研究对象,参照美国精神障碍诊断与统计手册第5版(DSM-5)[7]中相关诊断标准。纳入标准:(1)符合抑郁症诊断标准,且均为首发;(2)汉密尔顿抑郁量表(HAMD)评分>18分;(3)临床资料完整;(4)获得知情同意。排除标准:(1)双相情感障碍抑郁发作者或继发性抑郁障碍者;(2)合并心肺、肝肾功能严重异常者;(3)妊娠或哺乳期妇女。纳入的97例患者中,男39例,女58例;年龄23~59岁,平均年龄(38.93±6.52)岁;身体质量指数(BMI)18~24 kg/m2,平均BMI(21.83±1.94)kg/m2;吸烟史31例。另选择泸州市精神病医院于2018年1月~2019年1月期间健康体检者78名作为对照组,男34名,女44名;年龄21~58岁,平均年龄(38.26±6.10)岁;BMI 18~23 kg/m2,平均BMI(21.34±1.78)kg/m2;吸烟史24例。两组基线资料比较差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 CYP2D6基因位点rs1065852多态性检测 受试者于入院2 h内抽取外周静脉血2 ml,以EDTA-K2抗凝,放置于-80 ℃下保存待测。采用人类基因组DNA提取试剂盒提取全血基因组DNA,放置于-80 ℃下保存待测。由生工生物工程(上海)股份有限公司合成引物,引物序列:上游引物:5’-CCA TTT GGT AGT GAG GCA GGT-3’,下游引物:5’-CAC CAT CCA TGT TTG CTT CTG GT-3’。采用RT-PCR检测基因型,总反应体积30 μl,其中包括DNA模板2 μl,上下游引物各0.5 μl,2 μl dNTP,3 μl 10×loading buffer,21.8 μl ddH20,0.2 μl taq酶。反应条件为:95 ℃预变性5 min;95 ℃变性30 s,60.4 ℃退火30 s,72 ℃延伸40 s;30个循环后72 ℃延伸10 min。扩增550bp DNA目的片段。采用特异性限制性内切酶Ncol按照说明书反应条件酶切:10.5 μlNco,10 μl DNA,2 μl 10×buffer tango,0.7 μl ddH2O,取酶切后产物6 μl,酶切凝血酶原基因rs1065852位点。于37 ℃条件下孵育3 h,终止反应。置消化段于3%琼脂糖凝胶电泳,采用EB染色后以DL2000 DNA片段长度作为标准物,于紫外灯下对结果进行判断。
1.2.2 炎症因子检测 包括白介素-1β(IL-1β)、白介素-6(IL-6)和肿瘤坏死因子-α(TNF-α),受试者均于入院24 h内采集外周静脉血3 ml,分离血浆,离心半径10 cm,离心10 min,于-20 ℃下保存待测,采用酶联免疫吸附法测定IL-1β、IL-6和TNF-α含量。
1.2.3 单胺类神经递质检测 取上述血浆标本,采用酶联免疫吸附法测定5-HT、SP和NPY含量。
1.2.4 观察指标 (1)观察两组HAMD评分变化,以评分<8分为正常,以评分≥8分且≤20分可能有抑郁症,以评分>20分且≤35分为肯定有抑郁症,以评分>35分为严重抑郁症;(2)观察两组CYP2D6基因位点rs1065852多态性等位基因分布频率与基因型频率;(3)观察两组血浆炎症因子变化;(4)观察两组单胺类神经递质水平变化。
1.2.5 统计学方法 采用统计学软件SPSS 22.0进行数据处理分析,计量资料比较采用t检验,计数资料比较采用χ2检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 两组HAMD评分比较 抑郁症组HAMD评分[(23.98±4.35)分]高于对照组HAMD评分[(5.48±1.53)分](t=35.805,P<0.05)。
2.2 两组CYP2D6基因位点rs1065852多态性基因型频率与等位基因分布频率比较 抑郁症组TT基因型频率高于对照组(P<0.05),两组间等位基因C、T频率比较差异有统计学意义(P<0.05)。见表1。
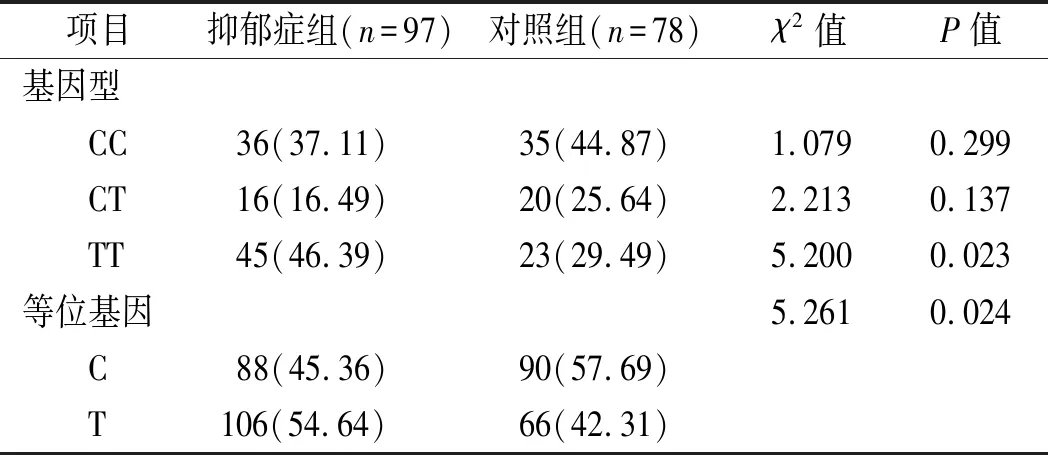
表1 两组CYP2D6基因位点rs1065852多态性基因型 频率与等位基因分布频率比较[n(%)]
2.3 两组血浆炎症因子变化比较 抑郁症组血浆IL-1β、IL-6、TNF-α和SP水平均高于对照组(P<0.05),5-HT和NPY水平均低于对照组(P<0.05)。见表2。
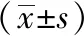
表2 两组血浆炎症因子、单胺类神经递质 水平变化比较
3 讨论
抑郁症由于具有高发病率、高致残率和高致死率越来越引起社会的广泛重视,给家庭和社会造成沉重的经济负担[8,9]。虽然近年来对抑郁症研究取得进展,但其具体病理生理机制和确切发病原因尚未完全阐明。CYP酶活性的人群特征呈遗传多态性,并且编码基因突变导致酶代谢相应底物的速率或能力增强或减弱,从而影响抗抑郁药的血药浓度,进一步影响疗效。CYP2D6是具有多态性的一种药物代谢酶,如文拉法辛、帕罗西汀等抗精神病药物均为CYP2D6基因的作用底物[10]。CYP2D6酶活性存在明显个体差异,且存在多位点基因型。目前,临床上尚无有关CYP2D6基因位点rs1065852多态性与抑郁症的相关性研究[11]。本文通过初步研究发现,抑郁症组TT基因型频率高于对照组,两组间等位基因C、T频率比较差异有统计学意义(P<0.05),认为rs1065852位点T基因可能是抑郁症易感基因。
炎症因子主要是由免疫细胞分泌的具有调节免疫应答生物活性的信号分子,在抑郁症的病理生理中具有重要作用,越来越受到重视[12,13]。IL-1可启动多项反应,如细胞因子的产生、T细胞和B细胞的活化、中性粒细胞聚集和活化及发热等。IL-1包括IL-1α和IL-1β等11种因子,其中IL-1β主要集中表达于骨髓细胞上,需模式识别受体的激活,认为其可能作为抑郁症革新治疗的生物靶点之一。研究报道表明,颞叶癫痫伴抑郁症患者血浆中IL-1β含量较健康者和颞叶癫痫不伴抑郁症患者高,且与HAMD得分呈正相关,由此可见高水平IL-1β可能与抑郁症相关[14]。本研究表明,抑郁症组血浆IL-1β水平高于对照组,说明首发抑郁症患者血浆IL-1β水平升高,可能是由于IL-1β通过激活海马神经干细胞上的IL-1受体I型,从而影响核因子κB信号通路,海马细胞增殖减少,进一步导致抑郁症的发生。IL-6主要由辅助性T细胞2和单核巨噬细胞产生,具有刺激肝细胞合成急性期蛋白的作用。研究报道显示,抑郁症患者血清水平高于健康人[15]。本研究表明,抑郁症组血浆IL-6水平高于对照组,说明首发抑郁症患者血浆IL-6水平升高。IL-6是下丘脑-垂体-肾上腺轴的强烈刺激物,而下丘脑-垂体-肾上腺轴过度激活则会引起皮质醇大量分泌,而其中皮质醇的受体主要分布于前额叶、杏仁核及海马等情绪认知调节脑区和环路,并且长期高浓度皮质醇会对这些脑区产生神经毒性作用,从而导致其功能和(或)结构异常,使其情感调节功能紊乱,造成抑郁症的发生。TNF-α是主要由多核巨细胞产生的一种分泌蛋白,可诱导干扰素、白介素等的生成和释放,可引起炎症的级联放大反应。学者研究报道显示,抑郁症患者血清TNF-α含量明显升高,认为其可能参与抑郁症的病理生理过程[16]。本研究表明,抑郁症组血浆TNF-α水平高于对照组,说明首发抑郁症患者血浆TNF-α水平升高,可能是由于TNF-α通过胱天蛋白酶相关通路诱导细胞凋亡,可能对抑郁症产生重要作用。
抑郁症具体发病机制尚未完全阐明,但大部分观点认为,抑郁症发生不仅是心理反应引起,同时与非多巴胺能神经生化改变相关。有研究报道显示,抑郁症患者下丘脑处5-HT存在病理性改变,且多巴胺减少也会引起单胺类神经递质含量下降,从而影响5-HT能神经元及其通路,导致抑郁症的发生,故而测定5-HT水平可了解抑郁症发生[17]。近年来,研究认为NYP可能是抑郁症诊断和疗效判断的一项指标。NYP主要在下丘脑参与昼夜节律的调节,及在边缘系统参与情绪的整合,认为可能影响与之共存的经典神经递质如肾上腺素、5-HT,进一步参与抑郁症的发生[18]。SP广泛分布于中枢神经系统,是神经激肽中一种含量最丰富的脑肠肽,主要参与免疫调节和炎症反应。中枢SP可能以调质或递质的方式介导应激反应和情绪,参与抑郁症的发病过程[19]。本研究表明,抑郁症组血浆5-HT和NPY水平低于对照组,而SP水平高于对照组,说明抑郁症患者存在明显的5-HT、NPY和SP紊乱,从而影响中枢神经功能。
综上所述,CYP2D6基因位点rs1065852多态性、炎症因子和单胺类神经递质与抑郁症密切相关,认为rs1065852位点T基因可能是抑郁症易感基因。
