SDS改性壳聚糖对Cu(Ⅱ)的吸附研究
2019-02-13田薪成刘珊冯婷刘丹荣蒋翠婷孙朝辉
田薪成,刘珊,冯婷,刘丹荣,蒋翠婷,孙朝辉
(长安大学 环境科学与工程学院 旱区地下水文与生态效应教育部重点实验室,陕西 西安 710054)
铜是动植物生长所必需的微量元素,但是当生物体内的铜元素积累过高时会对其生理活动产生不利的影响,严重情况下会破坏整个水生态环境[1]。
吸附法常用于去除水体重金属,目前常用的吸附材料有活性炭、沸石等[2-3]。壳聚糖(CS)是对甲壳素进行脱乙酰化获得的一种高分子聚合物[4],分子表面的大量胺基(—NH2)和羟基(—OH)可以有效吸附重金属离子[5-8]。十二烷基磺酸钠(SDS)是一种阴离子表面活性剂,可以改善壳聚糖分子的表面疏水性,解决了CS在酸性溶液下粘度高的问题[9-10]。
本文用SDS改性壳聚糖,探讨不同条件对材料吸附Cu(Ⅱ)效果的影响。
1 实验部分
1.1 试剂与仪器
壳聚糖(分子量70万~80万,脱乙酰度≥90.0%);十二烷基磺酸钠、冰乙酸、盐酸、氢氧化钠、二水合氯化铜均为分析纯;实验用水为蒸馏水。
MPLR-702恒温磁力搅拌器;HZS-H水浴恒温振荡器;TU-1810紫外可见分光光度计;PHB-4型pH计;WHL-25A台式电热恒温干燥箱;AP-019真空抽滤机;AVA-TAR360 傅里叶红外光谱仪。
1.2 材料制备
2.0 g CS溶于100 mL乙酸(质量分数为1%)中,磁力搅拌2 h,使其完全溶解。2.0 g SDS溶于100 mL蒸馏水中,加热至45 ℃使SDS完全溶解。将CS溶胶用滴定管逐滴滴入SDS溶液当中,同时磁力搅拌5 h。用质量分数1%的NaOH调pH至中性,抽滤,用水洗涤多次,在55 ℃烘24 h,烘干后研磨,过100目筛,得到CS-SDS改性材料。
1.3 吸附实验
0.2 g CS-SDS溶解于100 mL浓度100 mg/L的氯化铜溶液中。在25 ℃、120 r/min恒温水浴振荡器振荡24 h。滤出上清液,将其分级稀释100倍,用紫外分光光度计测定铜离子浓度。
2 结果与讨论
2.1 pH对Cu(Ⅱ)吸附的影响[6]
铜溶液的Cu(Ⅱ)浓度为100 mg/L,体积为200 mL,pH范围为2.0~5.5。同时以CS为对照组在同样的条件下进行吸附实验,结果见图1。
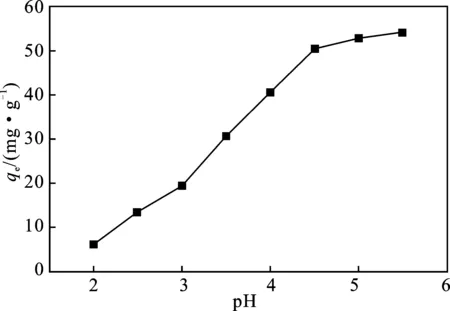
图1 不同pH下CS-SDS对Cu(Ⅱ)吸附量Fig.1 Adsorption of Cu(Ⅱ) by CS-SDS at different pH
由图1可知,随着pH的升高,材料的吸附量也随之增高,在pH=5.5时达到最高。原因是在pH较低时,溶液中大量存在的氢离子会与铜离子产生竞争关系[11],壳聚糖上的胺基会发生质子化,对铜离子产生电性斥力[12],使材料对Cu(Ⅱ)的吸附量较低。
2.2 吸附时间对Cu(Ⅱ)吸附的影响
配制100,200 mg/L的Cu(Ⅱ)溶液各200 mL,吸附时间的影响见图2。
由图2可知,在0~10 min时,吸附量随时间快速增长,在这一时间段完成了大约4/5的平衡吸附量;在10~30 min时,吸附量增长速率放缓,>30 min 时,随着时间的增长,吸附量几乎不发生变化,表明吸附时间30 min时,材料达到吸附平衡。这是因为CS-SDS对Cu(Ⅱ)主要是由CS分子链上大量的胺基和羟基等官能团进行吸附,在吸附初期,Cu(Ⅱ)主要在吸附剂的表面进行吸附,当表层吸附达到饱和时,Cu(Ⅱ)沿着材料的微孔向内部进行扩散,同时由于此时溶液中的Cu(Ⅱ)浓度相对较低,所以吸附的推动力也较低,此时的吸附速率相较于上一阶段放缓,最终慢慢达到平衡。
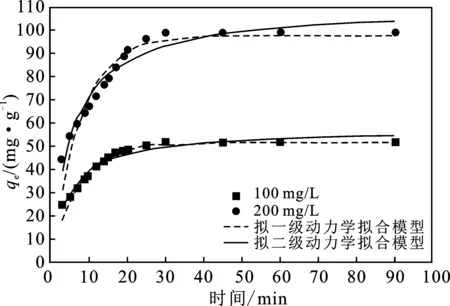
图2 CS-SDS吸附动力学模型拟合Fig.2 Kinetic models fitting results for CS-SDS
CS在同等条件下对Cu(Ⅱ)溶液的吸附实验见图3。
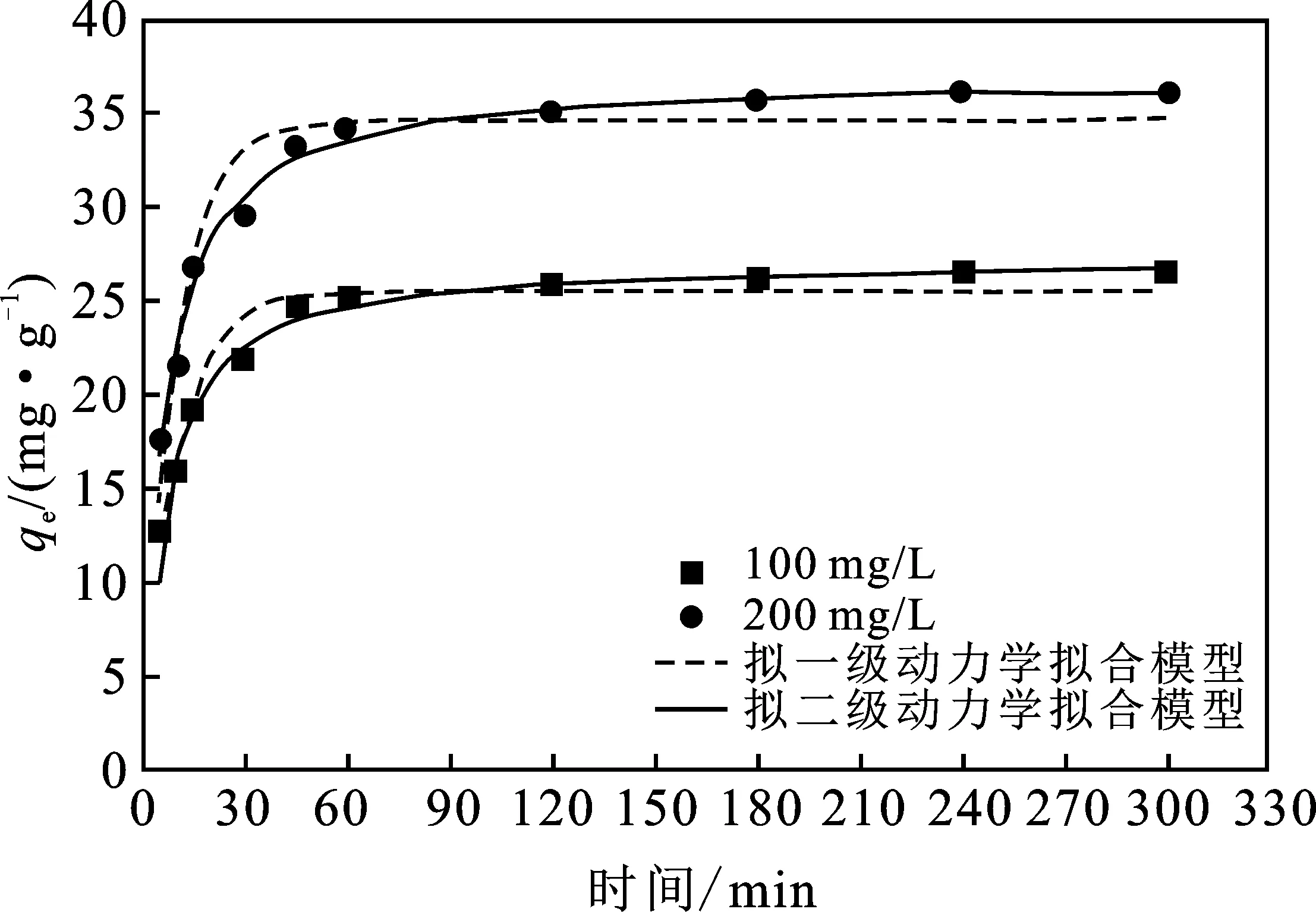
图3 CS吸附动力学模型拟合Fig.3 Kinetic models fitting results for CS
由图3可知,其吸附速率明显低于CS-SDS,需要4 h才能达到吸附平衡。
用拟一级和拟二级吸附动力学模型对吸附过程进行拟合,结果见表1。

表1 Cu(Ⅱ)吸附动力学参数Table 1 Kinetics parameters for Cu(Ⅱ) adsorption
式中 k1——拟一级速率常数,min-1;
k2——拟二级速率常数,g/(mg·min);
qt——t时刻的吸附量,mg/g。
拟二级模型的R2均高于拟一级模型,说明CS-SDS和CS对Cu(Ⅱ)的吸附符合拟二级动力学模型,主要以化学吸附为主。
2.3 初始浓度对Cu(Ⅱ)吸附的影响
溶液体积200 mL,吸附时间30 min,考察溶液初始铜离子浓度对吸附的影响,结果见图4。

图4 CS-SDS对Cu(Ⅱ)吸附等温线Fig.4 Adsorption isotherms of Cu(Ⅱ) onto CS-SDS
由图4可知,随着溶液Cu(Ⅱ)浓度的增大,CS-SDS和CS对Cu(Ⅱ)的平衡吸附量提高。因为在Cu(Ⅱ)初始浓度高的情况下,溶液中可利用的Cu(Ⅱ)相对较高,Cu(Ⅱ)可以与CS-SDS的吸附位点发生更多的有效碰撞,提高了材料的饱和吸附量。

图5 CS对Cu(Ⅱ)吸附等温线Fig.5 Adsorption isotherms of Cu(Ⅱ) onto CS
Langmuir和Freundlich吸附等温线模型广泛的用于对等温实验结果的拟合。Langmuir模型以假设在有限数量的吸附点位下进行的单层吸附为前提,公式可表示为:
式中qe——平衡吸附量,mg/g;
qm——最大饱和吸附量,mg/g;
KL——Langmuir模型常数,L/mg;
Ce——吸附质的平衡浓度,mg/L。
Freundlich模型假设吸附发生在非均匀表面而且有可能是多层面。
式中qe——平衡吸附量,mg/g;
Ce——吸附质的平衡浓度,mg/L;
KF——Freundlich等温常数,L/mg;
n——常数,用以描述吸附强度。
对实验数据进行非线性拟合,结果见表2。

表2 吸附Cu(Ⅱ)的Langmuir和Freundlich等温模型相关参数Table 2 Parameters of Langmuir and Freundlich isothermmodels for adsorption of Cu(Ⅱ)
由表2可知,Langmuir模型能更好的拟合Cu(Ⅱ)吸附数据,说明CS-SDS和CS对Cu(Ⅱ)的吸附为单层吸附,CS-SDS对Cu(Ⅱ)的最大吸附量219.22 mg/g,优于CS的118.98 mg/L以及大多数文献报道的壳聚糖改性吸附剂,见表3。

表3 不同壳聚糖改性材料对Cu(Ⅱ)的吸附量Table 3 Comparison of adsorption capacity for Cu(Ⅱ)onto different CS-based adsorbents
此外,引入一个量纲为1的常数RL,用于描述Langmuir模型的基本特征,表达式如下:
式中C0——铜溶液初始浓度,mg/g;
KL——Langmuir吸附常数(表2)。
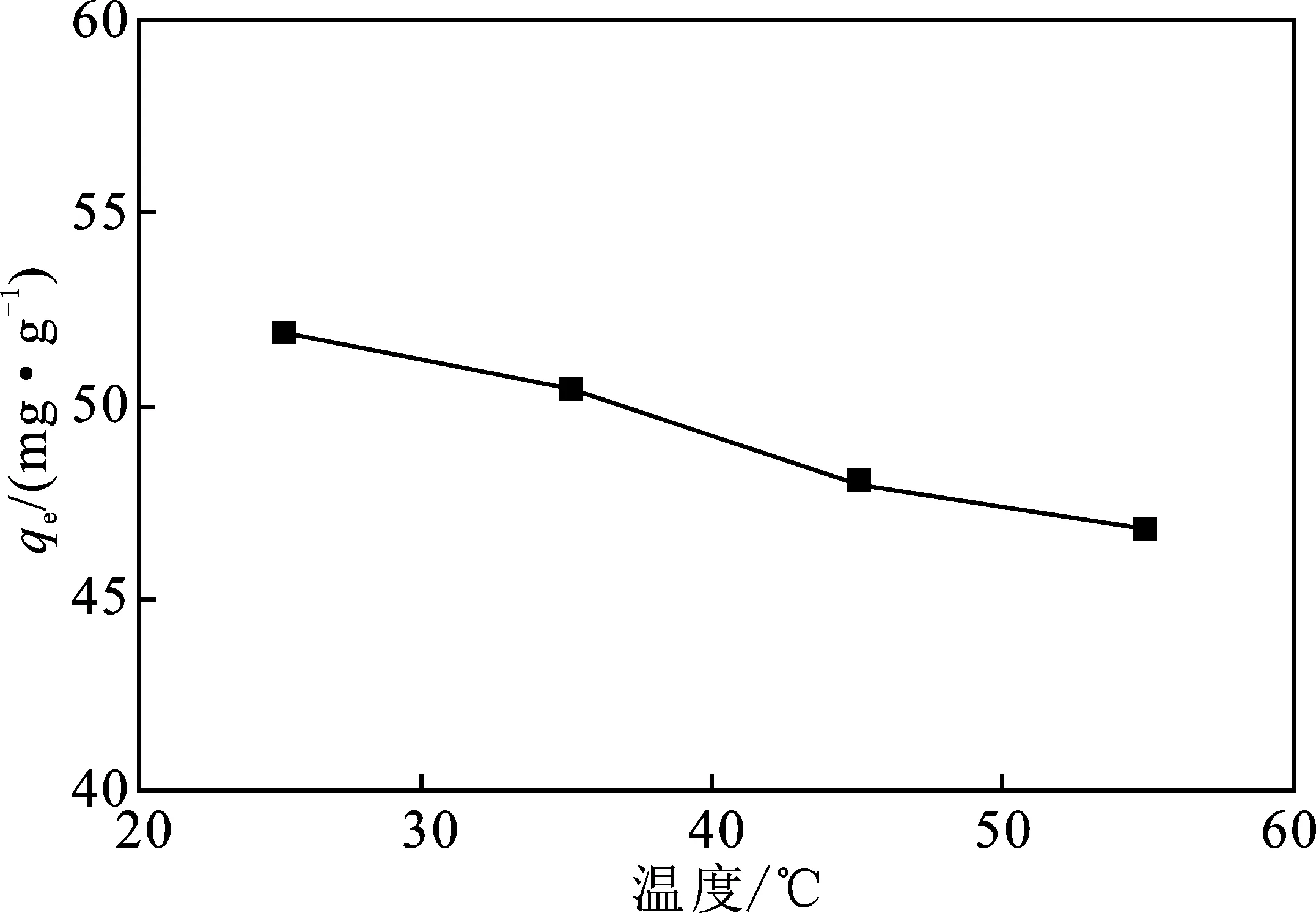
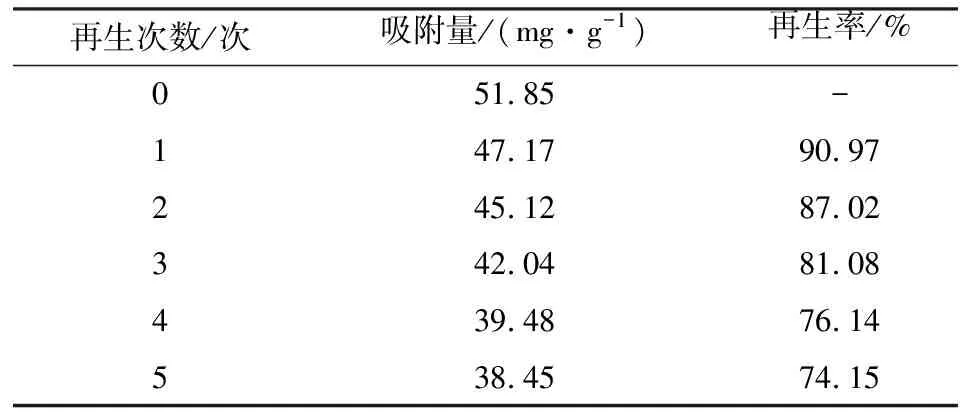
若RL=0,表示该吸附过程是不可逆的;若0 溶液初始Cu(Ⅱ)浓度100 mg/L,溶液体积200 mL,反应时间为30 min,考察反应温度的影响,结果见图6。 由图6可知,在25~55 ℃范围内,随着温度的升高,材料对Cu(Ⅱ)的吸附量随之缓慢降低。 图6 不同温度下的CS-SDS对Cu(Ⅱ)吸附量Fig.6 Adsorption of Cu(Ⅱ) by CS-SDS at different temperature 由图7可知,CS的1 656,1 596 cm-1分别为NHCOCH3基团中的C—O的伸缩振动和 —NH中N—H的弯曲振动,1 323,1 080,1 030 cm-1分别对应 —CN、C3—OH、C6—OH的伸缩振动[16-17]。改性后,CS上1 030,1 080 cm-1峰消失,产生的1 068,1 181 cm-1分别对应SO3的对称伸缩和反对称伸缩,说明SDS成功与CS进行结合,SDS可能通过CS上的C3—OH、C6—OH官能团与CS进行结合[18]。吸附后材料的1 068,1 181 cm-1峰明显减弱,说明磺酸根离子参与了Cu(Ⅱ)的吸附过程。 图7 壳聚糖、改性壳聚糖吸附Cu(Ⅱ)前后的改性壳聚糖FTIR图谱Fig.7 FTIR spectra of chitosan and modified chitosanbefore and after Cu(Ⅱ) adsorption 将吸附饱和的CS-SDS过滤,用质量分数1%的HCl进行24 h的脱附,再用去离子水洗涤至中性,烘干后再次进行Cu(Ⅱ)吸附实验,结果见表4。 表4 CS-SDS再生后的平衡吸附量Table 4 Equilibrium adsorption capacity afterCS-SDS regeneration 由表4可知,经过3次吸附再生,平衡吸附量能保持在81%;经过5次吸附再生,平衡吸附量能保持在74%。说明该材料可以在一定的次数内重复利用。 (1)采用SDS对CS改性后,材料对Cu(Ⅱ)有较好的吸附容量和较快的吸附速率。吸附效果受pH影响较大,其最佳的吸附pH为5.5。吸附在30 min内能达到吸附平衡,优于CS的4 h,其最大吸附量为219.22 mg/g,优于CS的118.98 mg/g。 (2)由FTIR可知,SDS的磺酸根基团可能与CS上的C3—OH、C6—OH官能团进行结合,从而达到改性目的。Langmuir和Freundlich等温模型和拟一级、拟二级动力学对吸附过程拟合表明,材料对Cu(Ⅱ)的吸附过程主要为单层化学吸附。 (3)CS-SDS有着较好的再生利用效果,经过5次的吸附再生,其平衡吸附量仍能达到最佳饱和吸附量的74%。2.4 温度对Cu(Ⅱ)吸附的影响
2.5 红外表征分析

2.6 吸附剂的再生利用
3 结论
