咪唑类离子液体微胶囊的CO2吸附和扩散行为
2019-02-13严红芳朱佳媚谷行李灿灿
严红芳,朱佳媚,谷行,李灿灿
(中国矿业大学 化工学院,江苏 徐州 221116)
温室效应已成为严重的世界问题,CO2捕集分离是当今研究热点[1]。离子液体具有低饱和蒸气压、高CO2吸收选择性和良好的溶解性等优势,应用于气体分离领域[2],但存在离子液体本身黏度大、价格昂贵、吸收解吸达平衡时间较长等问题[3]。将离子液体与无机载体结合,制得固定化离子液体[4-5],可有效解决上述不足。
目前国内外研究者开始关注微胶囊技术,即一种储存固体、液体、气体的微型包装技术[6]。 Shirato等[7]合成了一种气相硅胶包覆离子液体微胶囊,然而这方面的研究刚刚起步。
本文制备了气相硅胶包覆1-丁基-3-甲基咪唑氯盐([BMIM]Cl),同时向离子液体和水体系中加入适量的乙二醇,尽量减少水的损失,旨在提高其循环使用中的稳定性。重点研究其微观形貌、CO2吸附、CO2/N2选择性、稳定性和CO2吸附动力学。
1 实验部分
1.1 材料与仪器
N-甲基咪唑(99.5%)、气相硅胶(HB135)、二氯甲烷、 氯代正丁烷、无水乙醇等均为分析纯。
实验室自制吸附仪(吸附柱Φ7 mm×150 mm);Thermo Scientific Nicolet 380型FTIR红外光谱仪(采用KBr涂膜);CS200型光学显微镜。
1.2 咪唑类离子液体制备
在N2保护下,将氯代正丁烷15.07 g(0.11 mol)缓慢滴入N-甲基咪唑8.211 g(0.1 mol)中,磁力搅拌,升温至70 ℃,反应48 h,得浅黄色粘稠液体。二氯甲烷洗涤,减压旋蒸,在80 ℃下真空干燥6 h,即可得到1-丁基-3-甲基咪唑氯盐([BMIM]Cl)14.85 g,产率为83%。
[BMIM]Cl的FTIR(νmax,cm-1):3 146 和3 081(咪唑环上C—H); 2 958,2 934 和2 872(咪唑环上 —CH3);1 630,1 572 和1 568(咪唑环的骨架);617(C—Cl)。
1.3 气相硅胶包覆离子液体微粒的制备
称取干燥的疏水型气相硅胶(HB135)2 g,放入高速搅拌器中(20 000 r/min),加入一定量的离子液体[BMIM]Cl、乙二醇-水溶液,间歇高速搅拌90 s,混合充分后,形成流动状态的离子液体微粒(见图1)。为了对比分析,同样的方法制备了两种干水样品。具体气相硅胶包覆离子液体-乙二醇-水微粒制备条件见表1。

图1 气相硅胶包覆离子液体微粒实物图Fig.1 Physical diagram of ionic liquid microcapsules

样品液体种类离子液体含量/%硅胶含量/%水含量/%乙二醇含量/%BCE24[BMIM]Cl-乙二醇58.4624017.54BCE27[BMIM]Cl-乙二醇56.1527016.85BCE30[BMIM]Cl-乙二醇53.8530016.15BCE24-11[BMIM]Cl-乙二醇-水58.46248.778.77BCE24-12[BMIM]Cl-乙二醇-水58.452411.75.85BCE30-11[BMIM]Cl-乙二醇-水53.84308.088.08BCE30-12[BMIM]Cl-乙二醇-水53.863010.765.38HO05-135水05950HO24-135水024760
2 结果与讨论
2.1 气相硅胶包覆离子液体微胶囊的微观形貌分析
气相硅胶包覆离子液体-乙二醇体系样品的微观形貌见图2,粒径分布列于图3。

a.BCE24 b.BCE27 c.BCE30图2 不同质量配比的离子液体-乙二醇微粒微观形貌图(600×)Fig.2 Microstructure of ionic liquid-glycol particleswith different mass ratios
由图2可知,微胶囊均呈现清晰的包裹结构,这说明成功地制备了气相硅胶包裹[BMIM]Cl微胶囊。硅胶百分含量分别为27%,30%的BCE27和BCE30微胶囊颗粒粒径分布更加均匀;不同硅胶配比的离子液体微胶囊,颗粒大小具有显著差别,其中BCE24颗粒稍大,而BCE30颗粒稍小。可知离子液体-乙二醇体系微胶囊为微米级,平均粒径的范围是19.82~22.96 μm,其中平均粒径最小的BCE30为19.82 μm。随着硅胶含量的增加,离子液体微胶囊的平均粒径随之减小,这可能是因为在充分的高速搅拌下,离子液体分散成足够小的液滴,避免离子液体团聚,因而形成粒径较小的微胶囊。

图3 气相硅胶包裹离子液体微粒的粒径分布Fig.3 Particle size distribution of microparticlesencapsulated by gaseous silica gel
由图3可知,气相硅胶包覆离子液体-乙二醇-水体系样品,其粒径也是微米级,范围是15.46 ~18.31 μm,其中BCE30-11的平均粒径最小(15.46 μm),与干水HO24-135的相当。另外,与离子液体-乙二醇体系对比可以看出,随着水的加入和水含量的增加,形成的颗粒越细小,这可能是由于水的表面张力大于乙二醇,而黏度低于乙二醇所致。根据文献报道[8],两种材料的表面性质是成功制备离子液体微胶囊的关键,且被包裹液体介质的表面张力值越大越好。水的特性使得加入水后,能更容易形成高度分散的微小离子液体液滴,从而可以得到粒径较小的微胶囊。
2.2 气相硅胶包覆离子液体微粒中水的稳定性
在室温下,采用连续真空脱附法测定了水的失重[9]。图4为气相硅胶包覆离子液体微粒中水分的损失曲线。
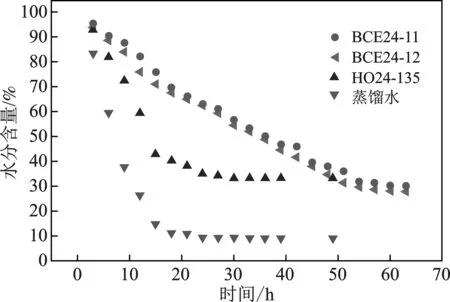
图4 气相硅胶包覆离子液体微粒水分的损失曲线Fig.4 Water loss curve of ionic liquid microparticlesencapsulated by gaseous silica gel
由图4可知,与蒸馏水相比,气相硅胶包裹液体样品均能有效地减缓水的损失。与HO24-135相比,BCE24-11和BCE24-12的水分损失曲线的下降梯度要更低,这也说明加入乙二醇的样品稳定性更好。另外,实验中也测试了样品BCE24在相同条件下的失重情况,结果表明其基本上没有损失。因此,表明随着乙二醇加入量的递增,能有效减缓水分的损失速率,从而提高水的稳定性。
2.3 CO2吸附性能和CO2/N2吸附选择性
在298 K和0.1 MPa条件下,各样品的CO2平衡吸附量和CO2/N2的吸附选择性见图5。
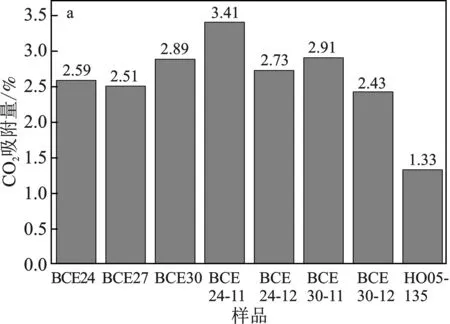
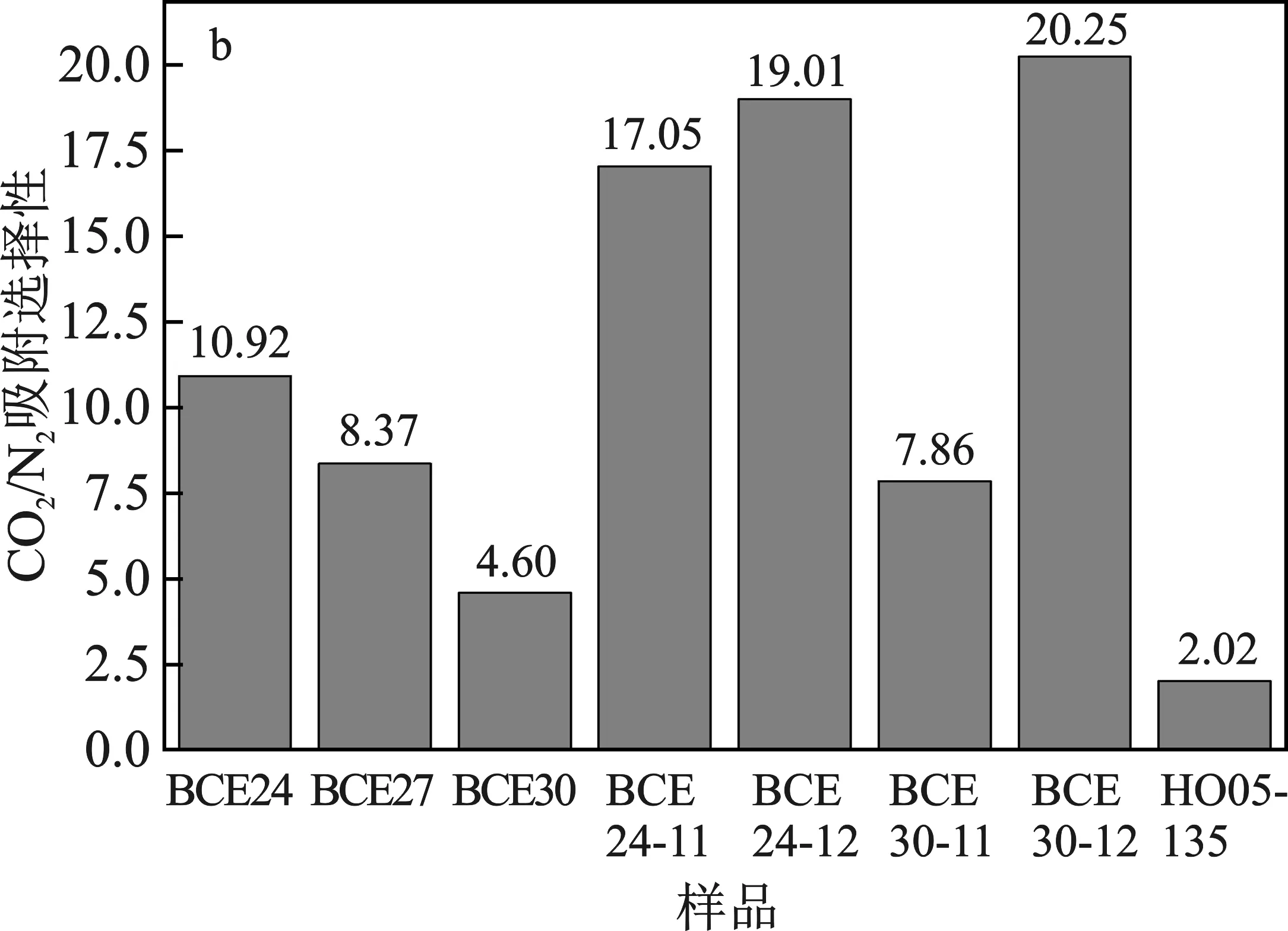
图5 各样品的CO2吸附量(a)和CO2/N2吸附选择性(b)Fig.5 The CO2 adsorption performance (a) and adsorptionselectilvity of CO2/N2 for samples (b)
由图5a可知,和干水相比较,各离子液体微粒的CO2吸附量均有所增加,说明离子液体微胶囊对CO2有较好的吸附能力。对于离子液体-乙二醇体系而言,BCE24、BCE27和BCE30的平衡吸附量分别为2.59%,2.51%和2.89%。随着离子液体含量的递减,CO2吸附量呈现不规律的变化,这说明离子液体微粒的CO2吸附量与离子液体含量和颗粒粒径有关。结合图3的粒径分析,BCE30的粒径相对较小,比表面积增大,为CO2接触提供了充分的界面积,更有利于CO2的吸收。
对于离子液体-乙二醇-水体系而言,样品BCE24-11和BCE24-12的CO2平衡吸附量分别为3.41%和2.73%,BCE30-11和BCE30-12的分别为2.91%和2.43%。与BCE24和BCE30相比,说明水对CO2的吸收影响比较显著。包裹液体中水的加入,一定程度上有利于提高CO2的吸附性能,过多的水则导致CO2平衡吸附量反而减小。由文献[10-11]可知,水的存在有利于提高CO2吸附量,同时降低了离子液体黏度,更容易形成高度分散的微小离子液体液滴。同样结合粒径分析可知,离子液体-乙二醇-水体系制得的微粒具有较小的粒径。
图5b为样品的CO2/N2吸附选择性。相同条件下,吸附CO2和N2的平衡吸附量之比。
由图5b可知,干水HO05-135的选择性仅为2.02,气相硅胶包裹离子液体的选择性均高于干水,这说明制备的样品具有较优的CO2/N2选择性。对比样品BCE24、BCE27和BCE30可知,CO2/N2选择性随着离子液体含量的减少而减小,这充分说明了离子液体含量对选择性起着重要作用。同样四种含水离子液体微胶囊样品的CO2/N2吸附选择性更优,且BCE24-12和BCE30-12的选择性要高于BCE24-11和BCE30-11,这也归因于加入的水促进了CO2的吸收,同时水含量的增加促使粒径减小。综上所述,对于气相硅胶含离子液体而言,离子液体的含量和微粒粒径对于CO2的吸附选择性起主要作用。
2.4 CO2吸附/脱附循环使用性
样品在0.1 MPa和298 K吸附饱和后,采用真空脱附的方法进行再生。图6为BCE30、BCE24-11和BCE30-12经过5次吸/脱附循环CO2的吸附量。
由图6可知,经过多次循环后,三种样品的CO2吸附量均未出现明显下降,表明样品具有良好的循环使用性能。其中BCE30的CO2平衡吸附量由2.89%降到2.78%,下降了3.80%;BCE24-11从3.41%降低到3.22%,下降了5.57%;BCE30-12从2.43%降低到2.30%,下降了5.35%。BCE30具有较好的循环使用性,说明乙二醇加入量的增加,使得样品稳定性更好,具备良好的循环使用性能。
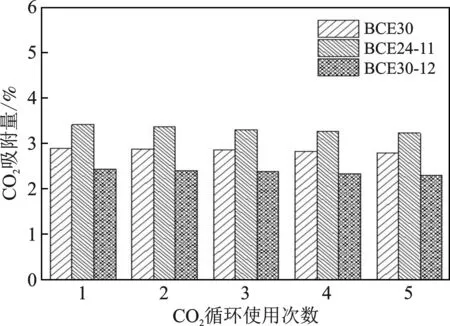
图6 各样品的CO2循环使用性Fig.6 Cycle performance of CO2 adsorption for samples
2.5 CO2吸附动力学
将包覆离子液体颗粒近似视为均一的球体,采用均相表面扩散模型(HSDM)对离子液体微粒的CO2吸附曲线进行拟合,部分样品的拟合结果见图7、表2。
HSDM模型的质量平衡方程为[12]:
(1)
求解,可得
(2)
式中C——t时刻时样品中CO2的质量浓度,%;
C0——CO2的初始质量浓度,%;
Cs——CO2的饱和质量浓度,%;
Ds——扩散系数,m2/s;
l——样品在容器中的厚度,m;
t——时间,s。
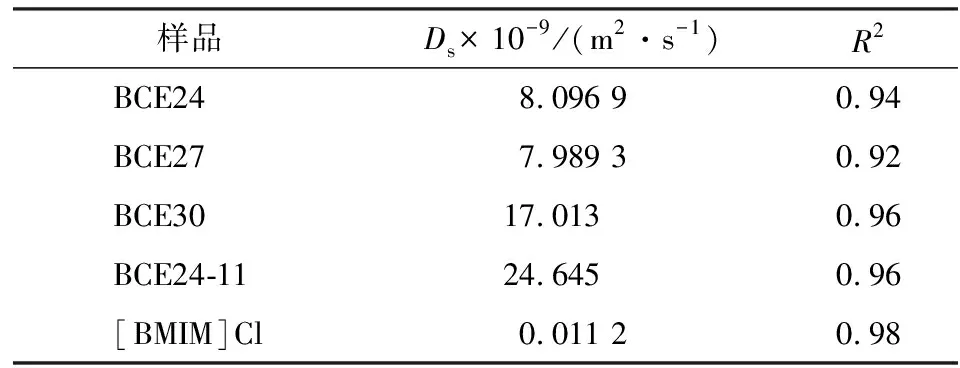
由图7可知,样品在HSDM模型下拟合较好。结合DS值可知,微粒的扩散系数数量级是10-8~10-9m2/s,[BMIM]Cl纯离子液体是1.12×10-11m2/s,本实验制备的样品则高出2~3个数量级。说明气相硅胶包覆离子液体微粒能有效克服纯离子液体粘度高,扩散速率缓慢的劣势,显著提高离子液体的CO2扩散过程。

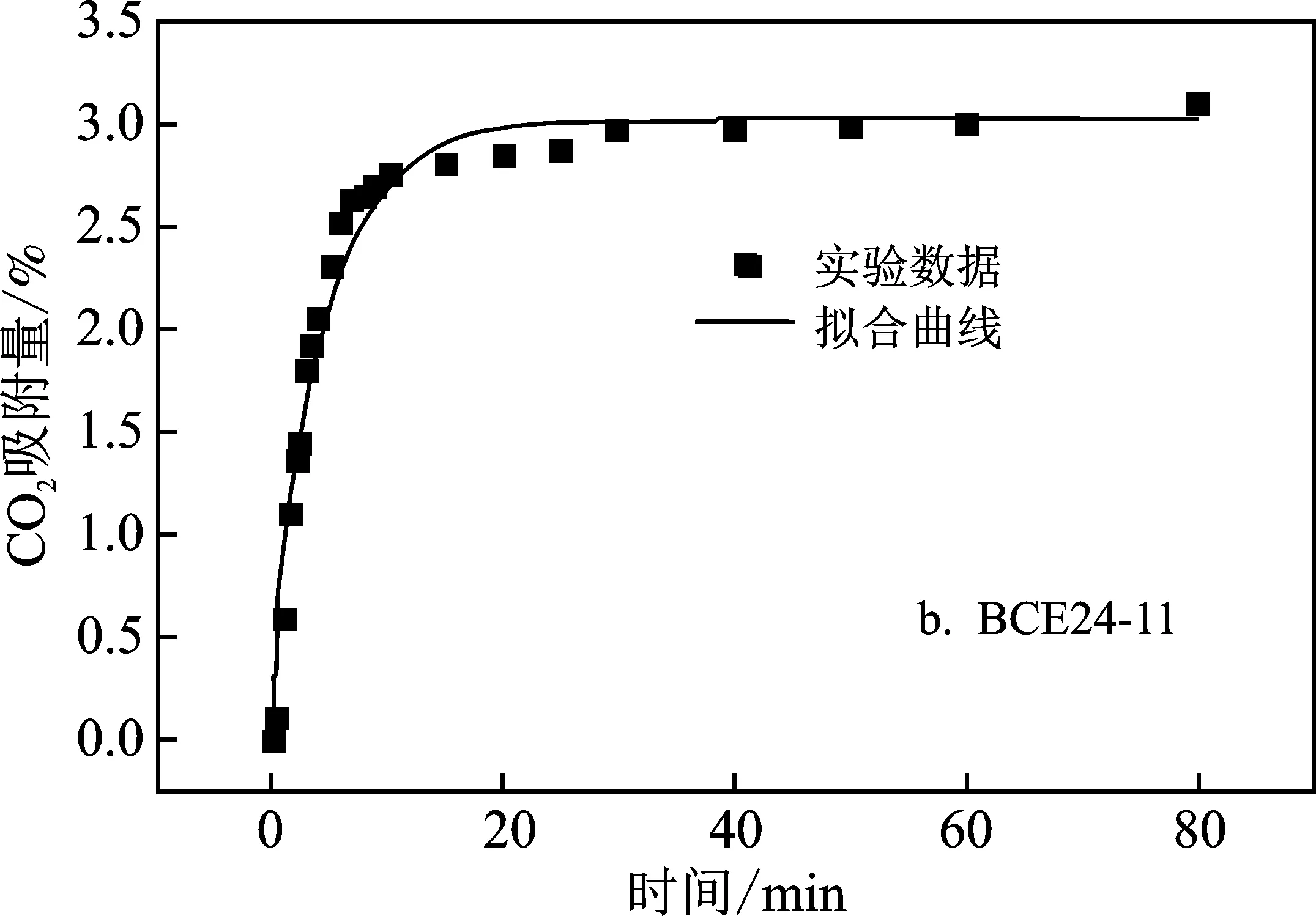
图7 气相硅胶含离子液体微粒的HSDM拟合曲线Fig.7 HSDM fitting curves for ionic liquid microcapsulesencapsulated by gaseous silica gel
样品Ds× 10-9/(m2·s-1)R2BCE248.096 90.94BCE277.989 30.92BCE3017.0130.96BCE24-1124.6450.96[BMIM]Cl0.011 20.98
由表2可知,样品BCE24-11的扩散较快,吸附实验也证实两者达吸附平衡的时间仅30 min。对比BCE24、BCE27和BCE30可知,BCE30的扩散系数稍快,结合微观形貌分析,这是因为其形成的颗粒结构完整且粒径较小。对比BCE24和BCE24-11的扩散系数可以看出,加入适量的水溶液,离子液体的粘度降低,有效降低气体的传质阻力,明显提高微胶囊颗粒的扩散系数[13],同时结合微胶囊的微观形貌分析可知,与颗粒的粒径也有关,水的加入使得制备的样品粒径减小,比表面积增大,同时也影响了扩散系数。
3 结论
(1)制备的气相硅胶含离子液体微胶囊粒径为微米级,且气相硅胶和离子液体、乙二醇-水溶液的配比对于粒径影响显著。以离子液体、乙二醇和水为芯材时,颗粒粒径较小。
(2)离子液体微胶囊的微观结构和粒径是影响CO2吸附量的主要因素。在0.1 MPa和298 K下,BCE24-11的CO2吸附量最大为3.41%,达吸附平衡仅30 min,且CO2/N2选择性、稳定性和循环使用性较好。
(3)扩散模型拟合得到的CO2在气相硅胶包覆咪唑类离子液体微粒的扩散系数,比纯[BMIM]Cl的Ds值(10-11m2/s)高2~3个数量级。
