红球菌跨膜运输荧蒽的差异膜蛋白分析
2019-02-13孔德康王红旗关晶晶
孔德康,李 艺,王红旗*,许 洁,关晶晶
红球菌跨膜运输荧蒽的差异膜蛋白分析
孔德康1,李 艺2*,王红旗1*,许 洁1,关晶晶1
(1.北京师范大学水科学研究院,北京 100875;2.广西师范大学环境与资源学院,广西 桂林 541004)
提取不同时间荧蒽诱导下红球菌BAP-1分泌的膜蛋白,利用同位素标记相对和绝对定量技术(iTRAQ技术)结合液相二级质谱对差异膜蛋白进行聚类以及生物信息学分析.旨在从蛋白质层面上研究红球菌BAP-1跨膜运输荧蒽过程中起关键作用的膜蛋白种类及其作用机制.结果共鉴定到172个差异膜蛋白.通过差异膜蛋白的COG和GO功能分析,发现荧蒽的加入主要影响了红球菌BAP-1细胞膜上与能量、转运相关的膜蛋白.ABC转运蛋白和TonB依赖转运蛋白作为微生物主要的载体蛋白对BAP-1跨膜运输荧蒽起到了重要作用.过氧化氢酶和超氧化物歧化酶在第6d有一个显著上调,作为抗氧化防御机制来保护微生物.各种膜蛋白在不同阶段发挥着各自作用,这些蛋白共同组成蛋白互作网络调控红球菌BAP-1的跨膜运输过程.
红球菌BAP-1;荧蒽;膜蛋白;跨膜运输;iTRAQ
多环芳烃(PAHs)因为其“三致”效应以及稳定的化学性质对人类和生态环境造成了极大的影响.PAHs的水溶性差,通过自然衰减或者物理化学去除工艺的方法往往收效甚微.生物降解已经被证实是最经济、最环保的PAHs修复方法[1].红球菌是一种典型的PAHs降解菌,可以有效的降解萘、菲、荧蒽等PAHs[2-3].
细胞膜是防止细胞外物质自由进入细胞的屏障,是保证细胞内环境的稳定性和各种生化反应有序运行的重要细胞器.细胞膜的稳定性是细菌提高细胞活力和生长的关键,研究表明,微生物膜能产生一些物质(如肽基脯氨酰异构酶)来维持膜的稳定性[4].我们的前期研究表明,在微生物成功的对PAHs进行吸附摄取后,PAHs需要通过微生物的细胞膜跨膜运输进入到细胞体内.此时,微生物才能对PAHs进行降解[5].细胞膜上的离子转运(例如H+)可以为PAHs的跨膜转运提供动力,从而提高微生物对PAHs的摄取和降解能力[4].并且,微生物细胞膜上有许多酶活性位点,可以与PAHs或其他底物结合,从而将这些物质转移到细胞中.但是,细胞膜的状态会随着外界环境的不同而变化,其疏水性和渗透性的变化会影响微生物对PAHs的吸附,进而影响整个降解过程[6].那么,在这个过程中,微生物是如何调节自身的生理生化过程来适应外界环境的变化,以实现对PAHs的运输和代谢,是近年来国内外研究的热点.
蛋白质组学通过研究蛋白质及其组分,从而用来分析不同环境下微生物蛋白质表达的差异.近年来,国内外学者利用蛋白质组学的优势来探究微生物降解石油烃过程的微观机理[7].例如利用蛋白质组学技术发现了铜绿假单胞菌SJTD-1的383种烷烃反应蛋白,并且将这些蛋白质与微生物的多种生化途径联系在了一起[8].此外,利用同位素标记相对和绝对定量技术(iTRAQ技术)比较荧蒽诱导不同时间下红球菌BAP-1全蛋白表达的差异,发现绝大部分差异蛋白参与代谢和能量产生过程[9].本文在课题组前期研究的基础上,对荧蒽诱导不同时间下红球菌BAP-1细胞膜蛋白的差异进行研究,旨在结合我们的前期研究成果,从蛋白质层面上明确红球菌BAP-1跨膜运输荧蒽过程中起关键作用的膜蛋白种类及其作用机制.
1 材料与方法
1.1 菌种培养
红球菌BAP-1(GenBank entry:JX683682, CGMCC ID:7.68)是课题组从天津滨海湿地石油污染场地分离筛选所得,能够有效降解荧蒽等多种PAHs.BAP-1在LB培养基中扩大培养36h后,转入荧蒽浓度为3mg/L的无机盐(MSM)培养基,在30℃, 110rpm条件下进行摇瓶诱导实验.
1.2 试剂和仪器
1.2.1 培养基 本研究采用了2种培养基,LB培养基和MSM培养基的配方参考许洁等[10]的文章.荧蒽诱导MSM培养基:在已灭菌的MSM中加入一定量的荧蒽丙酮溶液,使荧蒽浓度达到3mg/L,在无菌操作台静置6h使丙酮完全挥发.
1.2.2 实验仪器 LC-20AB液相色谱(岛津), LC-20AD纳升液相色谱仪(岛津),ESI串联质谱仪:TripleTOF5600(SCIEX,Framingham,MA,USA),离子源为Nanospray III source (SCIEX, Framingham, MA, USA),放射器为石英材料拉制的喷针(New Objectives, Woburn, MA, USA).
1.3 实验方法
1.3.1 实验设置 利用3mg/L荧蒽分别诱导降解菌0,1,3和6d,每组实验设置2个平行样,3个比对组分别为1d/0d,3d/1d和6d/3d,以确定不同时间段内BAP-1膜蛋白变化情况.
1.3.2 红球菌膜蛋白提取 采用贝博细菌膜蛋白提取试剂盒提取BAP-1的膜蛋白.按照试剂盒提供的步骤,对荧蒽诱导0,1,3和6d下的BAP-1膜蛋白进行提取,并对所提膜蛋白进行质控.
1.3.3 蛋白酶解和肽段标记 每个样品取100ug蛋白溶液,在37℃下,用测序级胰蛋白酶(蛋白和酶的比例为40:1)酶解膜蛋白4h,然后按上述比例再补加胰蛋白酶一次,37℃继续酶解8h.酶解后的肽段溶于30μL 0.5mol/L三乙胺-碳酸缓冲液(TEAB)中.每组的肽段分别用iTRAQ Reagent 8-plex One Assay Kit (AB Sciex,Framingham,MA)进行iTRAQ标记.
1.3.4 肽段分离 肽段在岛津LC-20AB高效液相色谱-高pH-RP柱系统中进行分离.用2mL缓冲液A (5%ACN pH=9.8)重组肽段,然后以1mL/min的流速进行梯度洗脱分离:0~10min,5%缓冲液B(95%ACN pH=9.8); 10~50min,5%~35%缓冲液B; 50~51min, 35%~95%缓冲液B,并在95%缓冲液B条件下保持3min;最后5%缓冲液B平衡10min.通过测量在214nm处的吸光度来监测洗脱,并且每分钟收集组分,洗脱的肽段汇集为20个组分并真空干燥.
1.3.5 高效液相 肽段样品用缓冲液A(2%ACN, 0.1%FA)重悬复溶,20,000g离心10min后,取上清进样.通过LC-20AD纳升液相色谱仪进行分离.样品首先进入trap柱富集并除盐,随后与自装C18柱串联,以300nL/min流速通过如下有效梯度进行分离: 0~8min,5%缓冲液B (98%ACN,0.1% FA); 8~43min,缓冲液B从8%线性升至35%; 43~48min,缓冲液B从35%升至60%; 48~50min,缓冲液B从60%升至80%; 50~55min,80%缓冲液B; 55~65min,5%缓冲液B.纳升液相分离末端直接连接质谱仪.
1.3.6 质谱检测 在参数为离子喷雾电压2300V,氮气压力30psi,喷雾气压力15psi,界面加热器温度150℃的高灵敏度模式下进行数据采集.一级质谱扫描的累积时间为250ms,质量范围为350~1500Da.按照一级谱图中的离子强度从高到低,选择强度超过150cp的前30个进行碎裂并扫描二级信息,筛选标准如下: m/z范围为350~1250Da;电荷数目为2~5个电荷;母离子动态排除设置为:在一半的出峰时间内(约12s),相同母离子的碎裂不超过2次.二级质谱的扫描累积时间为100ms.针对iTRAQ类型的数据采集,碎裂能量选择根据iTRAQ试剂调整,第二个四级杆Q2在100Da时的离子传输效率为100%.
1.3.7 蛋白质分析 得到原始数据后,进行统一的信息分析.图1显示了完整的iTRAQ定量流程.数据合格后经过一定的筛选阈值,得到最终可信的蛋白质鉴定结果.随后进行iTRAQ定量分析,从定量结果中筛选出我们更为关心的显著差异蛋白.在有重复实验的情况下,定量重复性分析判断本次定量数据质量是否达到标准.最后进行差异蛋白的COG和GO富集分析.
在谱图/肽段水平进行1% FDR的过滤(PSM-level FDR£0.01),从而获得显著性鉴定的谱图和肽段列表.利用肽段进行蛋白组装,并产生一系列的蛋白组.在Q-value<0.05的情况下,利用两组iTRAQ定量的比值>1.5或<0.67认为有差异,取2组平均值为最终差异倍数.
2 结果与分析
2.1 差异蛋白聚类分析
分别以荧蒽诱导0,1和3d的红球菌BAP-1的膜蛋白为各个时段的对照,设置3个比对组分别为1d/0d,3d/1d和6d/3d.以Q-value£0.05和Fold change>1.5(即上调>1.5,下调<0.67)为差异膜蛋白的筛选条件,共鉴定到172个蛋白.

表1 3个比对组鉴定到的差异膜蛋白数
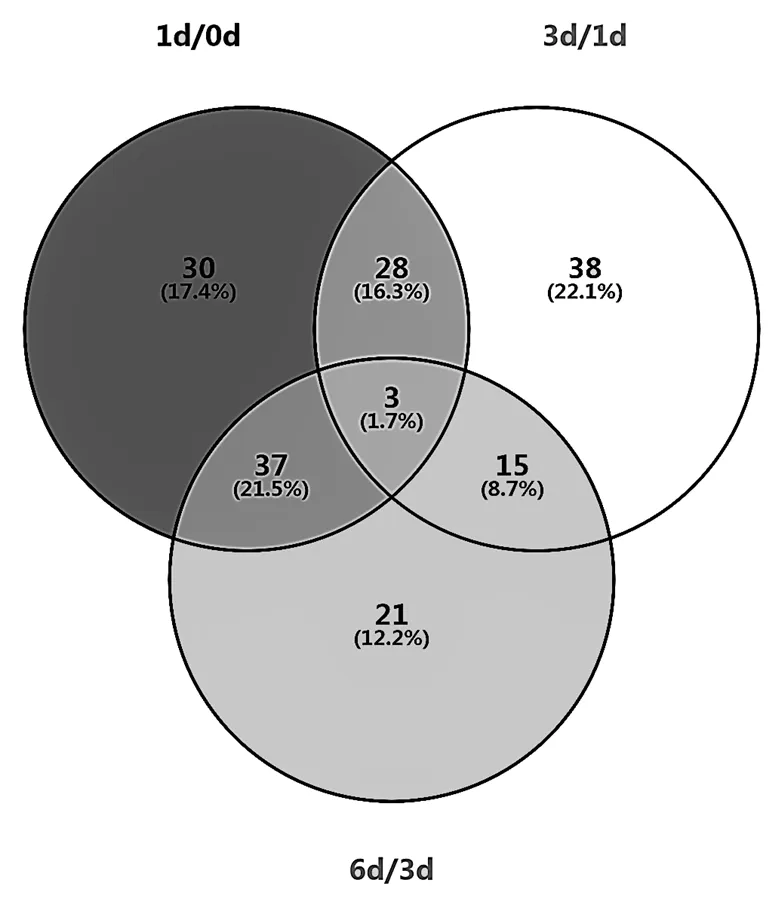
图2 3个比对组鉴定到的差异膜蛋白维恩图
由表1可知,与各自对照组做比对时,随诱导时间的延长,鉴定到的差异膜蛋白总数呈现略微下降的趋势,具体来看,下调膜蛋白在各个时间段的数量呈现逐渐下降的趋势,上调膜蛋白的数量则逐步上升.反应初期,菌体从LB培养液转接到荧蒽MSM培养液中,面临着营养物质变少的压力,通过大量下调一些与荧蒽转运无关的膜蛋白,来减少能量的耗散,以维持细胞正常的生命活动.随着反应时间的增加,微生物逐渐适应荧蒽胁迫的环境,需要调节下降的膜蛋白数量逐渐降低,在3~6d时间段内下调的膜蛋白几乎没有;而上调膜蛋白的数量逐渐上升,在3~6d有72个膜蛋白上调.微生物需要通过摄取环境中的荧蒽来维持正常的生命活动,因此需要上调与荧蒽转运有关的跨膜蛋白.相较于对膜蛋白的抑制作用,荧蒽对于BAP-1转运蛋白的促进表达作用存在一个相对滞后的过程.

图3 83个差异膜蛋白的热图
从图2中可以看出,3个对比组中共有的膜蛋白不是很多,仅有3个,但是两两组别共有的膜蛋白分别有28,37和15个,根据这83个差异膜蛋白在各自对比组中的差异倍数(没有差异的令差异倍数为1),得到这83个蛋白的热图(图3).
从图3中可以看出,大部分膜蛋白先是先下调(热图中显黄色),然后上调(红色)或者保持不变(浅红色),这与我们之前发现的上调膜蛋白滞后的规律相似.根据图2,发现在组别1d/0d中,显著上调的膜蛋白为TonB受体蛋白、异柠檬酸脱氢酶、磷酸甘油酸激酶、丙酮酸脱氢酶等,下调的膜蛋白主要为膜脂蛋白、鞭毛蛋白、ABC转运酶等;在3d/1d中,显著上调的蛋白主要为ABC转运蛋白、ATP合成酶、核苷二磷酸激酶等,下调的膜蛋白主要为丙酮酸脱氢酶、苹果酸脱氢酶、乙醛脱氢酶和延伸因子等;而在6d/3d中,显著上调的膜蛋白主要为超氧化物歧化酶、ABC转运蛋白、乙醇胺利用蛋白等,下调的膜蛋白主要为2个TonB依赖转运蛋白和2个ABC转运蛋白.
不难发现,随着时间的变化,一些转运蛋白的表达量逐渐升高,说明红球菌BAP-1适应胁迫环境之后,能够通过膜蛋白的变化来提高对荧蒽的跨膜运输过程.
2.2 差异蛋白COG功能分类
对差异膜蛋白进行正交同源蛋白组(COG)的功能分类.COG是一个用于分类同源蛋白的数据库,同源物通常具有相同的功能.

图4 3个比对组中差异膜蛋白的COG功能分类
从图4可以发现,荧蒽的加入主要影响了红球菌BAP-1细胞膜上的与能量、转运相关的膜蛋白.同时,荧蒽的加入还影响了其他功能的膜蛋白,包括无机离子运输与代谢,蛋白质周转,细胞壁/膜/包膜生物合成,细胞内运输、分泌和水泡运输等.这说明红球菌BAP-1跨膜运输荧蒽的过程是复杂的,是需要多种膜蛋白共同参与的一个过程.另外,在3个组别中,氨基酸转运与代谢,能量产生与转化以及碳水化合物运输和代谢均占了大多数的比例.表明红球菌BAP-1对荧蒽的吸附摄取和跨膜运输是一个能量消耗过程.这也再次证明了作者之前研究结论:红球菌BAP-1对荧蒽的跨膜运输过程是需要能量的主动运输过程,是红球菌BAP-1降解荧蒽的重要步骤[10].
2.3 差异蛋白的GO富集分析
GO(Gene ontology)数据库分别从参与的生物途径,细胞功能及在细胞中的定位对蛋白进行了注释,对差异膜蛋白进行GO富集分析可以大致了解差异膜蛋白参与了哪些生物过程,拥有哪些分子功能以及构成哪些细胞组件.
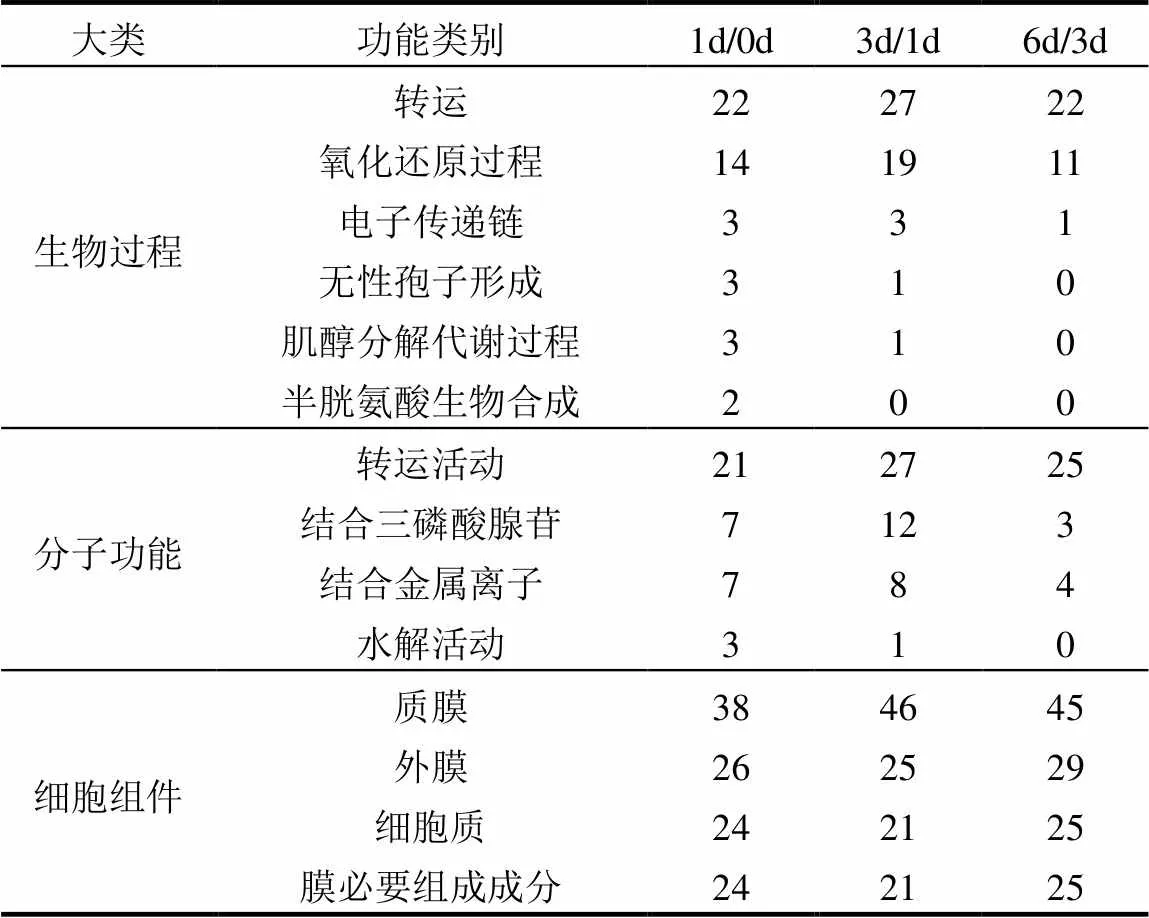
表2 3个比对组中差异膜蛋白的GO富集
从表2可以看出,差异膜蛋白主要参与的生物过程是转运及氧化还原过程,一小部分的蛋白参与了电子传递链、无性孢子形成、肌醇分解代谢以及半胱氨酸生物合成过程.从分子功能上看,3个组别中的差异蛋白也主要集中在转运活动以及结合三磷酸腺苷、结合金属离子等活动上,少数膜蛋白参加了水解活动.氧化还原过程、电子传递链能够为微生物跨膜运输提供能量,因此他们的变化影响着转运蛋白的变化.
由于所提取的是红球菌BAP-1的膜蛋白,从细胞组件来看,不难发现,多数蛋白作为细胞膜的组成成分,少部分构成细胞质的蛋白可能是一些吸附在内膜上的细胞质转运蛋白.
3 讨论
3.1 组别1d/0d中的差异膜蛋白
在组别1d/0d中,共有11个差异膜蛋白上调以及87个膜蛋白显示下调.上调的膜蛋白包括丙酮酸脱氢酶、异柠檬酸脱氢酶、醇脱氢酶以及延伸因子等,下调的膜蛋白包括膜脂蛋白、鞭毛蛋白、孢子外壳蛋白等.
丙酮酸脱氢酶能够通过丙酮酸脱羧过程把丙酮酸转化为乙酰辅酶A,而乙酰辅酶A被利用于柠檬酸循环,因此丙酮酸脱氢酶能够连接糖酵解代谢与柠檬酸循环,并通过NADH释放能量. Subashchandrabose等人[11]的研究发现,芘生长环境会导致丙酮酸脱氢酶复合体的明显积累,证明了丙酮酸脱氢酶在PAHs降解中起到了一定的作用.相比于0d,丙酮酸脱氢酶在反应进行1d后的表达上调了3.26倍.荧蒽进入红球菌BAP-1细胞内是微生物的主动运输过程,需要消耗大量的能量.丙酮酸脱氢酶的产生能够帮助红球菌BAP-1在细胞膜上产生大量的能量,从而使其能更好的对荧蒽进行跨膜运输.
异柠檬酸脱氢酶(IDH)是一种催化异柠檬酸氧化脱羧,并能产生α-酮戊二酸和CO2的酶.IDH参与三羧酸循环,还原氧化NAD+为NADH,被认为是三羧酸循环中的限速酶.因此,IDH活性对生物体的代谢有巨大影响[12].氧化木糖无色杆菌DN002降解荧蒽的过程中,Ma等人鉴定到了异柠檬酸等许多差异蛋白,基于这些鉴定的蛋白质,推断细菌菌株DN002遵循在C-2,3位的荧蒽双氧化的主要过程,并通过邻苯二甲酸和邻苯二酚作为中间体介导[13].IDH的表达量在第1d上调了3.03倍,说明在红球菌BAP-1细胞膜上不仅有跨膜蛋白,还能够对荧蒽的一些代谢产物进行继续代谢,用于产生能量,从而继续进行对荧蒽的跨膜运输.
醇脱氢酶(ADH)是在许多生物体中发生的一组脱氢酶,促进醇和醛或酮之间的相互转化.Kong等[14]研究了假单胞菌JP1在低氧条件下菲的降解机理.RNA测序和RT-qPCR结果表明,在PAHs暴露过程中,醇脱氢酶基因表达上调了 3.16倍.此外,采用双向电泳(2-DE)和MALDI-FT-ToF技术研究了与菲降解有关的蛋白质,发现醇脱氢酶参与了菲的分解代谢过程.在我们的研究中,醇脱氢酶在第1d上调了1.79倍,说明了醇脱氢酶在红球菌BAP-1跨膜运输荧蒽的过程中发挥了重要作用.表明红球菌BAP-1细胞膜的作用不仅仅在于保护细胞、周转物质,还能分泌许多酶以促进对荧蒽的运输和降解.
鞭毛蛋白是细菌鞭毛的主要成分,是细菌在液体中运动的主要工具.红球菌BAP-1从LB培养液转接到含有荧蒽的MSM培养液后,营养物质变少,微生物通过减少自身运动降低能量消耗,使更多的能量用于跨膜运输上,因此鞭毛蛋白的表达量在第1d下调了0.36倍.膜脂蛋白和孢子外壳蛋白在第1d也分别下调了0.14和0.44倍,这两类蛋白的减少,一方面说明红球菌BAP-1在营养物质匮乏的情况下减少不必要蛋白的合成来减少能量的耗散,另一方面又能够增加细胞膜的通透性,使荧蒽的跨膜运输过程更加便捷.
3.2 组别3d/1d中的差异膜蛋白
在组别3d/1d中,共有28个差异膜蛋白上调以及56个膜蛋白显示下调.上调的膜蛋白包括TonB-依赖转运蛋白、ATP合成酶、细胞色素C等,并且在组别1d/0d中下调的鞭毛蛋白、孢子外壳蛋白在3d/1d中也显示出了上调.下调的膜蛋白包括乙醛脱氢酶、乳酸脱氢酶、苹果酸脱氢酶等.
TonB-依赖转运蛋白(TBDT)允许细菌从营养限制环境摄取包括铁载体、血红素、维生素B12和碳水化合物等资源[15].sp.通过细胞膜上的TBDTs来跨膜转运壳寡糖,这为它们在营养不良的环境里提供生存优势[16].相较于第1d,共有2种TonB-依赖转运蛋白的表达量得到了上调,分别为4.14和2.35倍,说明它们很有可能作为载体参与了红球菌BAP-1对荧蒽的跨膜运输过程,为红球菌BAP-1在营养匮乏的环境中提供了生存优势.
ATP合成酶在细胞内催化能源物质ATP的合成,通过电子传递链释放的能量先转换为跨膜质子(H+)梯度差,之后质子流顺质子梯度差通过ATP合成酶使ADP+Pi合成ATP.ATP水解时释放出能量较多,是生物体内最直接的能量来源.以往的研究表明,红球菌BAP-1在跨膜运输荧蒽的过程需要能量[10]. ATP合成酶在反应进行3d后比第1d上调了5.91倍,证明在这个阶段内,大量的能量产生,可能是由于红球菌BAP-1在这个阶段开始大量降解荧蒽及其代谢产物,或者是由于红球菌BAP-1在逐渐适应荧蒽环境后,开始大量进行荧蒽的跨膜运输,从而需要大量能量的支持.
磷酸甘油酸激酶是糖酵解过程中的主要酶,是糖酵解途径的第一个ATP生成步骤.同样的,乙醛脱氢酶以及苹果酸脱氢酶等都是微生物用来产能的蛋白.他们在反应进行3d后,都有不同程度的下调,说明红球菌BAP-1能够调整自己产能的方式,在不同阶段选取最适合自己的产能方式来让自己更好的适应环境.
3.3 组别6d/3d中的差异膜蛋白
在组别6d/3d中,共有72个差异膜蛋白上调以及4个膜蛋白显示下调.上调的蛋白包括ABC转运蛋白、超氧化物歧化酶、过氧化氢催化酶等.下调的蛋白为2个ABC转运酶和2个TonB-依赖转运蛋白.
ABC转运蛋白通常由多个亚基组成,其中一两个是跨膜蛋白,另一些是跨膜相关的ATP酶.ATP酶亚单位利用三磷酸腺苷(ATP)结合和水解的能量来激发各种底物在膜上的迁移,用于吸收或导出底物.研究表明,ABC转运蛋白在多种生物过程中起作用,包括在细胞膜中起转运蛋白的作用,并且能够对环境中的PAHs做出一定的响应[17].相较于反应进行的第3d,荧蒽诱导下反应6d的红球菌BAP-1有9种ABC转运蛋白上调,但也有2种ABC转运蛋白显示下调,说明随着不断的诱导和适应,在6d,红球菌BAP-1在各种ABC转运蛋白的协作之下,对荧蒽的跨膜运输进行得更为顺利.
超氧化物歧化酶是一种催化超氧化物自由基分解成普通分子氧或过氧化氢的酶.超氧化物是氧代谢的副产物,如果不加以调节,会导致多种类型的细胞损伤.过氧化氢酶催化过氧化氢分解为水和氧.它是保护细胞免受活性氧(ROS)氧化损伤的非常重要的酶.研究表明,萘和芘能够改变铜绿假单胞菌PCC7806的生长,降低其藻蓝蛋白的含量,并且刺激超氧化物歧化酶、过氧化氢酶的活性[18].在反应开始进行的第6d,超氧化物歧化酶和过氧化氢酶分别上调了5.58和2.7倍,说明红球菌BAP-1在含有荧蒽的环境中生长,需要通过改变抗氧化防御系统来维持自身的生理生化过程.
前期实验对红球菌BAP-1在第1,3,6d的荧蒽降解率进行了测定,发现在第6d荧蒽的降解速率最高.在第6d,超氧化物歧化酶、过氧化氢酶的过量表达,维持了微生物的内环境稳定.与此同时,相较于反应前期,更多的ABC转运蛋白的表达使得微生物能更多的转运体系中的荧蒽,使得降解效率提高.
4 结论
4.1 共鉴定到172个差异膜蛋白,随诱导时间的延长,鉴定到的差异膜蛋白总数呈现略微下降的趋势.对差异膜蛋白进行聚类分析,表明下调膜蛋白在各个时间段的数量呈现逐渐下降的趋势,上调膜蛋白的数量则逐步上升;大部分膜蛋白先是先下调,然后上调或者保持不变.说明红球菌BAP-1适应胁迫环境之后,能够通过膜蛋白的变化来提高对荧蒽的跨膜运输过程.
4.2 通过差异膜蛋白的COG和GO功能分析,发现荧蒽的加入主要影响了红球菌BAP-1细胞膜上的与能量、转运相关的膜蛋白;在三个组别中,氨基酸转运与代谢、能量产生与转化以及碳水化合物运输和代谢共占据了近一半的比例.表明红球菌BAP-1对荧蒽的吸附摄取和跨膜运输是一个能量消耗过程.
4.3 通过对不同Cluster组别进行分析,发现ABC转运蛋白和Ton-B依赖转运蛋白作为膜蛋白中最主要的转运蛋白,随着时间的推移,表达量逐渐上调,显示了它们在红球菌BAP-1跨膜运输荧蒽过程中的重要性. 超氧化物歧化酶和过氧化氢酶在6d的表达量分别达到了5.58和2.7倍,从而起到保护微生物的作用.在反应进行的不同阶段,红球菌BAP-1能够调整自己产能的方式,选取最适合自己的产能方式来让自己更好的适应环境.
4.4 各种膜蛋白在反应进行的不同阶段发挥着各自作用,为红球菌BAP-1跨膜运输荧蒽提供着必要的能量,这些膜蛋白共同组成蛋白互作网络调控红球菌BAP-1的跨膜运输过程.
[1] Ogunbayo A, Olanipekun O, Owoade A. Biodegradation of certain polycyclic hydrocarbons with paenbacillus alvei and penicillum restricum [J]. Journal of Ecological Engineering, 2018,19:140-148
[2] Luo A, Wu Y R, Xu Y, et al. Characterization Fn of a cytochrome P450monooxygenase capable of high molecular weight PAHs oxidization fromsp. P14 [J]. Process Biochemistry, 2016,51:2127-2133.
[3] Zhou X, Xing X, Hou J, et al. Quantitative proteomics analysis of proteins involved in alkane uptake comparing the profiling of Pseudomonas aeruginosa SJTD-1in response to n-octadecane and n-hexadecane [J]. Plos One, 2017,12:e0179842.
[4] Liu S, Guo C, Dang Z, et al. Comparative proteomics reveal the mechanism of Tween 80enhanced phenanthrene biodegradation by Sphingomonas sp. GY2B [J]. Ecotoxicology and Environmental Safety, 2017,137:256-264.
[5] 李 艺,王红旗,吴枭雄,等.红球菌BAP-1对荧蒽的跨膜运输过程[J]. 中国环境科学, 2018,38(4):1441-1448. Li Y, Wang H Q, Wu X X, et al. Study on the trans-membrane transport process of fluoranthene by Rhodococcus sp. BAP-1 [J]. China Environmental Science, 2018,38:1441-1448.
[6] Zhang D, Zhu L, Li F. Influences and mechanisms of surfactants on pyrene biodegradation based on interactions of surfactant with astrain [J]. Bioresource Technology, 2013,142:454-461.
[7] Dou J, Qin W, Ding A, et al. iTRAQ-based proteomic profiling of a Microbacterium sp. strain during benzo(a)pyrene removal under anaerobic conditions [J]. Applied Microbiology and Biotechnology, 2017,101:8365-8377.
[8] Liu H, Sun W B, Liang R B, et al. iTRAQ-based quantitative proteomic analysis ofSJTD-1: A global response to n-octadecane induced stress [J]. Journal of Proteomics, 2015,123:14-28.
[9] 许 洁,王红旗,孔德康.基于iTRAQ技术荧蒽降解菌的比较蛋白质组学分析[J]. 中国环境科学, 2018,38(1):284-292. Xu J, Wang H Q; Kong D K. iTRAQ-based comparative proteomic analysis of a fluoranthene-degrading bacterium [J],China Environmental Science, 2018:284-292.
[10] Li Y, Wang H Q, Hua F, et al. Trans-membrane transport of fluoranthene bysp. BAP-1and optimization of uptake process [J]. Bioresource Technology, 2014,155:213-219.
[11] Subashchandrabose S R, Logeshwaran P, Venkateswarlu K, et al. Pyrene degradation bysp. MM3 in liquid medium and soil slurry: Possible role of dihydrolipoamide acetyltransferase in pyrene biodegradation [J]. Algal Research, 2017,23:223-232.
[12] Oliva M, Perales J A, Gravato C, et al. Biomarkers responses in muscle of() from a heavy metals and PAHs polluted estuary [J]. Marine Pollution Bulletin, 2012,64:2097-108.
[13] Ma Y L, Lu W, Wan L L, et al. Elucidation of fluoranthene degradative characteristics in a newly isolatedDN002 [J]. Applied Biochemistry and Biotechnology, 2015,175:1294-1305.
[14] Kong J, Wang H, Liang L, et al. Phenanthrene degradation by the bacteriumJP1 under low oxygen condition [J]. International Biodeterioration & Biodegradation, 2017,123:121-126.
[15] Kai T, Jiao N, Liu K, et al. Distribution and Functions of TonB- dependent transporters in marine bacteria and environments: implications for dissolved organic matter utilization [J]. Plos One, 2012,7:e41204.
[16] González J M, Fernándezgómez B, Fernàndezguerra A, et al. Genome analysis of the proteorhodopsin-containing marine bacteriumsp. MED152 (Flavobacteria) [J]. Proceedings of the National Academy of Sciences of the United States of America, 2008,105:8724-8729.
[17] Jeong C B, Kim D H, Kang H M, et al. Genome-wide identification of ATP-binding cassette (ABC) transporters and their roles in response to polycyclic aromatic hydrocarbons (PAHs) in the copepod Paracyclopina nana [J]. Aquatic Toxicology, 2016,183:144-155.
[18] Zhang M, Wang X, Tao J, et al. PAHs would alter cyanobacterial blooms by affecting the microcystin production and physiological characteristics of[J]. Ecotoxicology and Environmental Safety, 2018,157:134-142.
Differential membrane protein analysis ofduring the transmembrane-transport process of fluoranthene.
KONG De-kang1, LI Yi2*, WANG Hong-qi1*, XU Jie1, GUAN Jing-jing1
(1.College of Water Sciences, Beijing Normal University, Beijing 100875, China;2.College of Environment and Resource, Guangxi Normal University, Guilin 541004, China)., 2019,39(1):274~280
Comparative proteomics analysis was performed on membrane proteins extracted fromBAP-1on consecutive fluoranthene exposure days by using isobaric tags for relative and absolute quantization (iTRAQ) labelling and LC-MS/MS analysis to access differentially expressed membrane proteins. A total of 172differential membrane proteins were identified. The enrichment of COG and GO terms analysis of differentially expressed membrane proteins in three clusters showed that most of the differential proteins were involved in transport and oxidation-reduction processes. ABC transporters and TonB-dependent receptors played an important role in transmembrane-transport of fluoranthene. Catalase and superoxide dismutase had a significant up-regulation in sixth days as an antioxidant defence mechanism to protect microbes. Various energy-produced proteins played their respective roles at different stages, and constituted a protein interaction network to regulate transmembrane-transport of microorganisms.
sp. BAP-1;fluoranthene;membrane protein;transmembrane-transport;iTRAQ
X172
A
1000-6923(2019)01-0274-07
孔德康(1993-),男,浙江湖州人,硕士研究生,主要从事污染土壤修复与治理研究.发表论文5篇.
2018-05-16
国家自然科学基金资助面上项目(41372232);广西高校重点实验室研究基金资助项目(YRHJ152024);广西自然科学基金青年基金资助项目(2017GXNSFBA198168)
* 责任作者, 王红旗, 教授, amba@bnu.edu.cn; * 李艺, 讲师, liyi412@mailbox.gxnu.edu.cn
