壳聚糖负载磺化酞菁钴催化过硫酸盐降解甲基橙的研究
2019-02-13张宇东蔡珺晨安继斌张小平
陈 炜,张宇东,蔡珺晨,安继斌*,张小平
壳聚糖负载磺化酞菁钴催化过硫酸盐降解甲基橙的研究
陈 炜1,张宇东2,蔡珺晨1,安继斌1*,张小平2
(1.重庆文理学院,环境材料与修复技术重庆市重点实验室,重庆 402160;2.华南理工大学环境与能源学院,广东 广州 510006)
过渡金属催化过硫酸盐(PS)产生活性氧自由基(ROS)可有效降解有机污染物.为避免均相催化过程中过渡金属带来的二次污染,将磺化酞菁钴(CoPcS)键合固定于壳聚糖(CS)微球载体上,制备出一种结构稳定、较高催化活性的催化剂(CS-CoPcS),并以偶氮染料甲基橙(MO)为目标污染物,考察不同反应条件对MO降解过程的影响,进而分析了催化剂的稳定性和降解机理.结果表明: CS-CoPcS催化PS可有效降解MO,当反应温度为25℃,MO初始浓度为152.75μmol/L,pH0为5.5, PS的投加浓度为10mmol/L,CS-CoPcS投加量为1.25g/L,MO在180min的降解率可达87.21%,降解速率为1.24×10-2min-1,符合准一级动力学方程;电子自旋共振(EPR)和淬灭实验均证实催化过程产生以硫酸根自由基为主的有效ROS;4次循环利用实验中未能检测出溶液中潜在浸出的钴离子, CS-CoPcS表现出很好的催化活性和结构稳定性.
磺化酞菁钴;壳聚糖;过硫酸盐;硫酸根自由基;甲基橙
染料广泛应用于皮革、纺织、塑料和造纸等行业中,随着我国染料相关行业的快速发展,对染料需求量急剧增加,同时也产生了大量具有生物毒性的染料废水,成为生态环境安全的重要威胁之一[1].由于染料废水包含难降解有机物,一般的氧化剂和好氧硝化很难对其进行有效降解[2].目前对染料废水的处理方法主要包括絮凝、吸附、离子交换、膜分离、化学氧化等[3].相比其它处理方法,硫酸根自由基高级氧化法以其可以氧化去除难降解有机物的特点引起了广泛关注.过硫酸盐(PS)具有较高的氧化还原电位(~2.01V),同时可通过活化产生硫酸根自由基,相比常用的臭氧和过氧化氢氧化剂,过硫酸盐在降解体系中具有更长的留存时间,活化产生的硫酸根自由基比羟基自由基(1.9~2.7V)具有更高氧化还原电位(2.5~3.1V),因此体现出更强的降解和矿化有机物的能力[4].目前对于过硫酸盐的活化技术主要包括加热、微波、紫外辐照、添加过渡金属等,其中过渡金属活化过硫酸盐因其廉价易得、不需要外部能源等优势被广泛使用,其中以Co2+的活化效果最好[5-7].值得注意的是,Co作为优先污染物可对人体健康产生不利影响,直接利用Co2+进行均相活化可导致Co的大量流失,进而产生二次污染.
磺化酞菁钴(CoPcS)作为一种人工合成的大共轭体系化合物,其特殊的二维共轭π-电子结构,类似于自然界中广泛存在的卟啉,具有很好的光、热和化学稳定性,同时与Co2+具有极强的配位能力,只有通过破坏酞菁环才能将Co2+分离出来. CoPcS易于堆积,将其单独应用于催化反应,可形成活性极低的二聚物.为解决以上问题,已有研究通过共价键或金属中心的轴向配位,将CoPcS负载于石墨烯、碳纳米管、粘土、分子筛等表面构建催化剂并用于异相催化过程[8-10].然而,此类催化剂不仅成本较高,制备过程复杂,且制成的催化剂大多数以粉体形式存在,不利于其使用后的分离回收.壳聚糖(CS)作为自然界广泛存在的几丁质经过脱乙酰作用后的高分子物质,具有很好的经济性和环境友好性,通过不同的制备过程可将CS制备成纤维、薄膜、凝胶以及颗粒等不同形态,可作为异相催化剂理想的活性物载体,而以CS作为CoPcS载体用于催化PS降解偶氮染料废水的研究鲜有报道.
本研究制备出CS负载CoPcS催化剂(CS- CoPcS),选用甲基橙(MO)作为目标污染物,考察了不同反应条件下CS-CoPcS催化PS对MO的降解过程和循环利用性,结合电子自旋共振 (EPR)与淬灭实验,探讨了其催化降解机理,可为绿色高效活化PS高级氧化技术的运用提供理论参考.
1 材料与方法
1.1 试验材料与仪器
过硫酸钠、亚硫酸氢钠、氯化钴、钼酸铵、硫酸、氢氧化钠、叔丁醇(TBA)、MO(均为分析纯,上海国药集团化学试剂有限公司),乙酸(分析纯,成都市科隆化学品有限公司),甲醇(MA)(分析纯,天津大茂化学试剂厂),4-磺酰水杨酸(分析纯,上海江莱生物科技有限公司),尿素(分析纯,南京化学试剂股份有限公司),CS(脱乙酰度³95%,粘度100~200mPa.s,上海阿拉丁生化科技股份有限公司),5,5-二甲基-1-吡咯啉-N-氧化物(DMPO) (³97%,上海阿拉丁生化科技股份有限公司),实验溶液均采用超纯水配制.
主要仪器:紫外可见分光光度计(TU-1901,北京普析通用仪器有限责任公司),原子吸收光谱仪(PinAAcle 9007,美国帕金埃尔默公司),电子顺磁共振波谱仪(EPR)(A300,德国布鲁克公司),水浴恒温振荡器(SHA-C,金坛市宏华仪器厂),pH计(PHS-3C,上海精密仪器仪表有限公司).
1.2 CS-CoPcS制备
采用金属磺化酞菁模板合成法利用4-磺酰水杨酸、氯化钴和尿素等制备出CoPcS蓝色粉末备用[11].将1.5g的CS溶于50mL 浓度为2%(/)的乙酸溶液,磁力搅拌2h后静置脱气后通过针筒将其逐滴滴入到500mL的0.5mol/L的氢氧化钠溶液,形成的CS小球在碱液中静置3h,过滤并用超纯水反复冲洗至中性,60℃真空干燥至恒重.将1.5g CS小球投加至20mL浓度为10mmol/L的 CoPcS溶液,25℃条件下磁力搅拌6h,固液分离,用超纯水反复冲洗样品至洗脱液澄清,60℃真空干燥至恒重制备出CS- CoPcS.
1.3 试验与分析方法
在250mL锥形瓶中加入100mL已知浓度的MO溶液中,调节溶液初始pH0,加入一定量的CS- CoPcS和PS,置于水浴恒温振荡器中(=25℃),设置转速为150r/min,在一定时间间隔取样,用0.22μm的滤膜过滤,用分光光度计于波长464nm处测量其吸光度,3次平行试验分别测定反应前后MO浓度.测定结果通过准一级动力学模型进行拟合分析(1)~ (2):
式中:为反应时间,min;0和分别为MO初始浓度和在降解反应时间后的浓度),μmol/L;obs为准一级动力学反应常数,min-1.
2 结果与讨论
2.1 不同体系对MO去除率的影响
控制实验MO初始浓度为152.75μmol/L,pH0为5.5,对比了单独投加CS、CS-CoPcS、PS以及CS/PS和CS-CoPcS/PS等不同反应过程中MO的降解效率,实验结果如图1所示.PS、CS/PS和CS-CoPcS/PS体系中PS的投加量均为10mmol/L, CS、CS-CoPcS、CS/PS和CS-CoPcS/PS体系中催化剂投加量均为1.25g/L.从图1中可以看出,反应180min后,CS/PS体系中MO的去除率可达39.49%,而单独投加CS、CS-CoPcS和PS对MO的去除率分别为20.70%、13.99%和21.97%.图2为CS、CoPcS和CS-CoPcS的红外谱图,从图2中可以看出,1600cm-1、3382cm-1吸收峰分别为CS上的NH2的弯曲振动和-NH的伸缩振动,负载CoPcS反应后,该特征峰消失.1860cm-1、1503cm-1吸收峰为芳环中的C=N、C=C伸缩振动,729cm-1、876cm-1和951cm-1为酞菁骨架和金属配位振动,1340cm-1吸收峰为磺酸基中S=O的伸缩振动[12-13].以上分析表明,CS虽不能活化PS产生硫酸根自由基,但其自身的NH2、-NH等对MO具有一定的吸附能力,制备所得的CS-CoPcS, CoPcS成功负载于CS表面,致使CS有效吸附基团减少,导致MO去除率下降.分别对不同体系过程数据进行准一级动力学拟合,可以看出,CS-CoPcS、PS和CS/PS反应速率常数分别为0.09×10-2min-1、0.16×10-2min-1和0.29×10-2min-1,相比之下,CS- CoPcS/PS体系对MO的去除速率常数为1.24× 10-2min-1,180min去除率高达87.21%.对CS-CoPcS的SEM-EDS进行表征分析(如图3所示),从图3可以看出,CS-CoPcS的粒径为1006.52μm,表面光滑,Co占比为1.21%,表明制备所得的CS-CoPcS可以有效活化PS从而高效降解MO.

图1 不同体系对甲基橙去除率的影响
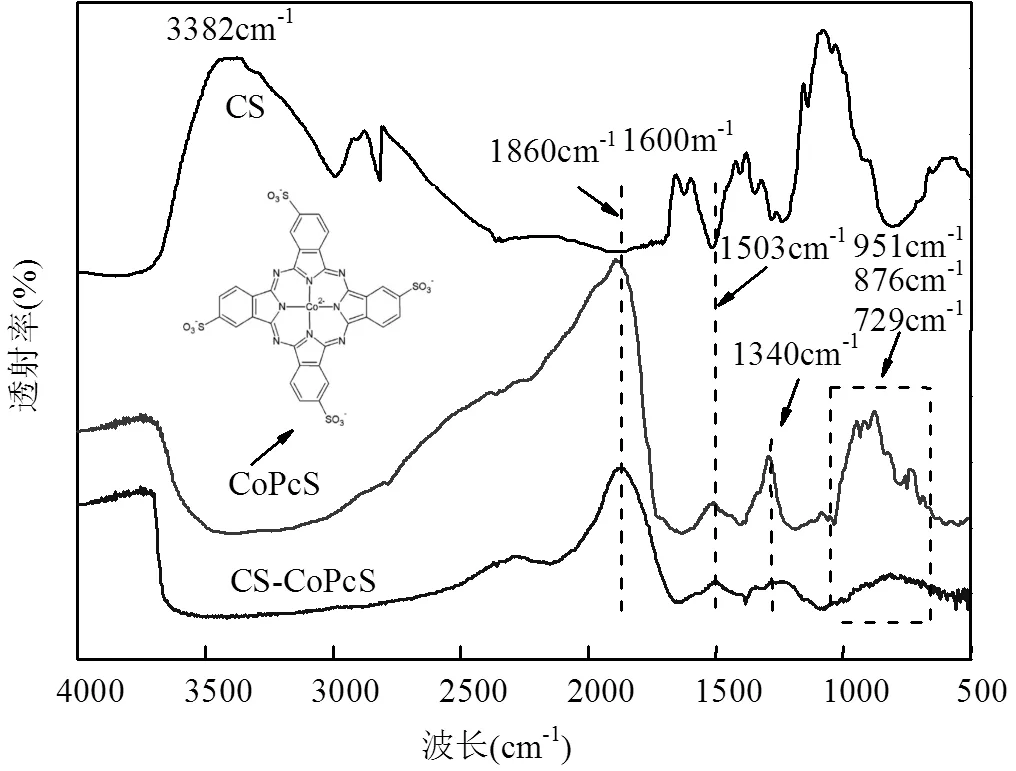
图2 CS、CoPcS和CS-CoPcS的红外谱
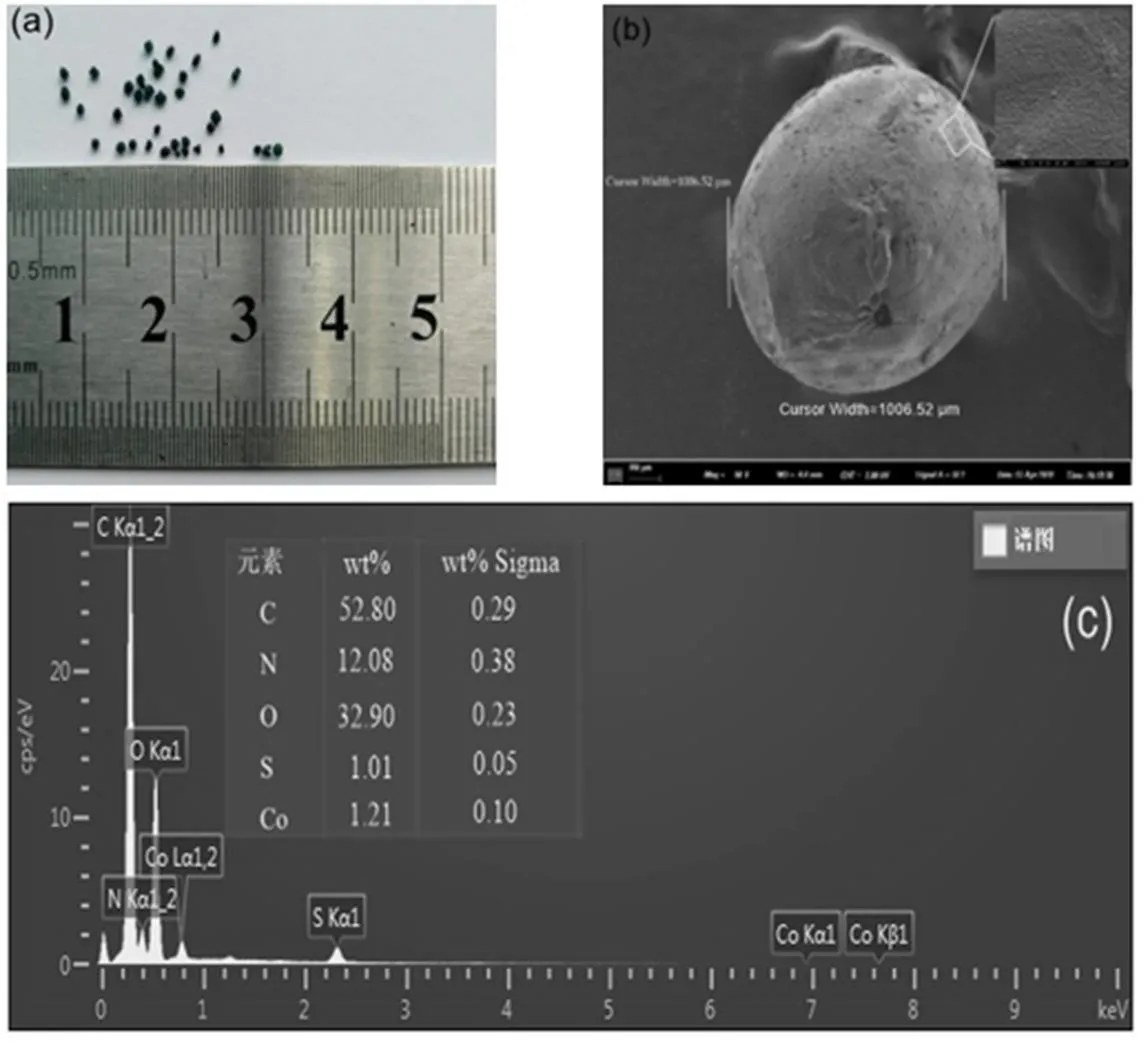
图3 CS-CoPcS的实物图像(a)和SEM-EDS图(b, c)
2.2 不同抑制剂对MO去除率的影响
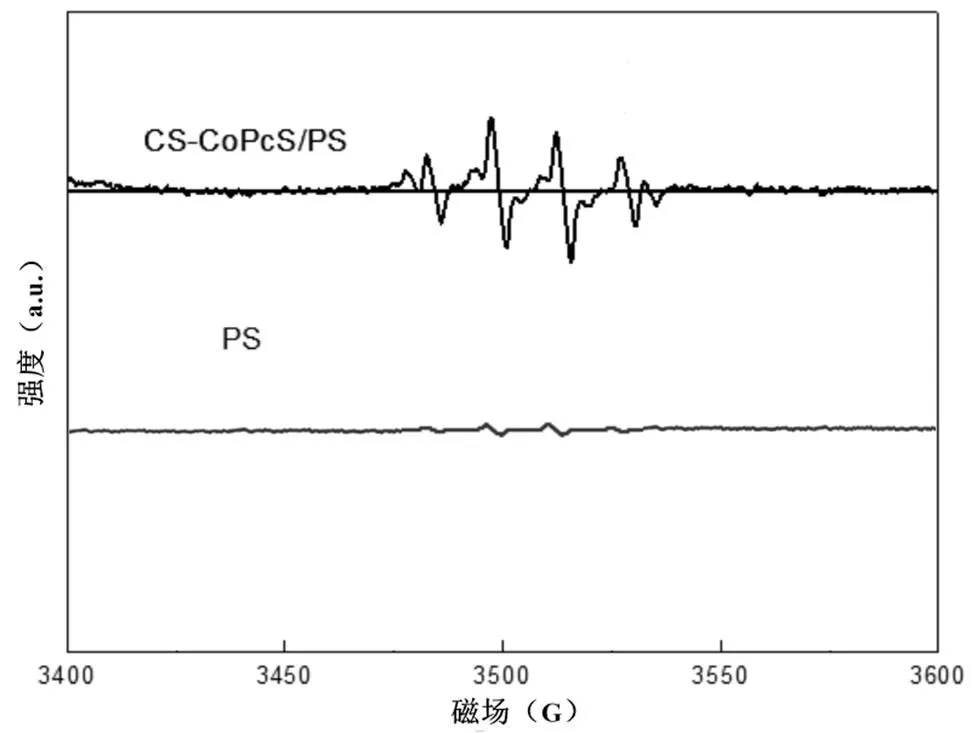
图4 PS和CS-CoPcS/PS体系的电子顺磁共振谱
过渡金属催化PS的过程中,可能产生硫酸根自由基和羟基自由基等活性氧物种(ROS),利用EPR(自旋捕捉剂DMPO)可识别CS-CoPcS/PS降解体系中产生的不同ROS.图4为PS和CS- CoPcS/PS体系的EPR谱图,可以看出,相比PS单独存在情况下,CS-CoPcS/PS体系的EPR谱图中出现了明显的硫酸根自由基和羟基自由基特征信号,进一步证实了CS-CoPcS对PS的活化作用. MA包含α氢原子,其与硫酸根自由基和羟基自由基均具有较高的反应速率(SO4-•=3.2×106mol/(L•s);•OH=9.7× 108mol/ (L•s)),TBA不包含α氢原子,其与硫酸根自由基和羟基自由基具有差异较大的反应速率(SO4-•=4.0×106-9.1×105mol/(L•s);•OH=3.8×108-7.6× 108mol/(L•s)),常作为羟基自由基的探针化合物.因而,通过淬灭实验可识别不同ROS在降解过程中的相对贡献[14].控制实验MO初始浓度为152.75μmol/ L,PS、CS-CoPcS的投加量分别为10mmol/L和1.25g/L, pH0为5.5,比较分别加入5mmol/L的MA和TBA前后(非)催化体系对MO降解效率的影响(图5).从图5可以看出分别加入MA、TBA后, 180min内,PS对MO的降解率分别降低了54.29%和21.77%,CS- CoPcS/PS体系对MO的降解率分别降低了54.13%和12.82%,可以看出在CS-CoPcS/ PS体系中MA的降解抑制率为62.07%,TBA的降解抑制率为14.70%,降解速率也分别由原来的1.32×10-2min-1降至0.25×10-2min-1和0.67× 10-2min-1.以上分析表明,硫酸根自由基和羟基自由基在CS-CoPcS/PS异相催化降解MO过程中均有贡献,而硫酸根自由基相比羟基自由基的作用效果更大,在降解过程中起主导作用.
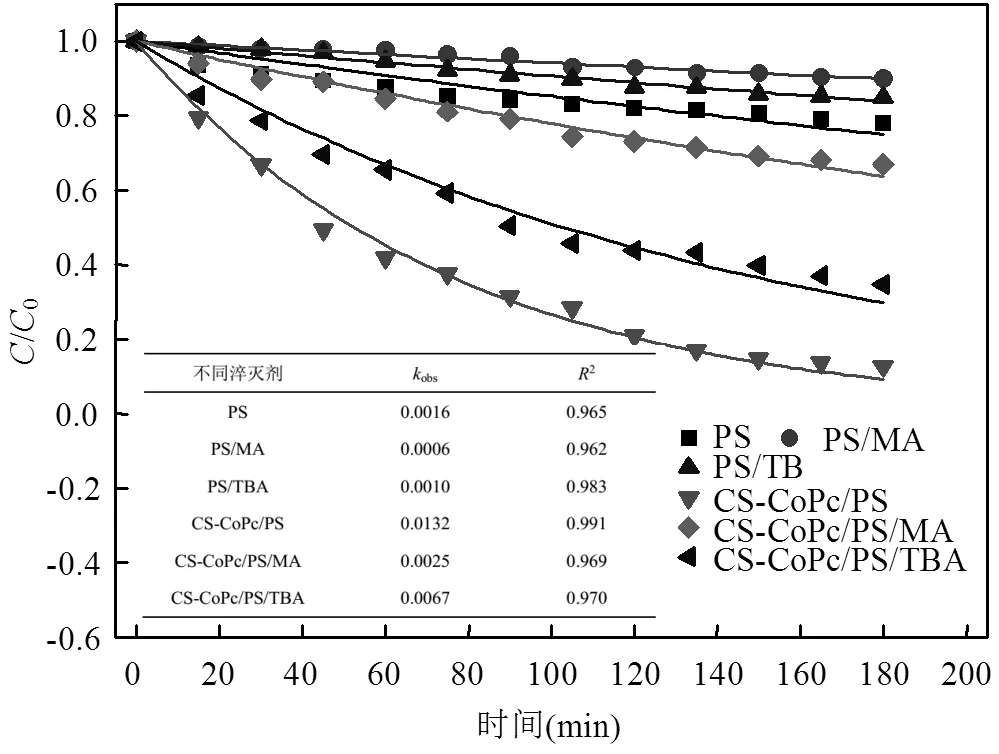
图5 不同抑制剂对甲基橙去除率的影响
2.3 溶液pH值对MO去除率的影响
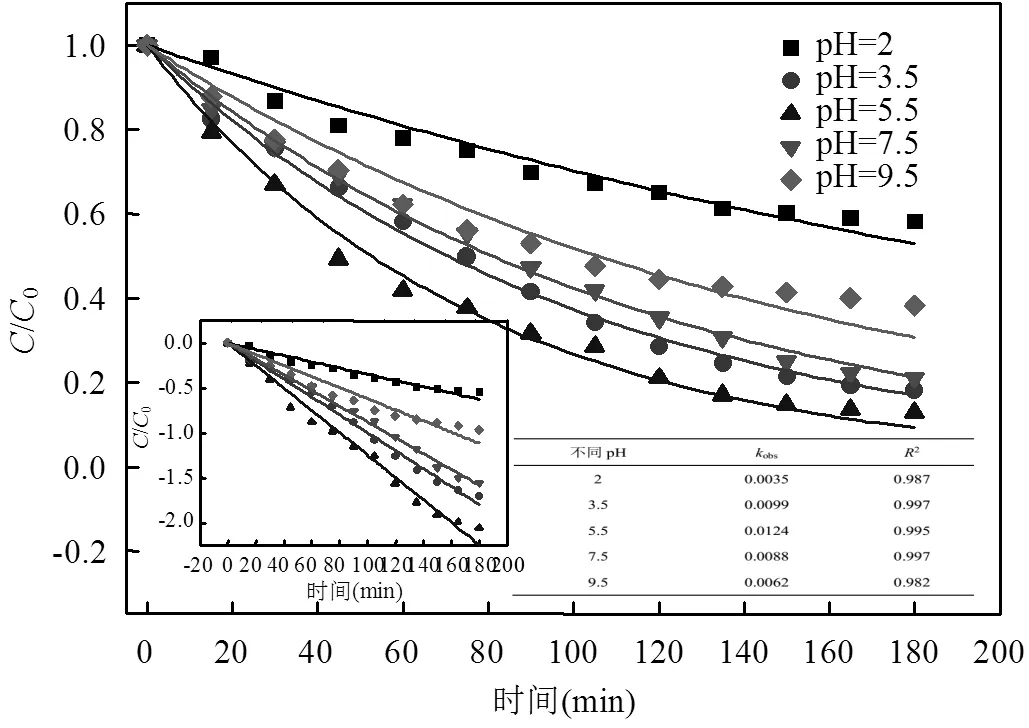
图6 溶液pH值对甲基橙去除率的影响
溶液pH值是影响过渡金属催化PS过程的一个重要因素,可直接或间接地影响体系的反应速率.当MO初始浓度为152.75μmol/L,PS和CS-CoPcS的投加量分别为10mmol/L和1.25g/L,调节溶液pH0,对比pH值在2.0~9.5范围下MO的降解情况,结果如图6所示.当pH0在4~7时,传统的Fe(II)/PS体系中的降解效率随着pH0的上升而急剧下降,相比之下,当pH0在3.5、5.5和7.5条件下,本实验中MO的降解仍可保持较高的降解效率(180min去除率分别为81.79%、87.21%和78.96%)和速率(分别为0.99× 10-2min-1、1.24×10-2min-1和0.88×10-2min-1),主要原因为酞菁结构与Co的配位作用,抑制Co(OH)2的形成,过氧链的均裂产生大量硫酸根自由基,从而降低pH值对降解体系的影响[15].当溶液pH值低于3时,体系中PS会转变为HS2O8-,形成四氧化二硫和硫酸氢盐,进而导致形成的有效硫酸根自由基减少,因而当溶液pH值为2.0时,MO的降解效率和速率仅分别为41.91%和0.35×10-2min-1[16].继续增大pH值至9.5,此时活化产生的硫酸根自由基可与体系中的OH-反应形成羟基自由基,致使MO的降解效率降低,降解效率和速率仍分别可达61.85%和0.62× 10-2min-1.
2.4 PS和CS-CoPcS投加量对MO去除率的影响

图7 不同PS投加量对甲基橙去除率的影响
控制实验MO初始浓度为152.75μmol/L,CS- CoPcS的投加量1.25g/L,pH0为5.5,对比不同PS浓度对MO降解效率的影响,如图7所示.从图7中可以看出,当PS从6mmol/L增至10mmol/L时,180min降解反应后,MO的降解效率从60.14%升至87.21%,准一级速率常数也由0.59×10-2min-1提升至1.24× 10-2min-1,分析原因为随着PS投加量的增加,催化PS产生的有效硫酸根自由基也相应增加,从而提高了MO的降解效率.继续增加PS的投加量至12mmol/ L和14mmol/L,MO的降解效率并未持续升高,相反出现了一定程度的降低,准一级速率常数分别降低至1.02×10-2min-1和0.92×10-2min-1,过量的PS可与催化产生的硫酸根自由基生成硫酸根离子产生淬灭效应,同时可能伴随着产生氧化能力较低的过硫酸根自由基[17].此反应与Fenton反应中过量的H2O2与羟基自由基间的淬灭反应相似.因此,CS-CoPcS催化PS降解MO的体系中PS的最适投加量为10mmol/L.
在上述最适实验条件下,进一步考察不同CS- CoPcS投加量对MO降解效率的影响(图8).从图8可以看出,CS-CoPcS投加量从0.5g/L到1.2g/L,MO的180min降解效率由61.28%增至87.21%,准一级速率常数也由0.62×10-2min-1提高至1.24×10-2min-1, CS-CoPcS投加量的增多为催化PS产生硫酸根自由基提供了更多的活性位点,继续增加CS-CoPcS投加量至1.5g/L, 180min降解效率和准一级速率常数仅分别升至88.06%和1.26×10-2min-1,恒定的PS投加量限制了更多硫酸根自由基的产生.
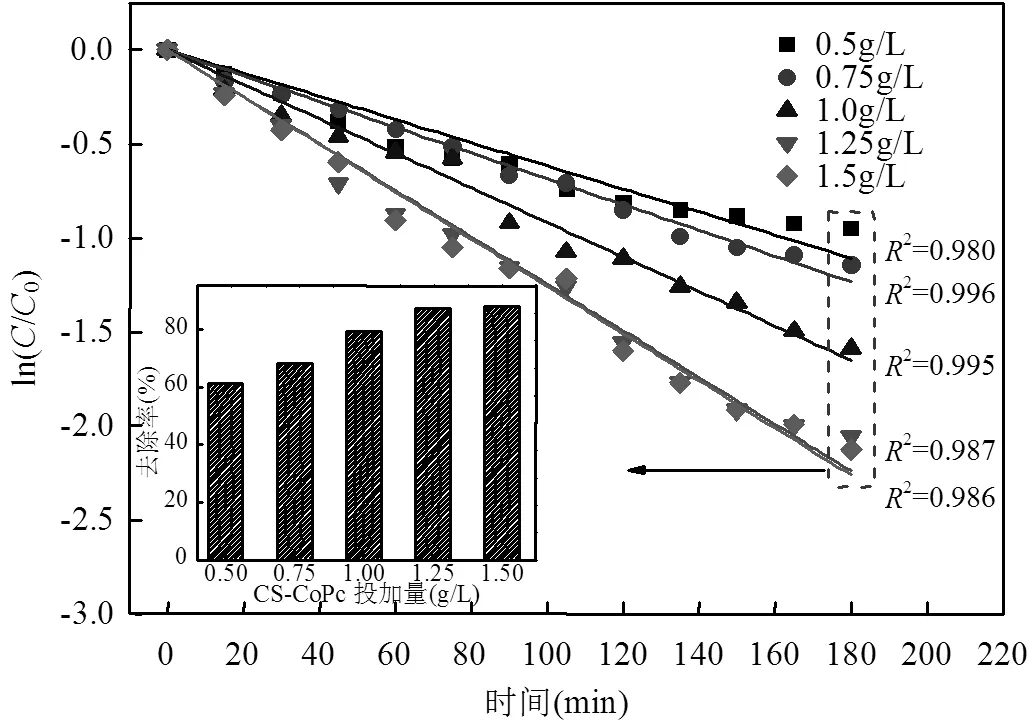
图8 不同CS-CoPcS投加量对甲基橙去除率的影响
2.5 初始MO浓度对去除率的影响
在以上选定的最适实验条件下,MO初始浓度控制在30.55~274.95μmol/L,考察不同MO初始浓度对降解效果的影响,如图9所示.初始MO在较低浓度时能快速降解,当MO初始浓度为30.55μmol/L,反应180min后的降解率和准一级动力学速率常数分别高达93.02%、1.82×10-2min-1,继续增大MO初始浓度,其降解率和降解速率依次降低,实验结果可归结于固定投加量的CS-CoPcS催化剂活化PS氧化剂产生恒定的有效降解自由基,高浓度MO和降解中间产物共同竞争硫酸根自由基等含氧活性物种,进而导致降解效率降低.

图9 初始甲基橙浓度对去除率的影响
2.6 CS-CoPcS的循环利用性
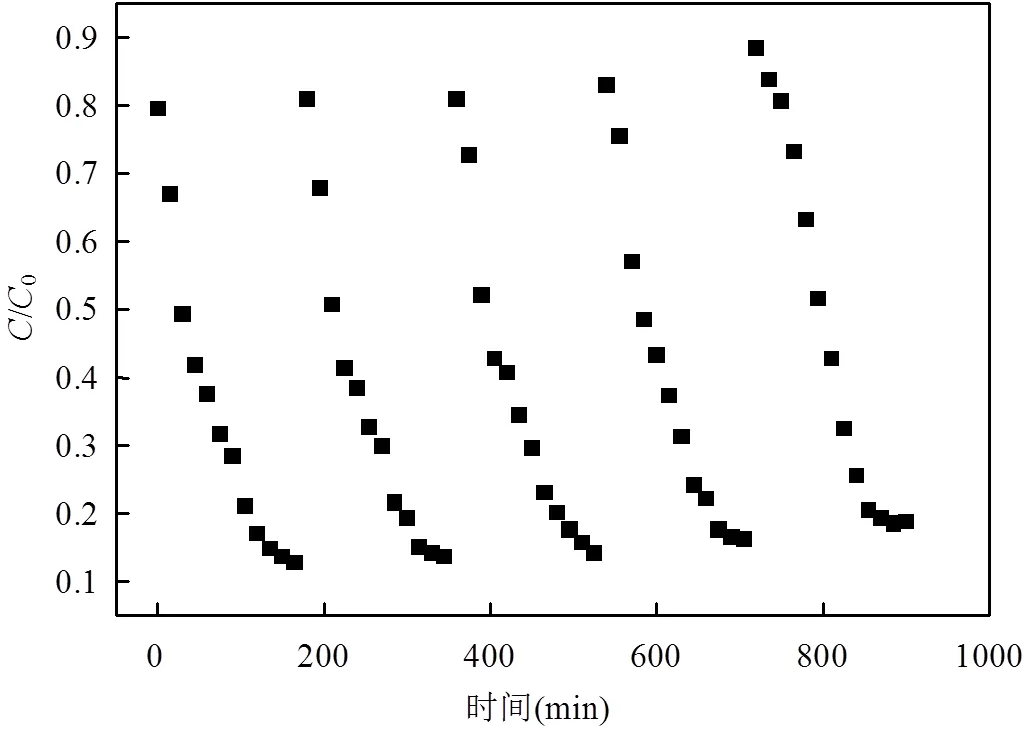
图10 CS-CoPcS催化PS降解甲基橙的循环测试
考察异相催化剂的循环利用性对于其实际应用具有重要的意义,取出催化反应后的CS-CoPcS,用去离子水冲洗3次,去除其表面PS和其它反应产物,60℃真空干燥后考察其循环利用性.已有的研究证实,过渡金属催化PS过程中,添加适当还原剂可实现过渡金属氧化态向还原态转化[18].本实验除控制最适实验条件外,降解体系中添加0.5mmol/L NaHSO3,4次循环实验中MO的180min降解率依次为86.35%、85.78%、83.79%和81.26%,表现出较好的催化活性,添加的NaHSO3可实现CS-Co(II)PcS与CS-Co(III)PcS间循环反应,进而提高CS-CoPcS的循环利用性,反应如(3)~(5)所示[19-20].此外,通过原子吸收光谱法未能检测出CS-CoPcS催化PS降解反应后溶液中潜在浸出的Co离子,表明CS-CoPcS能够比较稳定地应用于催化PS的高级氧化体系中.
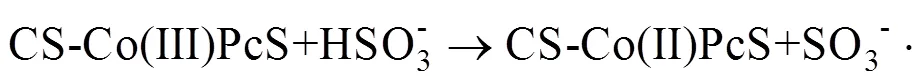
3 结论
3.1 通过CS负载CoPcS制备的CS-CoPcS可作为PS的高效绿色催化剂,同时表现出良好的循环利用性,未能检测出CS-CoPcS催化PS降解反应后溶液中潜在浸出的Co离子.
3.2 CS-CoPcS催化PS降解过程,相比Fe(II)/PS和Fenton体系具有较宽的pH值使用范围(pH0=3.5~ 7.5);MO的降解效率随CoPcS投加量的增加而升高,随着MO初始浓度的增加而降低;增加PS的投加量,MO的降解效率表现出先升高后略微降低的趋势.
3.3 硫酸根自由基和羟基自由基在CS-CoPcS/PS非均相催化过程中均有产生,而硫酸根自由基相比羟基自由基的作用效果更大,在降解过程中起主导作用, MO在180min催化反应后的降解效率可达87.21%.
[1] 董 振,刘 亮,郝 艳,等.偶氮染料废水处理技术的研究进展[J]. 水处理技术, 2017,(4):6-10. Dong Z, Liu L, Hao Y, et al. Research progress on the treatment of azo dye containing wastewater [J]. Technology of Water Treatment, 2017,(4):6-10.
[2] 岳 琳,王开红,郭建博,等.多金属氧酸盐电催化降解染料废水的研究[J]. 中国环境科学, 2013,33(1):88-94. Yue L, Wang K H, Guo J B, et al. Enhanced electro-catalytic oxidation of dye wastewater with polyoxometalates supported catalyst [J]. China Environmental Science, 2013,33(1):88-94.
[3] Su X H, Ling W L, Teng T T, et al. Combination and hybridisation of treatments in dye wastewater treatment: A review [J]. Journal of Environmental Chemical Engineering, 2016,4(3):3618-3631.
[4] Anipsitakis G P, Dionysiou D D, Gonzalez M A. Cobalt-mediated activation of peroxymonosulfate and sulfate radical attack on phenolic compounds. implications of chloride ions [J]. Environmental Science & Technology, 2006,40(3):1000-1007.
[5] 邓 靖,冯善方,马晓雁,等.热活化过硫酸盐降解水中卡马西平[J]. 化工学报, 2015,66(1):410-418. Deng J, Feng S F, Ma X Y, et al. Degradation of carbamazepine in water by thermally activated persulfate [J]. CIESC Journal, 2015,66(1):410-418.
[6] 骆靖宇,李学艳,李青松,等.紫外活化过硫酸钠去除水体中的三氯卡班[J]. 中国环境科学, 2017,37(9):3324-3331. Luo J Y, Li X Y, Li Q S, et al. Degradation of triclocarban aqueous solution through UV irradiation-activated sodium persulfate process [J]. China Environmental Science, 2017,37(9):3324-3331.
[7] Xia D H, Yin R, Sun J L, et al. Natural magnetic pyrrhotite as a high- Efficient persulfate activator for micropollutants degradation: Radicals identification and toxicity evaluation [J]. Journal of Hazardous Materials, 2017,340:435-444.
[8] Hadi H, Mojtaba M, Akbar B, et al. A novel bioelectrochemical sensing platform based on covalently attachment of cobalt phthalocyanine to graphene oxide [J]. Biosensors & Bioelectronics, 2014,52(2):136-142.
[9] And Z X, Xu Y. Immobilization of Palladium Phthalocyaninesulfonate onto Anionic Clay for Sorption and Oxidation of 2,4,6- Trichlorophenol under Visible Light Irradiation [J]. Chemistry of Materials, 2007,19(19):1452-1458.
[10] Ratnasamy P, Srinivas D. Selective oxidations over zeolite- and mesoporous silica-based catalysts: Selected examples [J]. Catalysis Today, 2009,141(1/2):3-11.
[11] Weber J H, Busch D H. Complexes Derived from Strong Field Ligands. XIX. Magnetic Properties of Transition Metal Derivatives of 4,4',4",4'''-Tetrasulfophthalocyanine [J]. Inorganic Chemistry, 1965, 4(4):469-471.
[12] Mack J, Stillman M J. Assignment of the optical spectra of metal phthalocyanines through spectral band deconvolution analysis and zindo calculations [J]. Coordination Chemistry Reviews, 2001,219(3): 993-1032.
[13] Wu S H, Wu J L, Jia S Y, et al. Cobalt (II) phthalocyanine-sensitized hollow Fe3O4@SiO2@TiO2hierarchical nanostructures: Fabrication and enhanced photocatalytic properties [J]. Applied Surface Science, 2013,287(24):389-396.
[14] Xia D H, Li Y, Huang G, et al. Activation of persulfates by natural magnetic pyrrhotite for water disinfection: Efficiency, mechanisms, and stability [J]. Water Research, 2017,112:236-247.
[15] Xu X R, Li X Z. Degradation of azo dye Orange G in aqueous solutions by persulfate with ferrous ion [J]. Separation & Purification Technology, 2010,72(1):105-111.
[16] Jeremy E. B. Mccallum, Madison S A, Alkan S, et al. Analytical Studies on the Oxidative Degradation of the Reactive Textile Dye Uniblue A [J]. Environmental Science & Technology, 2000,35(2).
[17] Li P, Liu Z, Wang X, et al. Enhanced decolorization of methyl orange in aqueous solution using iron-carbon micro-electrolysis activation of sodium persulfate [J]. Chemosphere, 2017,180:100.
[18] Peng H, Zhang W, Liu L, et al. Degradation performance and mechanism of decabromodiphenyl ether (BDE209) by ferrous- activated persulfate in spiked soil [J]. Chemical Engineering Journal, 2017,307:750-755.
[19] Zhang Y, Tran H P, Du X, et al. Efficient pyrite activating persulfate process for degradation of p-chloroaniline in aqueous systems: a mechanistic study [J]. Chemical Engineering Journal, 2017,308:1112- 1119.
[20] Huang Z, Bao H, Yao Y, et al. Novel green activation processes and mechanism of peroxymonosulfate based on supported cobalt phthalocyanine catalyst [J]. Applied Catalysis B Environmental, 2014, s154–155(s154–155):36-43.
Degradation of methyl orange by chitosan microsphere supported cobalt tetrasulfophthalocyanine activated persulfate.
CHEN Wei1, ZHANG Yu-dong2, CAI Jun-chen1, AN Ji-bin1*, ZHANG Xiao-ping2
(1.Chongqing Key Laboratory of Environmental Materials & Remediation Technologies, Chongqing University of Art and Science, Chongqing 402160, China;2.School of Environment and Energy, South China University of Technology, Guangzhou 510006, China)., 2019,39(1):157~163
Oxygen radicals (ROS) generated by transition metals catalysed activation of persulfate (PS) can be applied to degrade various organic pollutants. In order to avoid related second pollution of heavy metal under homogeneous catalytic system, a stable and effective catalyst (CS-CoPcS) was developed for PS activation by immobilizing cobalt tetrasulfophthalocyanine (CoPcS) onto chitosan (CS) microspheres covalently for the heterogeneous catalytic degradation of azo dye methyl orange (MO). The effects of different reaction conditions were studied. Furthermore, the stability of CS-CoPcS and possible mechanism were analyzed. The results showed that the MO removal efficiency could up to 87.21% at 25oC under the conditions of initial MO concentration of 152.75mmol/L, pH0value of 5.5, PS concentration of 10mmol/L and CS-CoPcS dosage of 1.25g/L. The kinetics data were fitted very well by pseudo-first-order model in 180min, and the removal rate was 1.24×10-2min-1. The comparison of the electron paramagnetic resonance (EPR) and different radical scavengers effect showed that sulfate radical was the dominant active species in the catalytic process. The results of recycling experiments after four runs indicated that the CS-CoPcS was recyclable for consecutive catalytic degradation of MO, and no detectable amount of cobalt ion in the aqueous solution after any runs reaction, which show high catalytic activity and structural stability of CS-CoPcS.
cobalt tetrasulfophthalocyanine;chitosan;persulfate;sulfate radical;methyl orange
X703
A
1000-6923(2019)01-0157-07
陈 炜(1987-),男,山西临汾人,讲师,博士,主要从事污染水体的深度处理技术.发表论文10余篇.
2018-05-22
国家重点研发计划项目(2016YFC0400702-2);国家自然科学基金资助项目(21507007);重庆市教委科学技术研究项目(KJQN201801324);重庆文理学院引进人才项目(R2018CH11)
* 责任作者, 副教授, anjibin99@126.com
