医用质子重离子加速器应用现状及发展趋势
2019-02-13杨小龙陈惠贤陈继朋马利强
【作 者】杨小龙,陈惠贤,陈继朋,乔 宇,马利强
兰州理工大学机电工程学院,兰州市,730050
0 引言
从全世界范围来看,癌症仍是威胁人类健康的主要疾病之一,在我国肿瘤死亡约占全部死因的1/4[1-2]。放射治疗作为肿瘤治疗的三大手段之一,在肿瘤的综合治疗方案中举足轻重。肿瘤放疗增益的提高在很大程度上依赖于放疗技术和放疗设备的优良性能。医用质子、重离子加速器作为当今国际社会公认的高性能尖端放疗设备,其应用和发展还有很大的提升空间。
近期国家部署的《中国制造2025》强国战略明确把高性能医疗设备作为重点发展的十大产业之一。我国制造业转型升级,对于高性能放疗设备,特别是医用质子、重离子加速器的创新发展迎来重大机遇。未来随着放疗技术和相关学科领域的进一步发展,以及医保政策的实质性实施,我国放疗设备市场将呈现加速增长态势。
1 质子与重离子治癌概述
1.1 物理学和生物学特性
质子和重离子束治疗肿瘤,是当今国际社会公认的最尖端放疗技术。质子和重离子都是带电粒子,与X射线、γ射线、电子线等常规射线不同,具有一定能量的质子和重离子在入射人体组织后存在集中沉积能量的Bragg峰,如图1[3]所示。在治疗肿瘤时,可以通过调节质子(或重离子)的能量,采用Bragg峰展宽技术(Spread Out Bragg Peak, SOBP)(如图2[4]),使射线作用于不同深度和大小的肿瘤,实现对肿瘤靶区的高剂量多野辐照,同时使肿瘤周围正常组织受到尽可能小的辐射损伤。相比之下,X射线、电子线、γ射线等常规射线在入射组织的起点附近能量就已经为最大值,到达肿瘤区域则衰减得更厉害,不仅不利于深部肿瘤的治疗,而且对正常组织产生较大程度的损伤。此外,X射线、电子线、γ射线属于低LET射线(Linear Energy Transfer, LET),其对氧存在的依赖性大,放疗过程中可能会使某些乏氧细胞存活下来,导致治疗的失败;而质子和重离子属于高LET射线,肿瘤细胞含氧量对其治疗影响不大,因此比常规射线具有更明显的治疗优势[5-7]。
1.2 性能比较
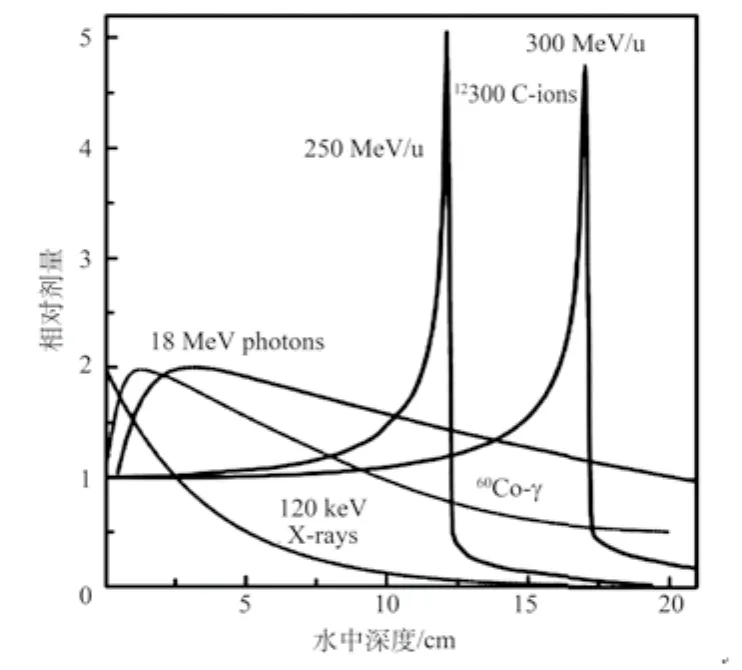
图1 [3] 120 keV的X射线、60Co-γ射线、高能光子以及250和300 MeV/u 12C6离子束在水中的深度剂量分布比较Fig. 1 Comparison of the depth-dose distribution in water of 120 keV X-rays,60Co -γ, high energy photons with 12C6 ions of 250 MeV/u and 300 MeV/u
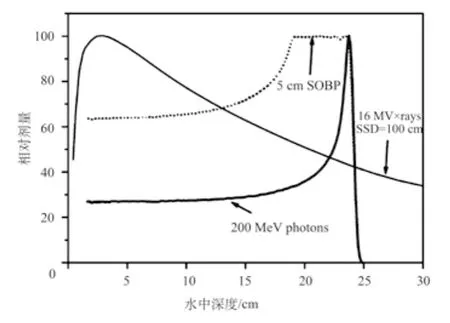
图2 [4] 200 MeV质子与16 MV的X射线在水中的深度剂量曲线及质子Bragg峰展宽(SOBP)曲线Fig.2 Depth-dose curves in water for a 200 MeV proton beam and a 16 MV X-ray beam and the spread-out Bragg peak (SOBP)of the proton
研究表明,重离子的线性能量密度(LET)、相对生物效应(Relative Biological Effectiveness, RBE)和氧增比(Oxygen Enhancement Ratio, OER)皆优于质子,而且剂量分布优势(Bragg峰)更为显著,所以辐射剂量可更多地沉积到人体深部的恶性肿瘤内,对肿瘤细胞更具杀灭性[8]。重离子束在治疗中表现出一系列的独特优点:治疗精度高(mm量级);剂量相对集中、照射治疗效率高;对肿瘤周围健康组织损伤更小;治疗过程可实时监测,便于控制位置和剂量、提高治疗精度[9]。因此,重离子被誉为面向21世纪最理想的放疗用射线。
2 医用质子、重离子加速器的国内外应用现状
肿瘤治疗的根本原则和理想目标是在尽量不损伤健康组织的前提下实现肿瘤局部控制率TCP的最大化,并且提高患者在治疗后的生存质量。医用质子加速器和医用重离子加速器的出现及其先进放疗技术的应用,正好为21世纪肿瘤精确放疗的进一步发展提供了更为广阔的空间。医用质子加速器和医用重离子加速器技术复杂,造价昂贵,目前只有少数几个国家能够自主建造,其产品在某方面也反映出一个国家的科技水平。
2.1 系统构成
从结构组成原理上,医用重离子加速器系统和医用质子加速器系统基本相同,主要包括加速器系统、束流传输系统、治疗终端系统(旋转机架、治疗头、治疗床)和治疗计划系统(TPS)。加速器系统是医用加速器的核心部分,目前世界上医用质子/重离子加速器治疗中心使用的加速器基本有三种类型:直线加速器、回旋加速器和同步加速器[10]。直线加速器通过电场控制使粒子沿直线方向加速,加速器长度与能量增益成正比,若将其作为主加速器,则所需的规模非常庞大,所以常将直线加速器用作线性辅助加速;回旋加速器通过间隙电场对粒子进行加速,粒子活动轨迹类似一个螺旋线,其磁场强度决定了加速器尺寸,而且可以提供稳定束流强度,但很少能够调节参数,需要其他装置配合调制强度;同步加速器是由多级磁铁组成的狭窄真空环,粒子在环内反复循环获得加速,其能量可变,但是需要注入和引出系统,操作相对复杂[11-13]。医用质子加速器通常采用回旋加速器或者同步加速器,将质子加速到70~250 MeV的能量用于临床治疗。现有或正建的医用重离子加速器治疗中心主加速器均采用能量可调的同步加速器,注入器则采用直线加速器或回旋加速器,如日本医用重离子加速器中心(HIMAC)和德国GSI的注入器都使用直线加速器,而中国科学院兰州近代物理研究所建设的医用重离子加速器(HIMM)的注入器则使用运行可靠、占地面积更小的回旋加速器[14]。
2.2 医用质子加速器(Medical Proton Accelerators)
1954年,美国加州大学劳伦斯伯克利国家实验室(Lawrence Berkeley National Laboratory,LBL)首次利用质子射线对晚期乳腺癌患者进行治疗,至此拉开了人类利用高能粒子治疗恶性肿瘤的序幕。到1990年,美国Loma Linda大学医学中心(LLUMC),研制成功世界首台医用质子同步回旋加速器,并投入临床使用。此后,由于医学影像技术、射线控制技术和计算机放疗计划系统的进展,使得质子放疗变得可控和精确,医用质子加速器市场迅速发展。
目前,几乎所有的医用质子加速器治疗中心的质子源采用回旋加速器或者同步加速器[15],回旋加速器与同步加速器技术已经相对比较成熟,两者性能比较如表1[16]所示。质子治疗时,加速器系统将质子束加速到极高能量(70~250 MeV),然后能量选择系统(ESS)根据治疗计划给予质子束确定能量,该能量的量等于患者身体中的特定穿透距离,再由传输系统将束流聚焦、塑形并引导至治疗室,最后通过毫米精度的治疗头将质子束导向靶目标。一个治疗中心常建有多个治疗室,分为固定束治疗室和旋转机架治疗室(如图3[17]),每个治疗室均配备有治疗床,能根据3D影像自动将患者精准地移动至正确的治疗位置。放疗时旋转机架与治疗床运动相结合,在TPS系统的引导下选择最佳的辐射方向和角度对病人进行治疗。
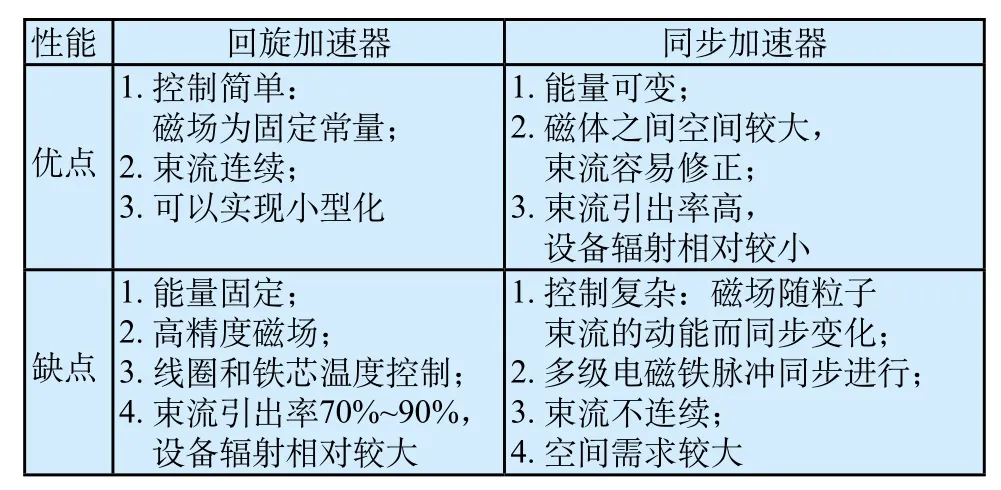
表1 [16] 回旋加速器与同步加速器性能比较Tab.1 The performance comparison between cyclotron and synchrotron
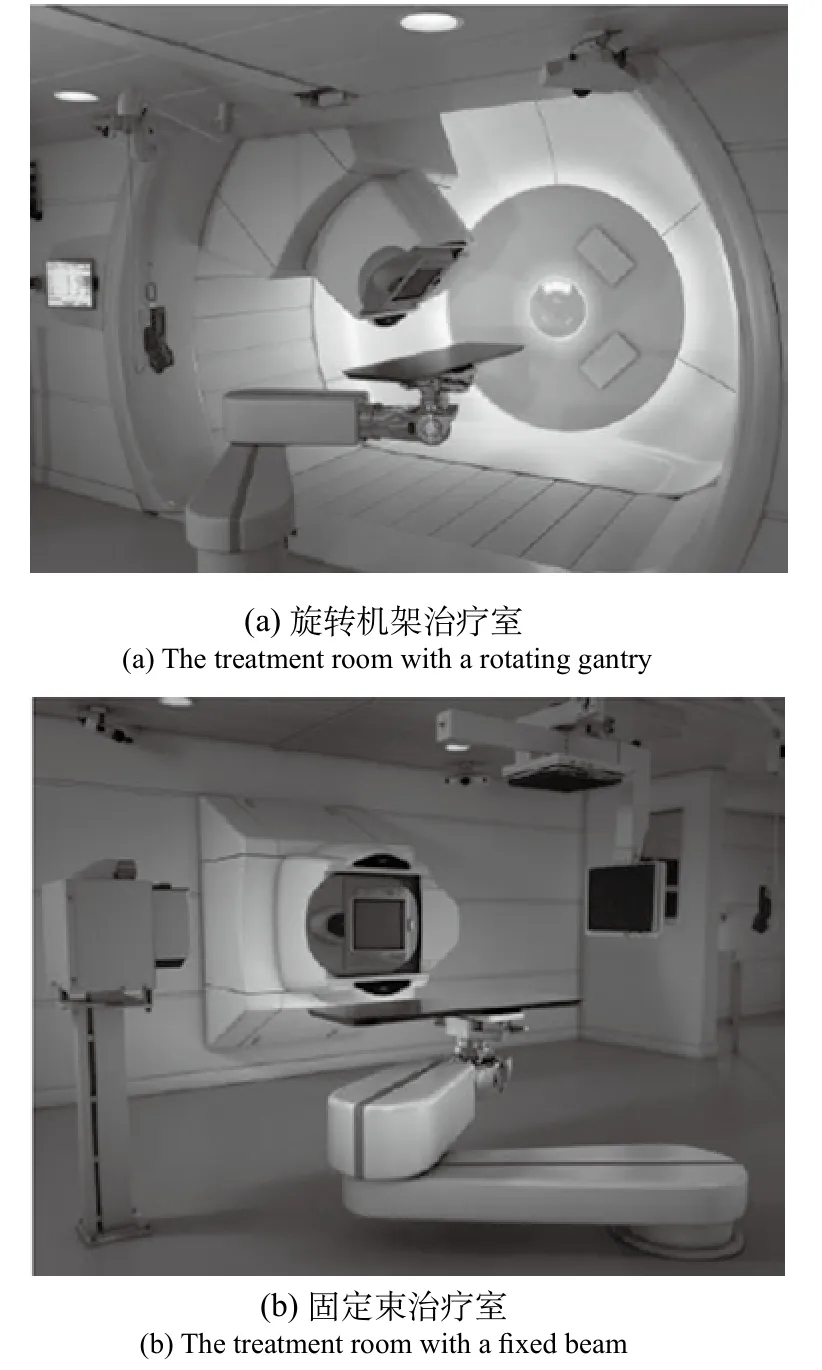
图3 [17] 治疗室Fig.3 The treatment room
近年来,超导等先进技术的应用,使得医用质子加速器系统更加紧凑。世界上第一台医用超导回旋质子加速器于2007年在瑞士投入运营[18],之后,超导、激光加速等先进技术研究突飞猛进。由于设备规模和成本原因,已有的医用质子加速器治疗中心通常建设在人口稠密的大城市,为了更多的人能够接受质子治疗,国际上一些著名的制造商都投入到紧凑型单室质子治疗系统的研发当中。图4[19]为Still River Systems(SRS)公司的紧凑型单室医用质子加速器系统的概念设计,该紧凑型系统硬件设施主要包括旋转机架、治疗床和超导同步回旋加速器Monarch250。其中,Monarch250质量约20 t,直径1.7 m,是目前最先进的紧凑型医用质子源[19-20]。根据国外PTCOG网站统计,目前全球有超过100个正在运营和在建的医用质子加速器治疗中心,主要集中在欧洲、美国和亚洲。国际上医用质子加速器设备的主要制造商有美国的Varian、ProNova、Mevion,比利时的 IBA,日本的日立、三菱、东芝等。

图4 [19] Still River Systems紧凑型单间医用质子加速器系统概念设计Fig.4 The conceptual design for the Still River Systems single compact treatment room proton beam radio-therapy
国内质子加速器放射治疗起步较晚,2004年山东淄博万杰医院首次引进比利时IBA公司的医用质子加速器开始临床治疗。2015年上海质子重离子医院引进的西门子设备也投入运营,该医院成为中国首家拥有质子和重离子放疗技术的医疗机构。2018年1月,中国核工业集团公司的230 MeV质子超导回旋加速器(CYCIAE-230)的核心部件—高频腔系统通过源地验收,下一步将进入整机总装和测试阶段,然后逐步实现临床应用。CYCIAE-230是我国首个具有自主知识产权的医用质子加速器先进设备,其系统设计紧凑,总质量约200 t,由主磁体系统、超导线圈系统、RF系统、内置PIG源、引出系统、真空泵和提升系统等组成,最大设计引出能量达到240 MeV。图5[21]为CYCIAE-230系统的布局图。
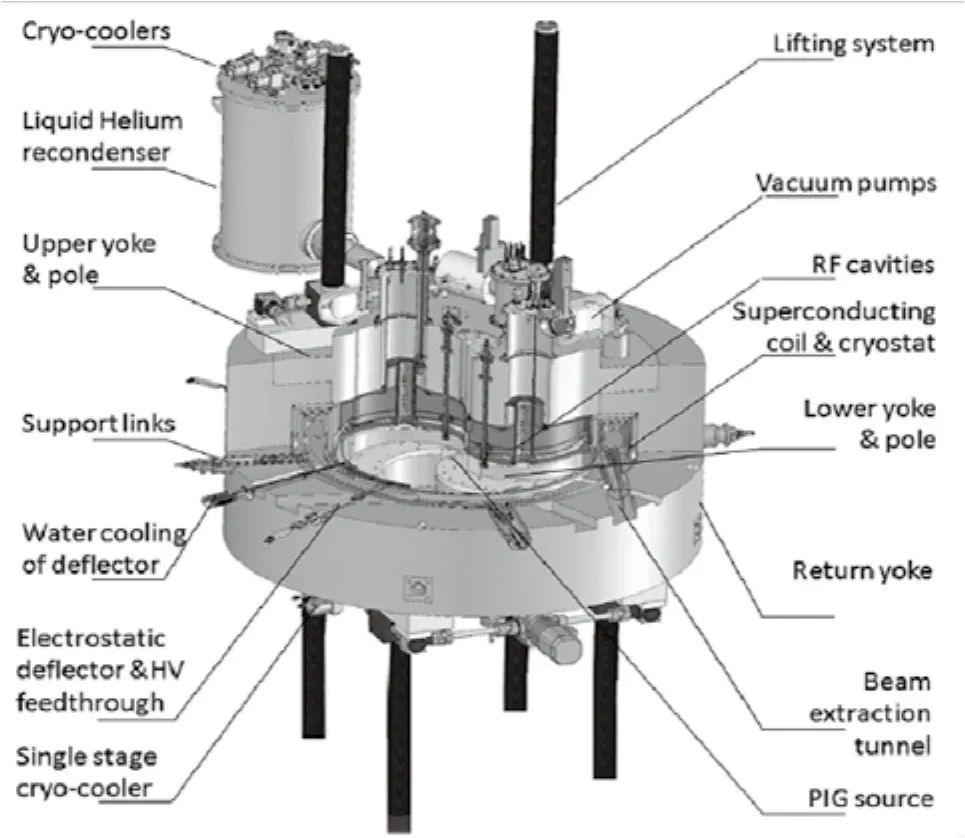
图5 [21] 中核集团CYCIAE-230系统的布局图Fig.5 The layout of superconducting cyclotron CYCIAE-230
2.3 医用重离子加速器(medical heavy ion accelerators)
与质子放疗相比,重离子放疗虽然更被看好,但是对技术和设备的要求更高,投入也更大,因此其临床试验起步也较晚。1975年,美国加州大学LBL实验室首次利用高能同步重离子加速器进行Ne离子束放疗临床试验研究,发现肿瘤局部控制率比常规射线提高了2~3倍(见表2[22]),取得了较高的肿瘤治愈率。1992年,有关部门停止提供经费,LBL实验室关闭,美国也将主要精力用于发展医用质子加速器治疗中心。1994年,日本国立放射医学综合研究所(NIRS)在千叶县建成世界上第一台医用重离子加速器(HIMAC),并选用碳离子束作为治疗方法进行临床治疗。截止2016年,HIMAC治疗肿瘤患者的数量已经达到约10 000例[23]。鉴于良好的临床治疗效果,日本政府2003年批准碳离子治疗成为尖端的肿瘤治疗技术,并且计划在全日本继续兴建50~60个医用重离子加速器治疗中心[24]。随后,NIRS为了推广重离子治疗,将重点放在研发紧凑型医用重离子加速器的技术上,以期望降低建造成本。图6是NIRS研发的一种紧凑型医用重离子加速器,由RFQ加速器和APF型DTL加速器作为注入器,将C4+离子加速到4 MeV/u后注入到一个周长为61.5 m的同步加速器中,并最终加速到400 MeV/u[25]。
国际上,日本和德国在医用重离子加速器治癌领域起步较早,产业化发展也较完整,目前相关技术遥遥领先;美国早期注重质子治癌的相关研究,在医用质子加速器精确治癌技术方面已处于全球领先地位,但近年来受到日本等国家重离子治癌疗效的鼓舞,也重新唤起了对重离子放疗的研究。在欧洲,1996年德国亥姆霍兹重离子研究中心(GSI)基于重离子物理研究的同步加速器建成了重离子治癌装置,开发了栅扫描束流配送系统、面向生物学效应的治疗计划系统和在线正电子发射计算机断层显像(PET)束流监测系统三项先进技术,实现了重离子束的适形调强治疗和束流的实时监控[26]。目前,由GSI研制的两台紧凑型医用粒子加速器已在德国海德堡质子重离子治疗中心(HIT)和意大利国立质子重离子治癌中心(CNAO)投入运行。HIT的注入器由一台RFQ加速器和一台DTL加速器组成,将碳离子加速后注入一个周长为65 m的同步加速器中,并最后加速到430 MeV/u[27]。图7[28]为IBA公司与俄罗斯科学家合作研发的一种新型紧凑型超导同步回旋加速器系统,该系统能够将C6+离子和He2+加速到400 MeV/u,还可将质子加速到265 MeV/u,是目前研发的最先进的紧凑型医用重离子加速器系统。

表2 [22] LBL的20Ne离子束治疗效果Tab.2 The therapeutic effect of the 20Ne ion beam in LBL
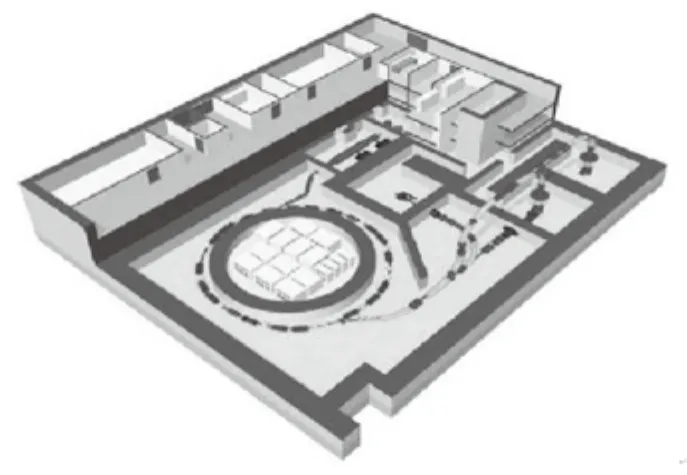
图6 NIRS新型紧凑型医用重离子加速器布局图Fig.6 The layout of a novel compact medical heavy ion accelerator

图7 [28] IBA公司的C-400紧凑型超导同步回旋加速器Fig.7 IBA's C-400 compact superconducting synchrotron
在国内,鉴于重离子放疗技术在肿瘤治疗上的显著效果,中国科学院近代物理研究所(IMP)从1995年开始启动重离子治癌研究项目。2005年,IMP在兰州重离子研究装置(Heavy Ion Research Facility in Lanzhou, HIRFL)的基础上自主设计建成重离子治疗浅层肿瘤装置并开始收治病人。这使得中国成为国际上继美国、德国、日本之后的第四个拥有重离子治癌技术的国家[29]。在HIRFL治癌研究的基础上,IMP与武威荣华集团和武威肿瘤医院合作,已经建成了武威紧凑型医用重离子加速器(HIMM)[30], HIMM成为国内首台具有自主知识产权的医用重离子加速器,武威HIMM目前已进入临床试验阶段。HIMM由同步加速器、回旋注入器、离子源、束流传输线和四个治疗终端组成。离子源产生12C6+束流,通过回旋加速器和同步加速器加速,引出到治疗终端进行肿瘤治疗。表3[31]列举了HIMM的重要参数。IMP未来新一代的医用重离子加速器将对各系统进行优化设计,实现更加紧凑型的同时还会降低成本,这将更加有利于医用重离子加速器的应用以及重离子放疗技术的推广[25]。同时,医用重离子加速器治疗终端相关治疗计划系统和治疗床的研究进步,也将为重离子高精确放疗技术提供重要的保障。当前,中国多省市的医用重离子加速器项目也正在建设规划当中。

表3 [31] HIMM装置的重要参数Tab.3 Important parameters of the HIMM device
3 医用质子、重离子加速器及其放疗技术的发展趋势
3.1 放疗技术高精确化
未来医用加速器放疗技术发展的方向是基于先进的质子/重离子放疗设备,综合利用呼吸门控技术(Gating Technique)、实时成像及追踪技术、精确摆位技术以及剂量引导、生物适形等先进技术,以高治疗增益为目的,实现肿瘤的高精确化放疗。基于医用电子直线加速器的精确放疗,虽然在IMRT、IGRT和4DCT精确放疗技术方面取得了显著地进步,但是由于X射线辐射剂量随组织深度而成指数衰减的特性,就不可避免地对正常组织产生较大的损伤。而质子和重离子在入射人体组织后存在集中沉积能量的Bragg峰,具有独特的剂量分布优越性,更适合于肿瘤的高精确化放疗。治疗计划系统(TPS)在精确放疗中扮演着重要的角色,医用质子加速器TPS系统中,美国Varian公司的Eclipse系统和日本Hitachi公司的系统已经相对比较成熟,能够实现调强质子治疗(Intensity Modulated Proton Therapy, IMPT)、实时图像门控质子束治疗(Real-time Image Gated Proton Beam Therapy, RGPT)、锥形束CT治疗(Cone Beam CT,CBCT)等先进治疗计划。由于重离子相对生物效应(RBE)在体内是变量,其计算理论基础与质子完全不同,医用重离子加速器TPS目前正处于进一步发展之中。另外,医用重离子加速器用于放疗的离子束主要是碳离子,重离子种类众多,寻求更高治疗增益的其它粒子也将是未来研究的方向。
3.2 设备集成化、小型化
医用质子加速器和医用重离子加速器的集成化是未来研究发展的方向之一,即将质子束和重离子束放疗的功能集成于同一医用加速器系统,以实现复合治疗、综合利用、降低成本的目的。由于医用重离子加速器系统和医用质子加速器系统结构组成原理基本相同,目前世界上已有或在建的一些紧凑型医用质子/重离子加速器兼具有质子和重离子放疗的功能,如日本宾库粒子束治疗中心(HIBMC)、德国海德堡质子重离子治疗中心(HIT)、意大利国立质子重离子治癌中心(CNAO)和中国上海质子重离子医院等[32]。高治疗增益、小型化、低成本的需求推动着医用质子加速器和医用重离子加速器技术不断的进步。虽然近年来超导等先进技术的使用,使得医用质子/重离子加速器更加紧凑,但是与人们期望的更加小型化的设备相比,仍然存在着较大距离。实现医用加速器系统的更加小型化,并且降低治疗成本,将是未来设备研究的重点。随着激光加速(Laser Acceleration)、固定场交变梯度加速器(FFAG)、高梯度线性加速器(High-gradient Linacs)、超导磁铁(Superconducting Magnets)等先进技术的发展及应用,未来实现与当今医用电子直线加速类似的小型化粒子治疗设备将不再遥远[33-34]。
3.3 系统智能化
现代医学的发展对医疗设备的智能化提出越来越高的要求,智能化转型是未来医用质子、重离子加速器等放疗设备发展的必然趋势。医用加速器的智能化将有效结合高精确放疗技术、现代通信与信息技术、计算机网络技术、先进制造技术以及智能材料[35]等,实现放疗过程的自动化、网络化、信息化和动态标准化,减小因放疗人员业务水平差异等因素对治疗结果造成的影响。另外,可通过网络建立更为强大的肿瘤放疗数据库, 实现智能系统管理和资源共享,为肿瘤治疗的综合性研究提供更加广阔的大数据平台。
4 结语
随着肿瘤发病率的逐年递增,可以预见,未来高性能医用质子、重离子加速器的市场需求十分广阔。加速器技术、放疗技术和各交叉学科的进步为现代医用质子、重离子加速器的发展提供了良好的条件;《中国制造2025》的宏伟蓝图,为我国医用质子、重离子加速器及相关技术的创新发展迎来重大机遇。与国际同行相比,我国的医用质子、重离子加速器产业发展还不完善,要参与到高端放疗设备的国际竞争,国内企业依然任重而道远。我们相信,随着放疗技术和加速器技术的发展及其广泛应用,一定会更好地造福于肿瘤患者。
