嵌合抗原受体T细胞免疫治疗在自身免疫病的研究进展
2019-02-12王鹏程综述刘志红审校
王鹏程 综述 刘志红 审校
随着对自身免疫病发生、发展机制的认识不断加深,人们对于自身免疫病的治疗方式已不仅仅局限于传统的激素及广谱免疫抑制剂。各种针对自身免疫病致病细胞及细胞因子的大分子靶向药物及生物制剂也在临床逐渐得到广泛的应用,例如靶向肿瘤坏死因子α(TNF-α)、CD19及白细胞介素6受体(IL-6R)的单克隆抗体能够通过与其靶抗原特异性结合起到选择性抑制免疫的作用。相比于激素及广谱免疫抑制剂,大分子靶向药物的靶向性更强且副作用更小,但其依然无法促成免疫平衡永久性恢复,患者往往需要终身用药。因此,寻找能够永久恢复免疫平衡的全新治疗方法至关重要。
嵌合抗原受体T细胞(CAR-T)免疫治疗,是一种新型的精准靶向细胞免疫疗法,其主要通过基因编辑技术使T细胞表达嵌合抗原受体从而特异性识别并杀伤表达相应抗原的靶细胞进而治疗疾病。该疗法已经在急性B淋巴母细胞白血病等血液系统肿瘤的临床试验中取得了非常好的治疗效果。CAR-T治疗具有高度特异性及持续恢复免疫平衡的潜能,因此该疗法也在逐渐拓展应用于自身免疫病中[1]。临床前研究的初步结果支持CAR-T治疗在自身免疫病中的应用。本文将结合CAR-T治疗在自身免疫病中的最新研究成果,阐述该疗法的免疫机制、应用策略及发展趋势,为后续临床研究拓展思路。
CAR-T治疗的免疫机制
CAR-T治疗的流程主要包括:(1)从外周血收集患者的T淋巴细胞;(2)体外活化T细胞后使其表达嵌合抗原受体并扩增;(3)将改造后的CAR-T细胞回输至患者体内。在回输至患者体内后,CAR-T细胞表达的嵌合抗原受体通过识别并结合相应抗原使CAR-T细胞活化增殖,进而特异性杀伤靶细胞。
T细胞活化
抗原特异性T细胞的活化是CAR结构设计的关键及CAR-T细胞发挥效应的基础。未被活化的T细胞处于相对静止状态,增殖能力很弱且不具备效应功能,被称为初始T细胞;而活化后T细胞则迅速克隆扩增并发挥效应,被称为效应T细胞。T细胞的活化主要依赖两种信号的协同作用:第一信号由T细胞受体(TCR)与抗原肽-主要组织相容性复合物(p-MHC)的结合介导,导致CD3分子上的免疫受体酪氨酸激活基序(ITAMs)的磷酸化及下游一系列信号通路的激活[2];而第二信号则依赖于共刺激分子CD28与其配体CD80/86的结合,其主要作用是提高免疫应答的持久性及扩增强度[3]。TCR-p-MHC的结合所形成的免疫突触决定了T细胞免疫应答的抗原特异性,而共刺激分子与其配体的结合则决定了T细胞免疫应答的强度,缺乏任一信号均不能使T细胞充分活化(图1A)。
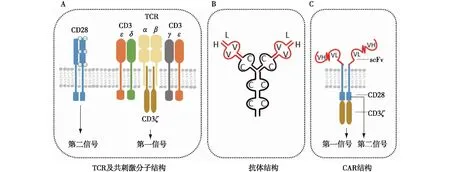
图1 TCR、抗体及CAR结构[2-6]TCR:T细胞受体;CAR:嵌合抗原受体;scFv:单链抗体可变区;H:重链;L:轻链;V:可变区;C:恒定区;VH:重链可变区;VL:轻链可变区;CAR结构主要由TCR及共刺激分子的胞内信号传导结构域以及抗体的可变区组成;A:TCR及共刺激分子结构,其第一信号和第二信号分别由CD3分子和CD28共刺激分子介导,两者独立向胞内传递活化信号,T细胞缺失任一信号均无法充分活化;B:抗体结构,包含两条轻链和两条重链,其中轻链及重链的可变区(v)是与靶抗原特异性结合的区域,CAR结构胞外的scFv片段即来源于自该部分;C:CAR结构,其第一信号和第二信号位于同一条链,胞外scFv片段与靶抗原的结合即可使T细胞充分活化
CAR结构组成
CAR结构由胞外至胞内主要包含抗原识别区、铰链区、跨膜区以及胞内活化信号区四个部分。 抗原识别区位于细胞的最外侧,其作用是识别特定抗原,主要结构为由抗体的重链可变区(VH)以及轻链可变区(VL)连接而成的单链抗体可变区(scFv)[4](图1B)。铰链区连接于scFv与跨膜区之间,负责为scFv提供一定的柔韧性,其结构主要来自于CD8α,IgG1或IgG4的氨基酸片段。跨膜区负责胞连接胞外的铰链区和胞内活化信号区,对于维持CAR结构的稳定性非常重要,其结构主要来源于CD3ζ,CD28以及CD8α的跨膜区片段[5]。胞内活化信号区主要包含CD28、4-1BB等共刺激结构域以及CD3ζ链的胞内结构域,其作用则是传递第一信号及第二信号促进CAR-T细胞的活化增殖[6](图1C)。CAR结构的设计来源于TCR,因此两者在生物学功能上很相似,均能在识别抗原后介导T细胞的活化。然而CAR与TCR在抗原的识别上存在显著的差异:CAR结构的抗体识别区为来源于抗体的scFv片段,因此类似于抗体能够识别靶细胞表面直接暴露的抗原;而TCR则识别靶细胞表面的p-MHC分子复合物,不能直接识别靶细胞表面直接暴露的抗原,具有MHC限制性[7]。CAR结构一方面结合了抗体的抗原特异性与T细胞高效的杀伤能力,另一方面解除了普通T细胞对抗原识别的MHC限制性,极大地提高了CAR-T细胞的效能。
CAR-T细胞的沿革
随着对CAR胞内活化信号区信号传导及T细胞效应机制的认识不断加深,CAR结构设计经历了第一代至第四代的发展。第一代CAR结构的胞内区只包含CD3ζ结构域,仅能引起较低程度的T细胞活化及扩增[4]。第二代CAR结构在胞内区除了包含CD3ζ结构域以外还添加了一种共刺激结构域(CD28或4-1BB),使得CAR-T细胞的杀伤能力及持久性显著增强[8]。第三代CAR结构的胞内区则除CD3ζ外还包含两种或多种共刺激结构域(如CD28和4-1BB)[9]。一些研究提示第三代CAR结构较第二代CAR结构的杀伤能力更强,而另外一些研究却得到相反的结论,因此目前临床上使用的CAR-T治疗仍然主要采用第二代CAR结构。除此以外,一些研究提出了第四代CAR结构的概念,即在常规CAR结构外还添加了促炎性细胞因子或共刺激因子配体的表达,进一步增强了CAR-T细胞的活化从而产生比前三代CAR-T更强的杀伤效果(图2)[10]。

图2 第一代至第四代CAR结构[4,8-10]scFv:单链抗体可变区;VH:重链可变区;VL:轻链可变区;第一代CAR胞内部分仅包含CD3ζ结构域;第二代CAR胞内部分在第一代的基础上添加了一种共刺激结构域;第三代CAR胞内部分在第一代的基础上添加了两种不同的共刺激结构域;第四代CAR除了本身CAR结构外还额外表达细胞因子或共刺激分子配体
CAR-T治疗在自身免疫病的应用策略
目前临床上CAR-T治疗主要应用于B细胞来源的造血系统肿瘤,而在自身免疫病的发生发展过程中,自身抗原特异性B细胞及其他免疫细胞也起着重要的促进作用。不仅如此,造血系统肿瘤和自身免疫病在病理生理特征上的相似性也支持了CAR-T治疗自身免疫病的巨大潜力,具体表现为:(1) 造血系统肿瘤细胞及自身抗原特异性免疫细胞均在循环中散在分布,CAR-T细胞与其靶细胞可充分接触;(2) 造血系统肿瘤细胞及自身抗原特异性免疫细胞均来源于骨髓造血干细胞,表达特定的免疫细胞相关抗原,可作为CAR-T治疗的靶点。因此,自身免疫病的病理生理特点提示CAR-T治疗在自身免疫病中具有很大潜力。若能够通过CAR-T治疗完全清除自身抗原特异性免疫细胞或持久抑制其活性,则可能使自身免疫病得到完全治愈或维持在不发病状态[1]。
通常CAR-T细胞是指CAR-CD8+T细胞,其效应机制是通过分泌穿孔素和颗粒酶杀伤靶细胞。而更广义的CAR-T细胞还包含CAR-CD4+T细胞,按功能又可进一步将其分为辅助性CAR-Th细胞以及调节性CAR-Treg细胞,分别发挥辅助免疫应答及负向调控免疫应答的作用。在肿瘤的CAR-T治疗中,肿瘤细胞是唯一的目标,因此肿瘤的CAR-T治疗主要依赖CAR-CD8+T细胞对肿瘤细胞的特异性杀伤以及CAR-Th细胞对免疫应答的辅助。然而,自身免疫病往往涉及多种免疫细胞针对自身抗原的异常活化。因此在自身免疫病的CAR-T治疗策略上与肿瘤有所不同:一方面可以使用多种CAR-T细胞靶向多个不同免疫环节;另一方面可以充分利用自身抗原与相应受体的特异性结合设计CAR结构使CAR-T细胞选择性杀伤或抑制自身抗原特异性免疫细胞。在目前的研究中,CAR-T治疗在自身免疫病中的应用策略主要包括两类:靶向自身抗原特异性免疫细胞的CAR-CD8+T细胞治疗以及靶向组织特异性抗原的CAR-Treg细胞治疗。前者能够直接杀伤自身抗原特异性免疫细胞,而后者则能够在组织局部抑制多种免疫细胞介导的炎症反应。
CAR-CD8+T细胞治疗
靶向CD19+B细胞B细胞及其分泌的自身抗体在多种自身免疫病的发生发展中均起着重要的促进作用,因此在B细胞表面普遍表达的CD19是自身免疫病中CAR-T细胞的候选靶点之一[11]。在近期的一项临床前研究中,Rita[12]等发现使用CD19靶向的CAR-T细胞能持续清除狼疮模型小鼠脾脏及外周血中的CD19+B细胞、降低自身免疫性抗体产生、逆转疾病相关靶器官的损害并延长小鼠的存活时间。该研究揭示了CAR-T治疗在系统性红斑狼疮等自身免疫病中的治疗潜能,值得在临床研究中进一步探索(图3A)。
靶向自身抗原特异性B细胞虽然靶向CD19+B细胞的CAR-T治疗研究在小鼠模型中取得了不错的治疗效果,但是该策略存在的重要缺陷是CAR-T细胞会清除包括正常B细胞在内的所有CD19+B细胞。这使得患者面临极大的感染风险,并可能导致体液免疫记忆的消失(记忆性B细胞也被清除)。在自身免疫病中,并非所有B细胞均参与疾病发生,只有自身抗原特异性的B细胞才会在识别自身抗原后增殖并产生大量自身抗体。因此,使用CAR-T细胞选择性杀伤自身抗原特异性B细胞则可能有效避免清除正常B细胞从而减少感染等副作用的发生。在一项临床前研究中Christoph[13]等巧妙地将CAR结构的胞外抗原识别区设计为自身抗原肽并将其命名为嵌合自身抗体受体(chimeric autoantibody receptor,CAAR)。该研究发现在小鼠的寻常型天疱疮模型中,表达该病自身抗原Dsg3肽段的CAAR-T细胞能够选择性结合并杀伤Dsg3特异性的自身免疫性B细胞而不会杀伤正常B细胞(图3B)。
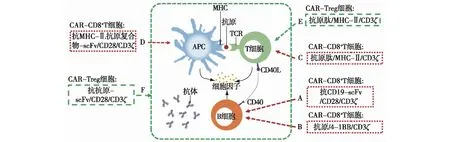
图3 自身免疫病CAR-T治疗策略[12-18]CAR-T:嵌合抗原受体T细胞;MHC:主要组织相容性复合物;TCR:T细胞受体;APC:抗原递呈细胞;自身免疫病的CAR-T治疗策略主要包含CAR-CD8+T细胞治疗(A~D)及CAR-Treg细胞治疗(E,F);A:靶向CD19+B细胞的CAR-CD8+T治疗;B:靶向自身抗原特异性B细胞的CAR-CD8+T治疗;C:靶向自身抗原特异性辅助性CD4+T细胞的CAR-CD8+T治疗;D:靶向递呈自身抗原细胞的CAR-CD8+T治疗;E:靶向自身抗原特异性辅助性CD4+T细胞的CAR-Treg治疗;F:靶向组织特异性抗原的CAR-Treg治疗
靶向自身抗原特异性辅助性CD4+T细胞除了B细胞以外,自身抗原特异性辅助性CD4+T细胞也参与了许多自身免疫病的发生发展[19]。自身抗原特异性辅助性CD4+T细胞在受到抗原递呈细胞(antigen presenting cell,APC)递呈的抗原肽-MHC-II复合物后一方面能够分泌大量促炎性细胞因子,另一方面能促进生发中心反应及自身抗体的产生,因此选择性靶向这群细胞或许能够在治疗疾病的同时减少副作用的发生。Moisini等[14]设计了包含小鼠实验性过敏性脑脊髓炎(experimental allergic encephalomyelitis,EAE)特异性抗原髓鞘碱性蛋白(myelin basic protein,MBP)片段、MHC-II分子以及TCRζ链的嵌合受体以模拟APC的抗原递呈作用。该研究结果显示在小鼠EAE疾病模型中过继回输表达嵌合受体T细胞能够有效杀伤自身抗原特异性的辅助性CD4+T细胞并治疗疾病。相较于对照组小鼠,治疗组小鼠的疾病严重程度更低并且存活时间更长(图3C)。
靶向自身抗原递呈细胞APC对自身抗原的递呈也是自身免疫病的重要环节,因此在自身免疫病的CAR-T治疗中,递呈自身抗原的APC也可以作为CAR-T细胞的靶细胞。在一项临床前研究中,Zhang等[15]在NOD小鼠I型糖尿病模型中利用能够识别胰岛素B链9-23肽-MHCII复合物的单克隆抗体片段设计了针对递呈自身抗原APC的CAR-T细胞。该研究发现该CAR-T能够特异性识别并杀伤递呈自身抗原的APC,并且过继回输该CAR-T细胞能够延缓NOD小鼠糖尿病的发生(图3D)。
CAR-Treg细胞治疗
Treg细胞是一群以免疫抑制及维持免疫耐受为特征的CD4+T细胞亚群,通常稳定表达CD25及转录因子Foxp3以行使其免疫抑制功能。既往研究表明Foxp3基因的突变会使Treg细胞功能缺陷并导致严重的自身免疫病[20]。Treg细胞发挥免疫调控作用的机制主要包括释放抑制性细胞因子,破坏效应T细胞代谢通路,抑制抗原递呈细胞以及细胞毒性作用等等。
自身免疫病的发生发展往往伴随着致病性效应性免疫细胞(包括自身抗原特异性DC、效应性T细胞以及B细胞等)与Treg细胞免疫平衡的破坏。例如在系统性红斑狼疮中,DC分泌的大量IL-6以及IFN-a会抑制Treg细胞的抑制功能,而辅助性CD4+T细胞分泌的IL-21亦会影响Treg细胞的存活及功能。不仅如此,系统性红斑狼疮患者体内强烈的促炎环境还会转变Treg细胞使其分泌IL-17等炎性细胞因子。这些因素最终导致Treg细胞的数量和抑制功能显著降低,不足以维持免疫稳态[21]。因此,增强Treg细胞的数量及抑制功能使免疫平衡得到恢复或许是自身免疫病治疗的关键。
既往研究发现过继回输多克隆Treg细胞能够抑制或预防自身免疫病的发生[22]。但多克隆Treg细胞中抗原特异性细胞极低的比例可能影响治疗效果,且大量多克隆Treg细胞回输可能会造成系统性免疫抑制。事实上,的确有研究发现在输入多克隆Treg细胞后体内病毒再次活化[23]。而使用抗原特异性的Treg细胞则可能会避免这些缺点。与多克隆Treg细胞相比,抗原特异性Treg细胞回输所需细胞数量更少,而且能富集于炎症局部减轻周围免疫细胞对组织的损伤。不仅如此,一些动物实验研究表明抗原特异性的Treg细胞在抑制功能上亦强于多克隆Treg细胞[24]。
体外制备抗原特异性Treg细胞的经典方法主要包括多克隆Treg细胞与APC和特定抗原共孵育或者设计能够靶向特定抗原的TCR-Treg细胞。使用APC扩增抗原特异性Treg细胞效率非常低,而TCR-Treg细胞识别抗原的MHC限制性使其在大量患者中难以广泛应用。与以上两种方法相比,抗原特异性的CAR-Treg细胞则既可以较好地扩增而又不存在MHC限制性。因此,CAR-Treg细胞治疗或许是增强抗原特异性Treg细胞量能的最佳选择[22]。在2005年,Divya等[16]设计了了包含MBP抗原、MHC-II及TCRζ链的受体修饰Treg细胞(receptor-modified T cell,RMTC)。该研究发现发现过继回输RMTC能够预防并治疗小鼠EAE疾病模型,证实通过使Treg细胞特异性抑制自身抗原特异性CD4+T细胞可以有效抑制小鼠自身免疫病的发生发展(图 3E)。不仅如此,通过编辑Treg细胞使其表达靶向组织特异性抗原的CAR片段同样能增强其抑制自身免疫病的效果。在既往临床前研究中,Moa等[17]通过向CD4+T细胞导入靶向小鼠髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)的CAR序列并使其过表达转录因子Foxp3设计了MOG特异性的CAR-Treg细胞。该研究发现靶向MOG的CAR-Treg细胞具有良好的免疫抑制功能且经鼻黏膜给药后能够定位于中枢神经系统并有效抑制EAE的进展。与之相似,Dan等[18]在癌胚抗原(carcinoembryonic antigen,CEA)转基因小鼠中发现靶向CEA的CAR-Treg细胞在回输后能够定位于结肠并降低T细胞转移性结肠炎的严重程度(图3F)。以上两项研究证实靶向组织特异性抗原的CAR-Treg细胞能够定位至相应组织并在局部抑制多种免疫细胞介导的炎症反应。
在CAR-CD8+T细胞介导的杀伤与CAR-Treg细胞介导的免疫抑制两种策略中,CAR-Treg细胞或许是更好的选择。一方面,在自身免疫病的发生发展过程中,多种免疫细胞均参与致病,而CAR-CD8+T细胞仅能杀伤某一种免疫细胞,对其他类型的自身免疫细胞没有杀伤作用;而CAR-Treg细胞能通过细胞-细胞间相互作用及分泌多种抑制性细胞因子抑制多种自身免疫细胞的活性。另一方面,CAR-CD8+T细胞杀伤靶细胞时释放的大量炎性细胞因子可能会进一步加重自身免疫病患者的组织损伤;而CAR-Treg细胞能够抑制局部炎症反应,可能有助于缓解组织损害。
小结:CAR-T治疗作为一种全新的细胞免疫疗法,已经在造血系统肿瘤中展现出强大的治疗潜力,而其在自身免疫病以及其他类型疾病中的应用研究才刚刚起步。CAR-T治疗的研究重点及未来的发展方向主要聚焦于异体或通用型CAR-T细胞治疗、多靶点CAR-T细胞治疗、扩展CAR-T治疗适应证、提高CAR-T治疗安全性及CAR-T联合其他药物治疗等方向。另外,噬菌体展示技术、转座酶系统及基因编辑等技术的不断进步也将有助于提高CAR-T治疗的安全性及有效性。期待在不远的将来,CAR-T治疗能够作为常规一线疗法广泛应用于肿瘤、自身免疫病等目前尚无法根治的疾病,为患者带来治愈的希望。
