糖尿病肾病与糖尿病视网膜病变的关联
2019-02-12综述刘志红审校
徐 颖 综述 刘志红 审校
糖尿病肾病(DN)和糖尿病视网膜病变(DR)是常见的糖尿病微血管并发症。DN发生在20%~40%的糖尿病患者中,是终末期肾病的主要病因之一。DR是20~74岁成年人致盲的主要原因,几乎所有的1型糖尿病和60%的2型糖尿病在20年后会发生DR。肾脏与眼睛在起源、发育和结构方面有着惊人的相似性[1]。同时多因素Logistic回归分析显示DN是唯一独立与DR相关的并发症,DR提示发生DN的可能性增加了至少3.78倍,严重的增殖性DR提示DN风险甚至达到23.56倍,其中1型糖尿病的预测能力强于2型[2]。在糖尿病人群中,有CKD提示存在DR(46.0%vs31.6%)的可能性更高[3],而DR人群中DN的患病率也高于无DR人群(19.4%vs4.1%)[4]。越来越多的临床和基础研究证实DN和DR存在极大的相关性。
流行病学特点
2015年,全球约有4.15亿成年人患有糖尿病,其中90%是2型糖尿病。20~79岁成年人中每11人就有1人患糖尿病,其中中国超过1亿。糖尿病并发症可分为大血管并发症和微血管并发症,是患者发病和死亡的主要原因。微血管并发症包括DN、DR和糖尿病神经系统病变,见于约半数的糖尿病患者。10%的2型糖尿病患者的死因为DN,同时DN也是引起终末期肾病的主要原因之一。2型糖尿病中DR的发生率约16%~35%,是青壮年人群致盲的主要原因。
作为糖尿病微血管并发症,DN和DR发生存在极大的相关性。一直以来,不断有队列研究探索DN和DR之间的关联(表1),提示DN是DR发生的危险因素,罹患DN的患者更有可能发生DR,反之亦然。
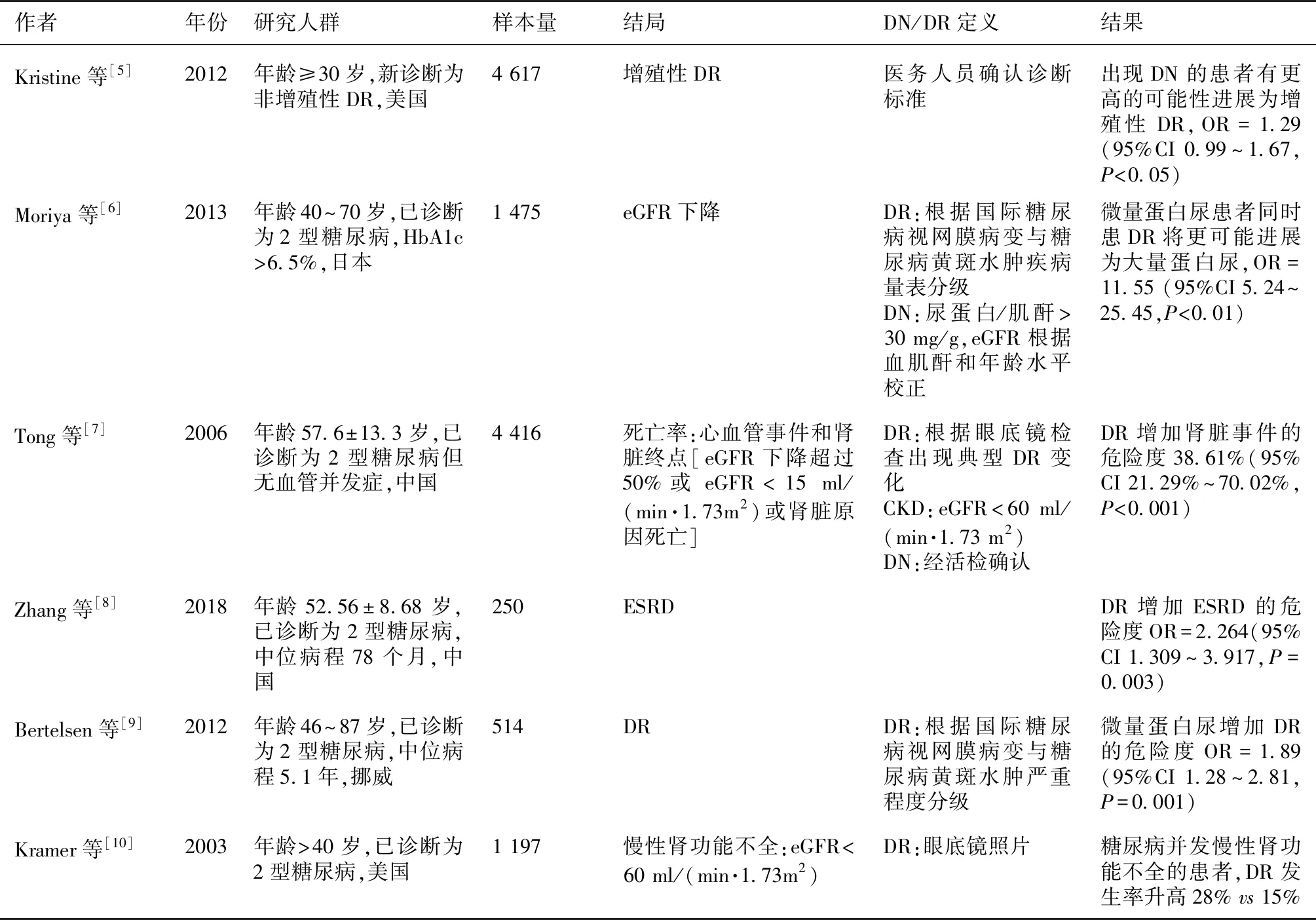
表1 糖尿病肾病和糖尿病视网膜病变的队列研究结果
DN:糖尿病肾病;DR:糖尿病视网膜病变;eGFR:估算的肾小球滤过率;CKD:慢性肾脏病;ESRD:终末期肾病;HbAlc:糖化血红蛋白
这些结果证实DN和DR发生存在相互关联,但由于研究之间存在的种群、样本量以及观察终点等差异,在不同研究中DN合并DR的发生率并不一致,DN和DR可以独立存在。为了探究只发生DN而不发生DR患者的特点,Li等[11]收集了104例经肾活检证实的DN患者,其中52例无DR。相比于合并DR,无DR的患者血清肌酐更低(P=0.028)、血清白蛋白(P=0.023)和血红蛋白(P=0.001)更高,并发糖尿病神经病变的可能性也更小(P=0.001)。Grunwald等[12]研究发现,近一半的CKD患者存在眼底病变,在CKD患者中存在视力缺损的人数也是非CKD患者人群的接近3倍(36.1%vs12.9%,P<0.001)。同时,该作者提出在糖尿病患者中进行眼底检查可提示肾脏病变。CKD患者及时且频繁的检查眼底,能够有效减少眼底病变的发展及视力下降。目前来说,尚无准确预测DN早期诊断的指标,肾穿刺活检仍然是诊断DN的最佳方法。
病理改变的关联
基于DN和DR常常合并存在的流行病学特点,人们试图通过无创、简便、低成本的眼底镜检查替代有创、难以预测的其他微血管并发症检测手段。在眼底相片中,测量视神经周围的动脉和静脉血管直径,计算中央动脉、视网膜中央静脉尺寸和动静脉直径比(AVR),这些数值可以提示心血管意外的风险[13]。同样的,也已经有一些试图通过眼底镜来预测肾脏病理改变的研究。多项横断面研究显示视网膜静脉直径的扩大与DR和DN的严重程度有关[14]。目前,在人工智能技术的推动下,计算机能够在没有直接人工干预的情况下建议诊断并实施临床管理。将人工智能应用于DN和DR的识读及诊断技术也在不断革新。在过去的数年里,已有不少使用人工智能预测DR的技术发布,敏感度与特异度均超过80%。在新加坡国家DR筛查项目和10个多种族糖尿病群组研究中[15],为了检测DR深度学习模型的使用效率,共计使用DR及其相关疾病(可疑DR、严重DR、可疑青光眼和年龄相关黄斑部退化)494 661张视网膜图像,其中274 169个图像用于训练,220 492个图像用于测试。诊断DR的灵敏度为90.5%,特异度为91.6%,诊断严重DR灵敏度达100%。使用机器学习识别DN肾穿刺标本的各区域并进行分级,识别肾小球准确度为93%,识别肾小球结构的灵敏度为95%,特异度为99%。机器进行的DN分级与高级病理专家判定结果一致性的Cohen’s kappa=0.55[16]。这些结果表明,深度学习模型的检测毫不逊色于人工检查,这将大大降低诊断花费而不影响诊断结果。相信在不久的将来,通过人工智能大量识别DR眼底图像及DN病理切片,可从病理水平上评价它们之间的关联,通过对视网膜形态和功能的仔细评估来监测DN发生与进展。
共同危险因素
DN和DR的发生受到很多传统危险因素的影响,年龄、性别、糖尿病病程等。但人们发现,在很多控制良好的糖尿病中仍有相当数量的患者患DN,相反的,部分糖尿病控制差的患者也并未发生DN。在DR中也存在类似的现象。很多研究已经表明,除了基因背景和种族之外,DN和DR存在很多共同危险因素(表2),DN和DR互为危险因素。

表2 DN和DR的危险因素[17-18]
DN:糖尿病肾病;DR:糖尿病视网膜病变
共同发病机制
氧化应激氧化应激在糖尿病微血管并发症的发生发展中起着至关重要的作用。糖尿病的代谢异常可导致线粒体超氧化物的过度产生。超氧化物生成增加是糖尿病组织损伤的中心和主要介质,导致多元醇途径、晚期糖基化终产物(AGEs)形成、AGEs受体及其激活配体的表达增加、蛋白激酶C(PKC)异构体的激活和己糖胺通路的过度活化,以及两种抗动脉粥样硬化酶内皮型一氧化氮合酶(eNOS)和前列环素合成酶(PGES)的失活,最终导致糖尿病微血管并发症[23]。
肾素-血管紧张素系统(RAAS)血管紧张素Ⅱ通过产生活性氧诱导炎症反应和内皮细胞失功能,同时参与调控细胞外基质,活化多重组织损伤信号通路。RAAS不仅存在于肾脏,同时也存在于视网膜血管。在DR时,眼内肾素和血管紧张素Ⅱ水平升高[19]。
AGEs 晚期AGEs是一组异质的化合物,它们通过非酶糖化蛋白反应形成,高糖可加速其形成。与AGEs受体结合后,细胞周期阻滞、凋亡、迁移改变,产生促炎细胞因子。AGEs可引起肾脏系膜细胞的凋亡、炎症因子产生。在DR中,视网膜周细胞是AGEs的主要靶点,会引起周细胞的氧化应激增加、成骨分化和钙化,同时引起凋亡[20]。
PKC 糖尿病时,视网膜和肾小球中甘油二酯水平升高,继而激活PKC及其下游多条通路,引起基膜增厚、细胞外基质增加、血管通透性增加及新生血管形成[21]。
含SH2结构域的蛋白酪氨酸磷酸酶1(SHP-1)激活高糖会激活SHP-1活性,从而抑制肾脏保护因子如肾小球内皮细胞与足细胞的血管内皮生长因子(VEGF),导致DN的进展。高糖会激活PKCδ/p38α MAPK,从而独立地引起下游核因子κB(NF-κB)激活和SHP-1活化导致DR[22]。
激肽释放酶-激肽系统(KKS)缓激肽及其受体发挥了促血管生成和促炎作用。已经证明增殖性DR患者的玻璃体中存在KKS,可导致视网膜血管通透性增加。在DN中,抑制KKS通路可减轻肾小球和肾小管的损伤[24],但同时也有报道会减轻蛋白尿和肾小球系膜硬化[25],因此还需要更多的证据来解释KKS通路的不同作用机制。
内质网应激内质网应激的失衡会导致自噬介导的细胞凋亡,与糖尿病及糖尿病微血管并发症的启动及进展有关。高糖及活性氧会引起炎症、内质网应激,继而引起肾脏及视网膜的损伤[26]。
维生素D缺乏Maddaloni等[27]研究表明维生素D可能存在抗炎和抗血管生成的特性。维生素D还可通过介导β细胞钙依赖的内肽酶的激活来发挥作用,这种内肽酶可将胰岛素原转化为活性胰岛素。维生素D抑制肾素形成和胰腺局部RAAS。在小鼠实验及几项人群试验中,在ACEI/ARB的治疗中增加维生素D,可减少蛋白尿。有研究显示DR的严重程度与维生素D的水平成反比[28]。
加速动脉粥样硬化CKD通过多种可能的机制加速动脉粥样硬化,包括高血清同型半胱氨酸、脂蛋白的增多、TGF-β水平的降低和氧化应激的增加[29]。
红细胞生成素(EPO)EPO是一种具有抗凋亡、抗炎和神经保护作用的内源性细胞因子。CKD 患者的EPO产生减少,缺乏这种神经保护机制[30]。
胱抑素C 胱抑素C是CKD的敏感生物标志物,是CST3基因编码的半胱氨酸蛋白酶抑制剂,存在于几乎所有的人体组织和体液中。最近的一项研究表明胱抑素C是DR和视力受损的独立危险因素[31]。
共同的遗传基础
所有糖尿病并发症都存在家族聚集和遗传性,但是背后的基因背景和分子机制却罕为人知。眼和肾脏的器官发生共有一些基因,包括:Pax2、BMP7和WT-1,这些基因的改变可导致多种同时累及眼和肾脏的疾病[32]。近年来,随着全基因组关联研究(GWAS)的发展,已经获知一些影响糖尿病微血管并发症的位点。
在GWAS出现之前,人们通过候选基因研究来识别疾病风险相关变异。根据DN发病机制中相关已知或可疑基因产物来推算候选基因。对候选基因的筛选往往样本量比较少,不同研究之间的标准不尽相同,统计意义不够有说服力,并且存在出版偏差。DN的候选基因中,最具可信度的是编码血管紧张素转化酶(ACE)基因的插入/删除变异,此变异会引起ACE活性增加2倍。目前针对DR的候选基因研究得到的结果说服力不强,其中两个研究相对完善的候选基因是编码VEGF的VEGFA和编码醛糖还原酶的AKR1B1。
GWAS的出现使得致病基因的筛选结果更加可靠且增加了可重复性。Porta等[33]对3 546例1型糖尿病患者进行了GWAS研究。根据已知硫胺素调节细胞内葡萄糖代谢并纠正高糖的多重损伤效应,作者推测特定硫胺素转运体的变异与严重视网膜病变和/或严重肾病的风险有关,因为它们改变了个人获得足够高细胞内硫胺水平的能力。因此作者提取了两个硫胺转运蛋白(SLC19A2/3)及其转录因子(SP1/2)的134个SNPs数据,探究它们与严重视网膜病变或肾病的关系。在SLC19A3位点上发现了两个SNPs在强连锁不平衡状态下,严重视网膜病变的发生率降低,严重视网膜病变和终末期肾病的联合表型降低。这就提示SLC19A3基因变异在严重DR和DN的发病机制中起着重要作用。基因研究可一定程度解释DN和DR在人群中的发病差异,但该作者也表示SLC19A3基因变异的保护作用是有限的,因为在糖尿病病程达到20年以上时,患者仍然没有出现DN或DR十分罕见。GWAS研究的不足之处在于受到样本量的限制,很难在不同研究群体得到相同结论。并且,即便筛选得到具有统计学差异的基因改变,大多数情况下在进行功能研究前也无法解释其影响基因的机制。因此,需要在更多的队列研究中进行验证以提高说服力,同时进一步了解相关SNPs的功能。
小结:DN和DR的发生与进展存在相关性,目前的研究从这两种微血管并发症的发病机制和基因背景进行探究,部分解释了它们之间存在关联的原因。仍然需要寻找DN和DR可靠的预测因子和治疗方案。
