补骨脂酚通过抑制SIRT3信号抵抗口腔鳞状细胞癌的机制研究
2019-02-11王路明姜庆生左艳萍唐成芳
王路明,姜庆生,左艳萍,唐成芳
(1西安医学院第二附属医院口腔科,西安 710038;2西安交通大学口腔医院口腔修复科;3西安医学院口腔医学院口腔修复学教研室;*通讯作者,E-mail:wlmxayxy@126.com)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是头颈癌中的常见病理类型之一[1]。在过去的几十年中,尽管手术、化疗和放疗等治疗措施不断进展,但OSCC患者的5年生存率依旧较低,约为50%-60%[2]。临床和基础研究表明,OSCC细胞已经对临床常规化疗药物产生了耐药[3]。因此,亟需寻找新的有效药物用于预防或延缓OSCC的发展。
补骨脂酚(bakuchiol,BAK)是一种从补骨脂种子中分离出的异戊烯化酚类单萜,是常用于治疗哮喘、腹泻和骨质疏松症等疾病的传统中药[4-6]。补骨脂酚可通过JNK激活Caspase-3,促进Bax易位到线粒体,诱发大鼠肝脏肌成纤维细胞发生凋亡[7]。补骨脂酚可通过诱导肺癌细胞S期阻滞、Caspase-3/9活化、p53和Bax上调以及Bcl-2下调发挥抗肿瘤作用[6]。我们课题组前期研究首次证实,补骨脂酚能够有效抑制OSCC的增殖和转移,但其具体下游分子机制仍需进一步阐明[8]。SIRT3是线粒体内最主要的去乙酰化酶,可通过去乙酰化修饰线粒体内多种蛋白(如超氧化物歧化酶2,SOD2),参与调节线粒体三羧酸循环、能量转化和氧化应激等病理生理过程[9]。近年来研究发现,补骨脂酚多种药理作用的发挥与线粒体功能密切相关[10,11],据此我们推测补骨脂酚可能是通过调节SIRT3/SOD2信号通路发挥抗OSCC作用。因此,本研究旨在观察补骨脂酚对OSCC细胞增殖、凋亡、氧化应激及迁移的影响,并探究SIRT3/SOD2信号通路是否介导补骨脂酚的作用。
1 材料和方法
1.1 主要试剂
补骨脂酚(货号:68612)、细胞核染料DAPI(货号:D9542)和二甲基亚砜(DMSO,货号:D2650)购自Sigma-Aldrich公司;抗Bax(货号:2772,20 kD)、Bcl-2(货号:3498,26 kD)和cleaved Caspase-3(货号:9661,17 kD)抗体购自Cell Signaling Technology公司;抗Ac-SOD2(货号:ab137037,24 kD)、SOD2(货号:ab13533,25 kD)和SIRT3(货号:ab118334,29 kD)抗体购自Abcam公司;抗β-actin(货号:4E8H3,43 kD)抗体购自Santa Cruz公司;原位末断转移酶标记(TUNEL)试剂盒购自Roche公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)试剂盒购自碧云天生物技术研究所;SIRT3过表达腺病毒和空载体腺病毒购自汉恒生物科技(上海)有限公司。
1.2 细胞培养及实验分组
OSCC细胞系购自美国模式培养物集存库(ATCC)。将OSCC细胞分为4组:①正常OSCC细胞(control)组:将OSCC细胞转染空载体腺病毒24 h,然后再用无血清DMEM培养24 h;②补骨脂酚(BAK)组:将OSCC细胞转染空载体腺病毒24 h,然后用补骨脂酚处理24 h;③腺病毒过表达SIRT3+补骨脂酚(SIRT3-AV+BAK)组:将OSCC细胞转染SIRT3过表达腺病毒24 h,继而补骨脂酚处理24 h;④腺病毒过表达SIRT3(SIRT3-AV)组:将OSCC细胞转染SIRT3过表达腺病毒24 h,然后再用无血清DMEM培养24 h。补骨脂酚的给药剂量为5 μmol/L,该剂量的选择参考本课题组以往发表的相关文献[8]。本研究中使用的腺病毒滴度为1×1010PFU/ml。
1.3 细胞活力测定
将OSCC细胞以每孔104个细胞的浓度接种在96孔培养板中;各组细胞药物处理结束后,每孔加入20 μl的MTT溶液(5 mg/ml),将细胞在37 ℃下进一步孵育4 h;除去培养基,每孔加入150 μl的DMSO并充分震荡5 min;用ELISA酶标仪在490 nm波长处检测各组细胞吸光度。细胞活力的检测结果表示为相对于control组吸光度值的百分比。
1.4 细胞凋亡率检测
采用TUNEL染色检测各组OSCC细胞凋亡率。凋亡率=TUNEL阳性细胞数/总细胞数×100%。具体操作参考以往文献[8]。
1.5 细胞迁移能力检测
将各组OSCC细胞以每孔2×105个细胞的浓度接种在六孔板中;当细胞基本汇合后,吸出细胞培养基;用同一移液枪头(10 μl)进行划痕;用PBS洗涤细胞3次;用无血清DMEM处理细胞24 h;用倒置显微镜(Olympus公司)自带相机对各组细胞划痕进行拍照并计算划痕两侧细胞间距。各组OSCC细胞的细胞间距以control组的相对值来表示。
1.6 活性氧产量检测
细胞内活性氧的检测方法参考以往文献[12]。简言之,将OSCC细胞(1×104)接种于96孔板,然后进行腺病毒转染和BAK等处理;BAK处理24 h后,将细胞与10 μmol/L 2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)在37 ℃的细胞培养箱中进一步共处理20 min;用DMEM洗涤细胞3次后向每孔加入100 μl无血清DMEM;用SpectraMax M5(Molecular Devices公司)分光光度仪测量各组细胞的荧光强度,激发波长为488 nm,发射波长为525 nm。
1.7 蛋白表达检测
用CelLyticTMM细胞裂解液(Sigma-Aldrich公司)裂解细胞,提取细胞总蛋白质;通过Bradford方法定量蛋白质浓度;通过10%SDS-PAGE分离蛋白质并电转到PVDF膜上;将PVDF膜在5%脱脂牛奶中室温孵育1.5 h;将抗SIRT3、Ac-SOD2、SOD2、Bax、Bcl-2、cleaved Caspase-3和β-actin抗体以1 ∶1 000稀释,在4 ℃下与PVDF膜孵育过夜;TBST洗膜3次,每次10 min;将辣根过氧化物酶HPR-标记的二抗(1 ∶5 000)与PVDF膜孵育1 h;TBST洗膜3次,每次10 min;使用Fusion SL成像系统(Viber Lourmat公司)检测和分析蛋白表达情况。β-actin作为内参。
1.8 统计学分析

2 结果
2.1 BAK和SIRT3-AV对OSCC细胞SIRT3信号通路的影响
与control组相比,BAK组细胞中SIRT3的表达下降,而SOD2的乙酰化水平提高(P<0.05)。与control组相比,SIRT3-AV组SIRT3的表达量明显上升,而SOD2的乙酰化水平明显下降(P<0.05)。此外,与BAK组相比,SIRT3-AV+BAK组OSCC细胞内SIRT3的表达量也明显上升,而SOD2的乙酰化水平明显下降(P<0.05,见图1)。

与control组相比,#P<0.05;与BAK组相比,*P<0.05图1 Western blot检测补骨脂酚对OSCC细胞SIRT3信号通路的影响 (n=4)Figure 1 The effect of bakuchiol on the SIRT3 signaling pathway in OSCC cells by Western blot (n=4)
2.2 补骨脂酚和SIRT3-AV对OSCC细胞增殖和氧化应激水平的影响
与control组相比,BAK组OSCC细胞的细胞活力明显降低(P<0.05)。与BAK组相比,SIRT3-AV+BAK组OSCC细胞的细胞活力明显提高(P<0.05)。SIRT3-AV组OSCC细胞的细胞活力与control组细胞相比差异无统计学意义(P>0.05)。与control组细胞相比,BAK组OSCC细胞的ROS产量明显增高(P<0.05)。与BAK组相比,SIRT3-AV+BAK组OSCC细胞的ROS产量明显降低(P<0.05)。SIRT3-AV组OSCC细胞的ROS产量与control组细胞相比差异无统计学意义(P>0.05,见图2)。

与control组相比,#P<0.05;与BAK组相比,*P<0.05图2 补骨脂酚和SIRT3-AV对OSCC细胞活力和活性氧产量的影响 (n=4)Figure 2 The effects of bakuchiol and SIRT3-AV on the cell viability and ROS production of OSCC cells (n=4)
2.3 补骨脂酚和SIRT3-AV对OSCC细胞凋亡的影响
与control组相比,BAK组OSCC细胞的凋亡率(TUNEL染色阳性率)明显增高(P<0.05)。与BAK组相比,SIRT3-AV+BAK组OSCC细胞的凋亡率明显降低(P<0.05)。SIRT3-AV组OSCC细胞的凋亡率与control组细胞相比差异无统计学意义(P>0.05,见图3)。此外,我们检测了促凋亡蛋白Bax和抗凋亡蛋白Bcl-2的表达以及Caspase-3的活化情况。与control组相比,BAK组OSCC细胞Bax和cleaved Caspase-3的表达量明显增加,而Bcl-2的表达量明显降低(P<0.05)。与BAK组相比,SIRT3-AV+BAK组OSCC细胞Bax和cleaved Caspase-3的表达量明显降低,而Bcl-2的表达量明显增高(P<0.05)。与control组相比,单纯上调SIRT3表达对于OSCC细胞Bax、Bcl-2和cleaved Caspase-3的表达无明显影响(P>0.05,见图4)。

图3 补骨脂酚和SIRT3-AV对OSCC细胞凋亡率的影响 (n=4)Figure 3 The effects of bakuchiol and SIRT3-AV on apoptotic ratio in OSCC cells (n=4)

1.control组;2.BAK组;3.SIRT3-AV+BAK组;4.SIRT3-AV组;与control组相比,#P<0.05;与BAK组相比,*P<0.05图4 Western blot检测补骨脂酚和SIRT3-AV对OSCC细胞凋亡相关蛋白表达的影响 (n=4)Figure 4 The effects of bakuchiol and SIRT3-AV on the expression of apoptosis-related proteins in OSCC cells by Western blot (n=4)
2.4 补骨脂酚和SIRT3-AV对OSCC细胞迁移的影响
与control组相比,BAK组细胞间距明显增加(P<0.05)。与BAK组相比,SIRT3-AV+BAK组细胞间距明显降低(P<0.05)。与control组相比,SIRT3-AV组OSCC的细胞间距差异无统计学意义(P>0.05,见图5)。
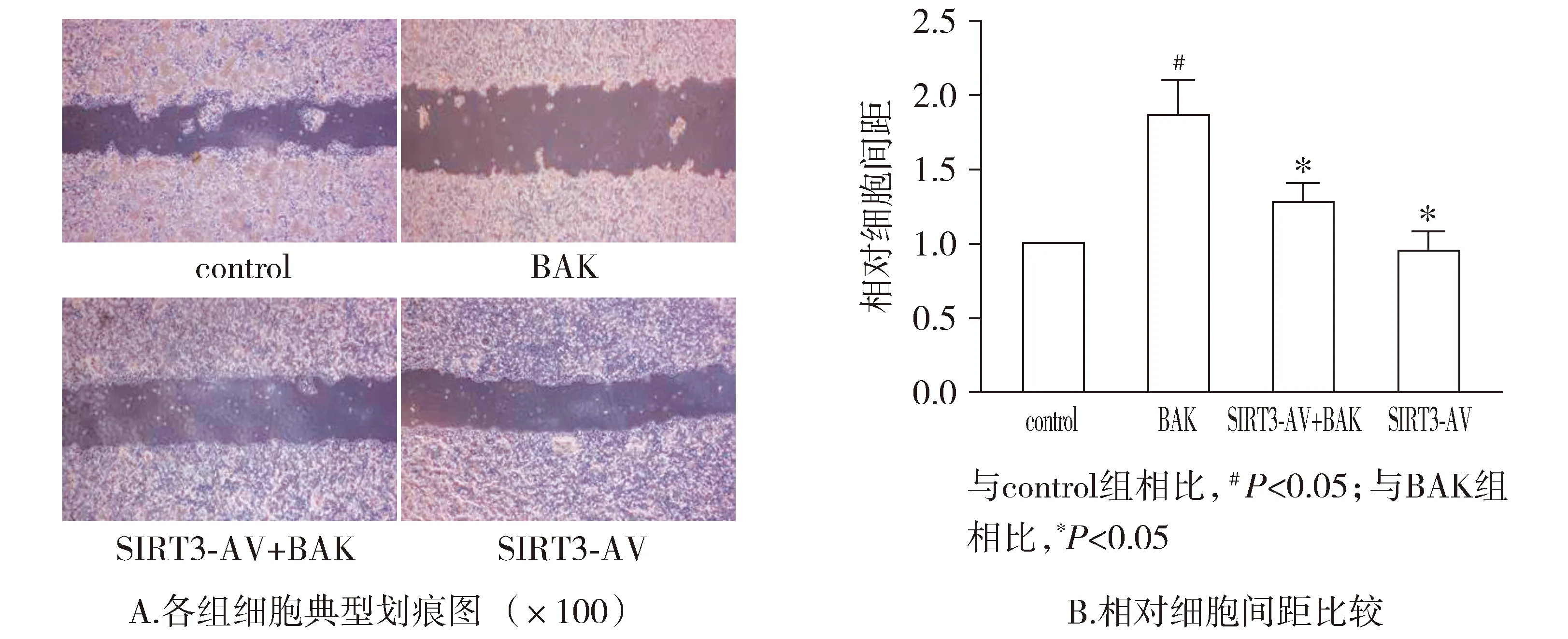
图5 补骨脂酚和SIRT3-AV对OSCC细胞迁移能力的影响 (n=4)Figure 5 The effects of bakuchiol and SIRT3-AV on the migration of OSCC cells (n=4)
3 讨论
由于口腔鳞状细胞癌患者5年生存率仍然很低,因此需要研发新的有效治疗方法用于干预口腔鳞状细胞癌的发生发展[2]。补骨脂酚是一种从补骨脂种子中分离出的异戊烯化酚类单萜。补骨脂酚是白藜芦醇的类似物之一,而白藜芦醇是潜在的强效抗癌药物之一[13]。据报道,白藜芦醇能够诱导多种癌细胞发生凋亡,包括SW480、MCF7、HCE7、Seg-1、HL60和U251胶质瘤细胞等[14,15]。与白藜芦醇相似的是,最新研究发现,补骨脂酚也可用于治疗多种类型的肿瘤。Park等[16]证实,补骨脂酚通过激活ROS/JNK途径信号上调DR4和DR5受体表达促进TRAIL诱导的结肠癌细胞凋亡。Kim等[17]证实,补骨脂酚可靶向结合并调节Hck、Blk和p38 MAPK,抑制皮肤癌细胞增殖。本课题组前期研究证实,补骨脂酚能有效抵抗OSCC细胞的增殖并促进其凋亡,但具体机制仍需进一步探究[8]。本研究的结果表明,补骨脂酚可通过抑制SIRT3的表达,降低OSCC细胞的细胞活力,促进细胞发生凋亡,诱导过量ROS的产生,降低OSCC细胞的迁移能力,从而发挥抗OSCC发生发展的作用。
SIRT3是线粒体内最主要的去乙酰化酶,参与调节线粒体能量代谢、氧化应激等病理生理过程[18]。大量研究证实SIRT3与多种肿瘤的发生和进展息息相关,但其具体作用因肿瘤类型的不同而不同。一些研究人员认为,SIRT3可通过调节线粒体抗氧化应激系统中的关键蛋白,抑制肿瘤细胞线粒体内过量ROS的产生,抑制细胞凋亡并促进细胞增殖,从而促进某些类型癌症的发生发展。例如在乳腺癌中,降低SIRT3的表达可以通过诱导过量ROS的产生,增加乳腺癌细胞对于化疗的敏感性[19]。在膀胱癌细胞中,p53可以导致癌细胞生长抑制和凋亡,而SIRT3可以与p53结合并使其去乙酰化,导致p53活性降低[20]。在胃癌细胞中,过表达SIRT3促进细胞增殖,增加细胞内ATP产量,促进葡萄糖摄取和糖原形成,提示SIRT3可能在胃癌发生发展中发挥重要作用[21]。此外,在黑色素瘤细胞中,抑制SIRT3表达可抑制黑色素瘤细胞增殖、集落形成和迁移,诱导细胞衰老,引起G1期停滞;而过表达SIRT3能明显促进黑色素瘤细胞的增殖[22]。与之相反的是,一些研究表明SIRT3具有抑制肿瘤发生发展的作用。SIRT3通过去乙酰化修饰HIF-1α、Bcl-2和p53等蛋白,诱导细胞周期停滞和细胞凋亡[23,24]。在宫颈癌细胞中,Vosaroxin可通过激活AMPK/SIRT3信号通路,降低HeLa细胞的细胞活力,增加乳酸脱氢酶的释放,增加线粒体内ROS的产量,促进脂质过氧化产物的生成,降低细胞内ATP的合成[25]。过表达SIRT3可以抑制乳腺癌细胞中的糖酵解和增殖,从而抑制肿瘤细胞能量代谢[23]。在裸鼠异种移植模型中,SIRT3基因敲除的肿瘤细胞比对照组肿瘤细胞生长更快并且体积更大[26]。在肝细胞癌中,SIRT3可抑制HepG2细胞的生长和增殖,诱导HepG2细胞发生凋亡,其机制可能与SIRT3上调SOD和p53活性,进而上调Bax和Fas的表达有关[27]。在B细胞性恶性淋巴瘤中,上调SIRT3可以通过去乙酰化异柠檬酸脱氢酶2和SOD2抑制肿瘤细胞增殖[28]。特别值得注意的是,Alhazzazi等[29]证实,与正常口腔角质细胞相比,SIRT3在口腔鳞状细胞癌细胞中表达量明显增加。下调SIRT3表达可明显抑制OSCC细胞生长和增殖,并增加OSCC细胞对放射线治疗和顺铂治疗的敏感性。
在本研究中,为明确SIRT3是否介导BAK抗口腔鳞状细胞癌的作用,我们通过补骨脂酚(5 μmol/L)处理OSCC细胞,并检测了SIRT3/SOD2信号通路的表达情况。补骨脂酚给药剂量与本课题组先前研究[8]一致。我们发现,补骨脂酚明显降低OSCC细胞内SIRT3的表达量,继而增加SIRT3下游靶蛋白SOD2的乙酰化水平。以往研究表明,SIRT3可以与Ku70蛋白相互作用,对Ku70进行去乙酰化修饰,进而参与细胞DNA修复,抑制细胞凋亡[30]。此外,激活SIRT3还可以通过去乙酰化修饰SOD2,抑制ROS产生,抑制细胞凋亡[12]。与此相一致的是,补骨脂酚处理后OSCC细胞内SIRT3信号通路的抑制伴随ROS产量、促凋亡蛋白Bax和cleaved Caspase-3表达量以及细胞凋亡率明显增加,而抑制凋亡蛋白Bcl-2的表达量明显降低。此外,SIRT3信号通路的受损也伴随OSCC细胞迁移能力的明显降低。为了证明补骨脂酚是否通过抑制SIRT3信号通路发挥上述保护作用,我们通过腺病毒上调OSCC细胞内SIRT3的表达水平。与control组相比,单纯过表达SIRT3(SIRT3-AV组)对于OSCC细胞的细胞活力、Bax、Bcl-2和cleaved Caspase-3的表达、凋亡率以及迁移能力均无明显影响。但与BAK组相比,SIRT3-AV+BAK组OSCC细胞内Bax和cleaved Caspase 3的表达量、ROS产量、凋亡率明显降低,而细胞迁移能力和Bcl-2的表达量明显增加,即上调SIRT3表达可以明显抑制补骨脂酚的抗肿瘤作用。
综上所述,本研究证实补骨脂酚可通过抑制OSCC细胞增殖和迁移,诱导OSCC细胞发生氧化应激损伤和凋亡,从而发挥抗OSCC发生发展的作用,且其抗肿瘤作用的发挥主要由SIRT3信号通路介导。本研究为临床上应用补骨脂酚治疗OSCC提供了新的理论依据。
