大肠埃希氏菌O157∶H7/NM标准物质制备
2019-02-11戴晓丽黄嫦娇
柯 璐 戴晓丽 徐 珊 黄嫦娇 林 杰
(1.福建出入境检验检疫局技术中心 福建福州 350003;2.福建省检验检疫技术研究重点实验室)
1 前言
生物特性标准物质是标准物质中特殊的一类,在提高实验室的测试水平和科研能力上有重要作用,是检测技术高效、准确运行的重要前提和保障[1]。含基质的生物特性标准物质的研究已成为标准物质研制的重点,我国在含食品基质的食源性致病菌标准品领域仍处于起步阶段[2]。大肠埃希氏菌O157∶H7/NM(Escherichia Coli O157∶H7/NM)是肠出血性大肠埃希氏菌的主要病原血清型。鸡肉、牛肉、生奶及其制品,蔬菜、水果及其制品等均可能受其污染,受污染的食物在外观与气味上不明显,但是仍可使人患病,严重者甚至会引起死亡[3,4]。因此,研制添加基质的大肠埃希氏菌O157∶H7/NM定量标准物质有重要意义。本文以大肠埃希氏菌O157∶H7/NM为目标菌,添加鸡肉粉,配合保护剂通过冷冻干燥法制备含一定菌数的标准物质,并进行均匀性和稳定性验证,为今后开展含基质的微生物标准物质的研究提供一定参考作用。
2 材料与方法
2.1 材料与试剂
2.1.1 菌源
大肠埃希氏菌O157:H7/NM(E.coli O157:H7/NM,以下简称“O157”)(上海汉尼公司),ATCC 43895。
2.1.2 基质
鸡胸脯肉(市场)低温运输,-20℃储存备用。
2.1.3 试剂(表 1、表 2)

表1 保护剂
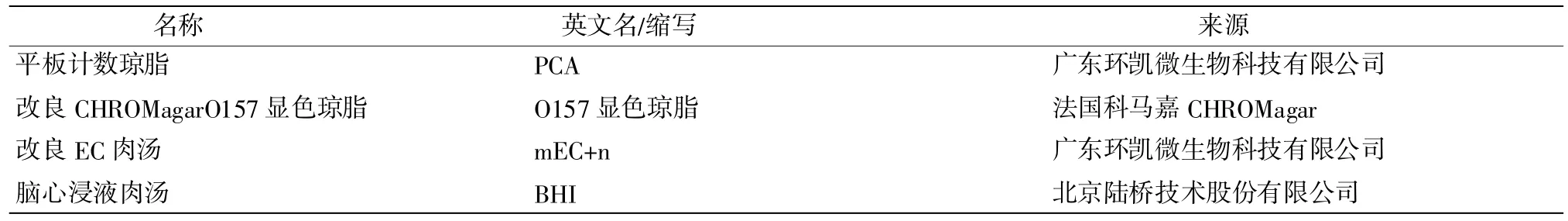
表2 培养基及其他试剂
2.1.4 其他
一次性针头过滤器(33 mm,0.22 μm)(广州赛国生物科技有限责任公司);一次性使用无菌注射器(江苏康友医用器械有限公司);5 mL西林瓶(配套丁基胶塞)(安徽华欣药用玻璃制品有限公司);筛网:50目标准筛。
2.2 仪器与设备
主要仪器与设备详见表3。

表3 主要仪器与设备
2.3 方法
2.3.1 基质前处理方法
鸡肉剔除脂肪及碎骨等非肉组织,切成小肉丁,铺开置于拖盘上,于-70℃预冻20 h后置于真空干燥机中,-40℃下冷冻干燥45 h,10℃下冷冻干燥8 h。用捣碎机粉碎,分批过50目筛,充分混匀鸡粉。按照GB 4789.2—2016《食品微生物学检验 菌落总数测定》[5]对其进行菌落计数,分装于无菌自封袋中,根据菌落计数结果选择60Co辐射剂量为6 kg,辐照后无菌,室温下保存干燥锅中,在每次使用前进行一次菌落计数,保证基质无污染。
2.3.2 菌种复活
冻干菌株恢复至室温,用脑心浸液(BHI)肉汤溶解,吸取适量接种于BHI肉汤,(36±1)℃培养 18~24 h。新鲜菌液按1∶1与50%的甘油混合后,分装于1.5 mL无菌离心管中,保存于-20℃,待用(甘油保存菌液含菌量107CFU/支)。
2.3.3 相关曲线方程
菌龄一般分为4个阶段:适应期、对数期、稳定期和衰亡期。稳定期时菌液营养物质刚好维持存活,处于稳定期的细胞或成熟的孢子对不良环境的抵抗力较强,因此,不产芽孢的细菌,应采用对数生长末期或稳定期初期的细胞作为冻干干燥的菌龄。
吸取甘油保存液1 mL于9 mL磷酸缓冲盐溶液(PBS)中,作10倍数稀释,直至10-5。吸取10-5稀释液0.1mL于50mL EC肉汤中(平行3瓶),振荡均匀后,于(36±1)℃静置培养。定时取出,同时进行菌落计数及吸光度(OD)值检测。绘制菌落对数值—OD值的关系曲线,菌落对数值—时间的关系曲线。
2.3.4 预冻及冷冻干燥参数设计
细菌对不同的降温速率有着不同的敏感程度,细菌细胞表面积/体积的数值大小决定了对水分的渗透率,而细胞对水分的渗透率受到冻结速度的影响[6]。当采用慢速冷冻时,由于细胞外溶液浓度低,结晶首先在细胞外发生,而此时细胞内水分还以液态存在,较大的冰晶易对细胞组织造成机械损伤,影响产品的品质。此外,冷冻浓缩效应使细胞质中盐浓度升高和pH变化,造成蛋白质变性,导致细胞失活。而当采用快速冷冻时,物料组织内冰层推进速度大于水移动的速度,冰晶分布接近食品中液态水的分布状态,且冰晶体积小,对产品的质量有利[7,8]。添加鸡肉基质的样品,浓稠度大,基质的蓄水型强,因此,干燥时需另调整温度和时间。-70℃预冻时间均为20 h。参数设计详见表4和表5。
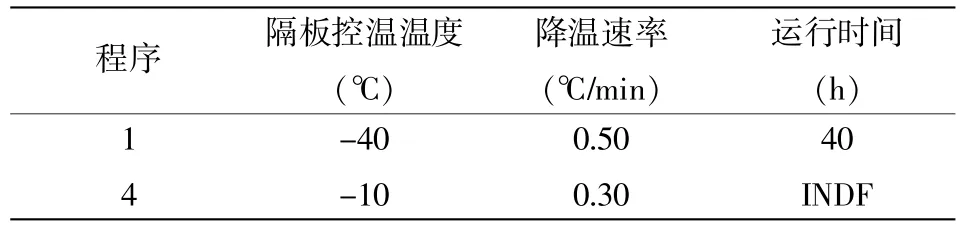
表4 无基质样品冷冻干燥参数设计
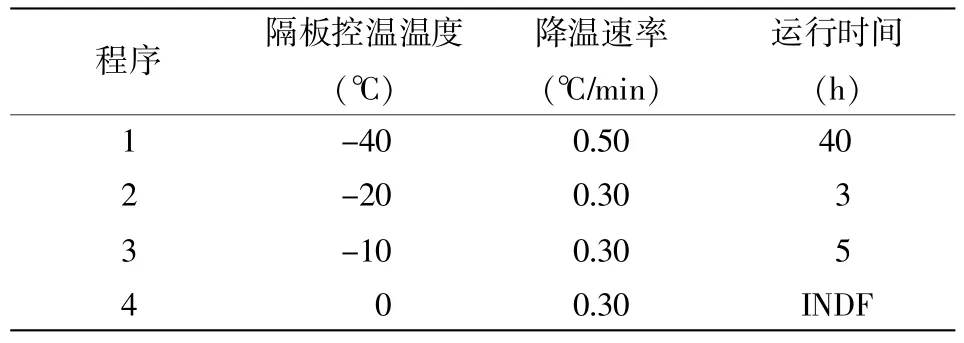
表5 含基质样品冷冻干燥参数设计
2.3.5 保护剂的选择
保护剂需要在冻干和保存的过程中发挥赋形剂和营养液的作用,营养液可修复受冻干影响而损伤的细胞;赋形剂主要起骨架作用,使冻干物形成多孔疏松的海绵状结构,从而增加溶解度。因此,在组合配方时就必须考虑到这两大作用[9]。本文选择脱脂牛奶、D-海藻糖、蔗糖作为基础配方,再辅以填充剂(PVP),pH稳定剂(甘氨酸)进行保护剂选择试验。
(1)添加菌液的制备。吸取甘油保存液1 mL于9 mL PBS中,作10倍数稀释至10-5。吸取10-5稀释液0.1 mL于50 mL EC肉汤中,根据2.3.3的曲线方程预估培养时间,检测菌液OD值,以此获得生长至稳定初期的菌液并估算其含菌数。预定冻干前样品含菌量为103CFU/mL,根据保护剂配制总体积为50mL及预估菌数推算新鲜培养菌液的稀释度。
(2)细菌存活率的计算。冻干前对样本进行菌落计数,结果记为M。从冰箱中取出冻干样本恢复至室温后,吸取2.5 mL BHI复水,用1 mL平头移液管吹吸均匀后分别吸取1 mL制备2片计数平皿,结果记为N。细菌存活率(即保护剂保护率)记为S。计算详见式(1)。
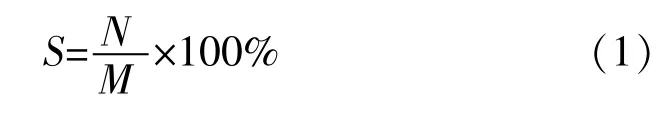
冷冻干燥后7 d内冻干样本菌浓度下降快(保存7 d后的菌落数记为P),因此选择保护剂时可以以冻干后7 d下降率作为参考条件。下降率记为C,计算详见式(2)。
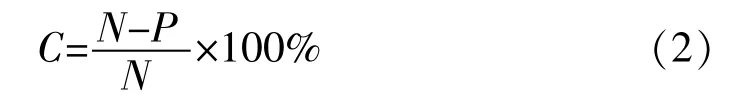
(3)保护剂添加水平及配方设计。对T,S和M先进行单因素添加水平的试验。添加水平详见表6,用无菌水配制T、S、M的单剂保护剂体积100 mL,115℃下高压灭菌30 min,冷却后分别添加细菌稀释液1 mL(统称混合液A),使混合液A的含菌数为103CFU/mL。置于摇床振荡器上匀速振摇10 min后,上下颠倒充分混合,吸取1 mL于无菌平皿进行菌落计数,作6个平行,每次吸取前需重新上下颠倒,取平均值作为混合液A的菌浓度。按3 mL分装于5 mL西林瓶中,-70℃下预冻20 h后冷冻干燥,按照2.3.4冷冻干燥参数表4进行冻干。于冻干后第0 d检测冻干样品的菌浓度,取12个平行样本,每个样本用3mL无菌BHI复水(室温下静置5min),吹吸混匀后立即检测,取1 mL于平皿,平行2个,另取1 mL于9 mL PBS中进行10倍数稀释,对每个稀释度进行平行2次计数取平均值。按照式(1)和式(2)计算3种单剂在冻干后的存活率(取平行6个的计数结果均值)。
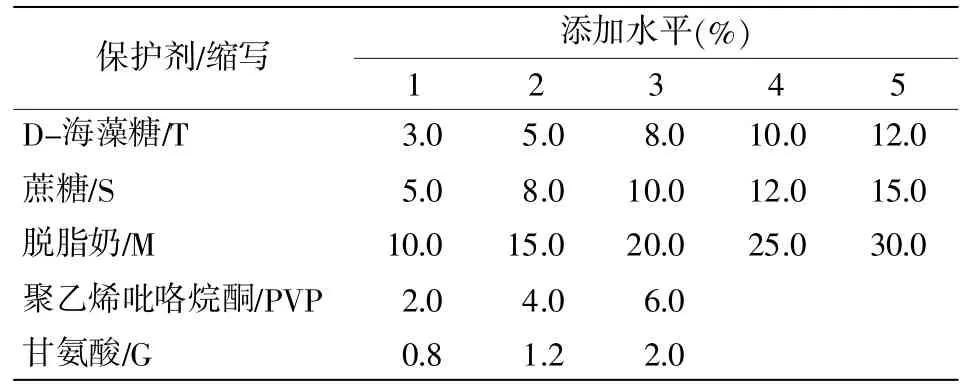
表6 单因素水平设计
在基础配方I中添加不同水平的填充剂PVP和pH稳定剂甘氨酸,详见表7。混合均匀后115℃高压灭菌30 min。冷却后添加细菌稀释液1 mL(记为混合液B),使混合液B的含菌数为103CFU/mL。冻干前计数后分装,按照单因素保护剂试验的流程进行,每组12个平行。
2.3.6 基质与基础配方II混合比例设计
基质的冻干脱水率约为75%,因此,1 g的基质需至少3 mL的水复溶,将基质与水的混合记为基质液,当按最低体积比配制时,基质液浓稠,难以均匀混合,需提高基质与水的体积比例至1∶5。基质液与基础配方II保护液混合后记为混合液C,添加新鲜菌液1 mL,使其含菌数为103CFU/mL。每组混合液吸取3 mL于西林瓶中,-70℃预冻20 h,按照表5参数进行冻干。混合比例详见表8。
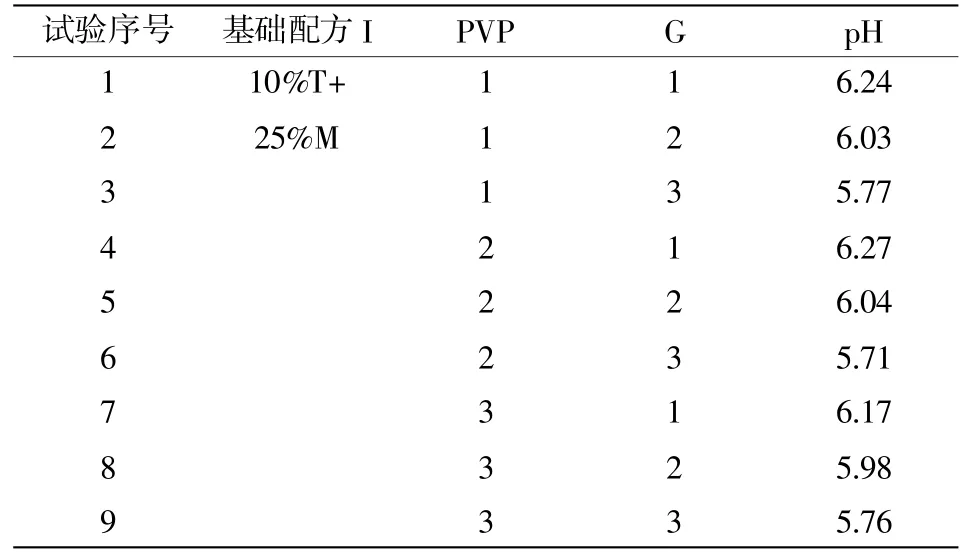
表7 PVP和甘氨酸添加水平设计

表8 基质与基础配方II混合比例设计
2.3.7 分批次制备冻干样品
按照最优的保护剂配方II:10%T+25%M+4%PVP+0.8%G,配制保护剂液。按照基质与水的混合比例为1∶7,基质液与保护剂液的混合比例为1∶3进行配制。培养新鲜菌液(菌浓度约为2.6×108CFU/mL),稀释后添加至混液C中,使得菌液浓度为2.6×103CFU/mL。按3 mL/瓶分装,盖以丁基胶塞,在-70℃下预冻,按照表5的冻干程序进行冻干。相同方式制备6个批次的样品。
2.3.8 均匀性验证
根据保护剂保护率约为40%,预估冻干后样品的含菌浓度为1.0×103CFU/mL,对冻干后样品进行合适的稀释计数。同一实验条件下进行检测,6个批次,每批次抽取10个样品。计算统计量F,根据自由度及给定的显著性水平 α=0.05,查得 Fα,当 F<Fα时,组内和组间无显著性差异,即样品均匀[10]。
2.3.9 标准物质定值的不确定度评估结果
取不同批次的冻干样品10份,每份样品平行测量2次。合并样本样品标准差SP计算详见式(3)。
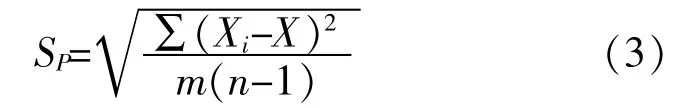
其中,m—检测的样本数(m=10);n—每个样品重复检测的次数(n=2)。
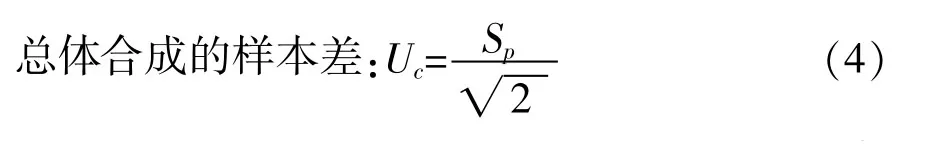
取置信水平95%,f(自由度)=10,经过查t分布表得:t0.05(10)=2.228,则扩展不确定度:
2.3.10 稳定性验证
(1)短期稳定性验证。设计存储温度为:-20℃、4℃、25℃,保存时间分别设计为 3 d、7 d、10 d、15 d、28 d,按设计的保存时间分别取3瓶冻干样品验证,取平均值作统计分析。
(2)长期稳定性验证。设计存储温度为:在短期稳定性试验中,弃去不稳定的保存温度,在其他温度下继续追踪长期稳定性。保存时间分别设计为1 min、3 min、6 min、12 min、18 min。 按设计的保存时间分别取3瓶冻干样品验证,取平均值做统计分析。
(3)计算公式及评价标准。以x代表时间,y代表冻干样品的菌浓度,拟合成一条直线,-20℃、4℃、25℃斜率分别记为 b1、b2、b3。
斜率计算:
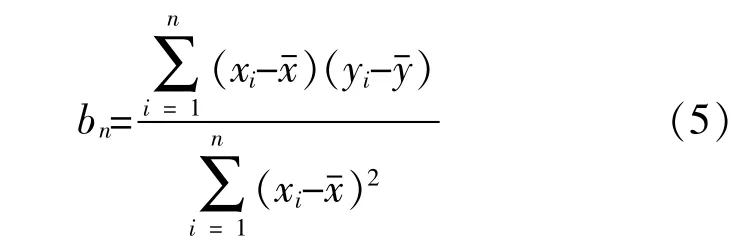
截距bn:

直线的标准偏差s2:
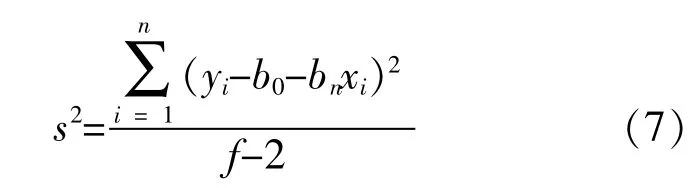
自由度:f-2=3
斜率的不确定度 s(bn),由式(8)计算:
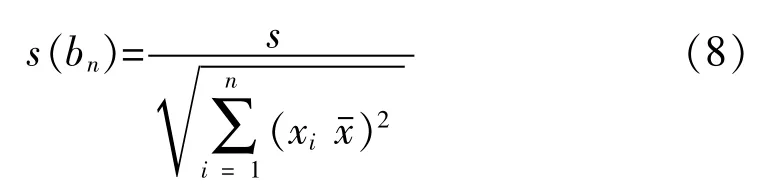
若满足|bn|<t0.95,f-2×s(bn),则斜率是不显著的,样品未观测到不稳定性[12]。
3 结果与分析
3.1 相关曲线方程
在培养不同的时间间隔取出进行菌落计数及OD600值检测。结果详见表9。
以OD600值为主纵坐标,以菌落计数值的对数值为次纵坐标,以培养时间为横坐标绘制OD600—菌落对数值相关曲线,即生长曲线。详见图1。
由表9和图1可知,当培养至7.5~16 h时,细菌的生长开始进入稳定期,对数值曲线趋平,但活菌数仍在增加,OD600值仍有上升趋势,16 h后固定体积增菌液中营养已基本消耗,增菌液的细菌浓度开始饱和,OD600值曲线趋平。选择作为试验用的菌液,应处于菌落对数值曲线进入平向的初期以及OD600值仍为上升趋势的阶段,即培养至7.5~16 h的菌液。为方便预估菌落数,在7.5~16 h阶段制作OD600菌落对数值相关曲线,详见图2,并生成方程:y=0.996 4x+8.157。
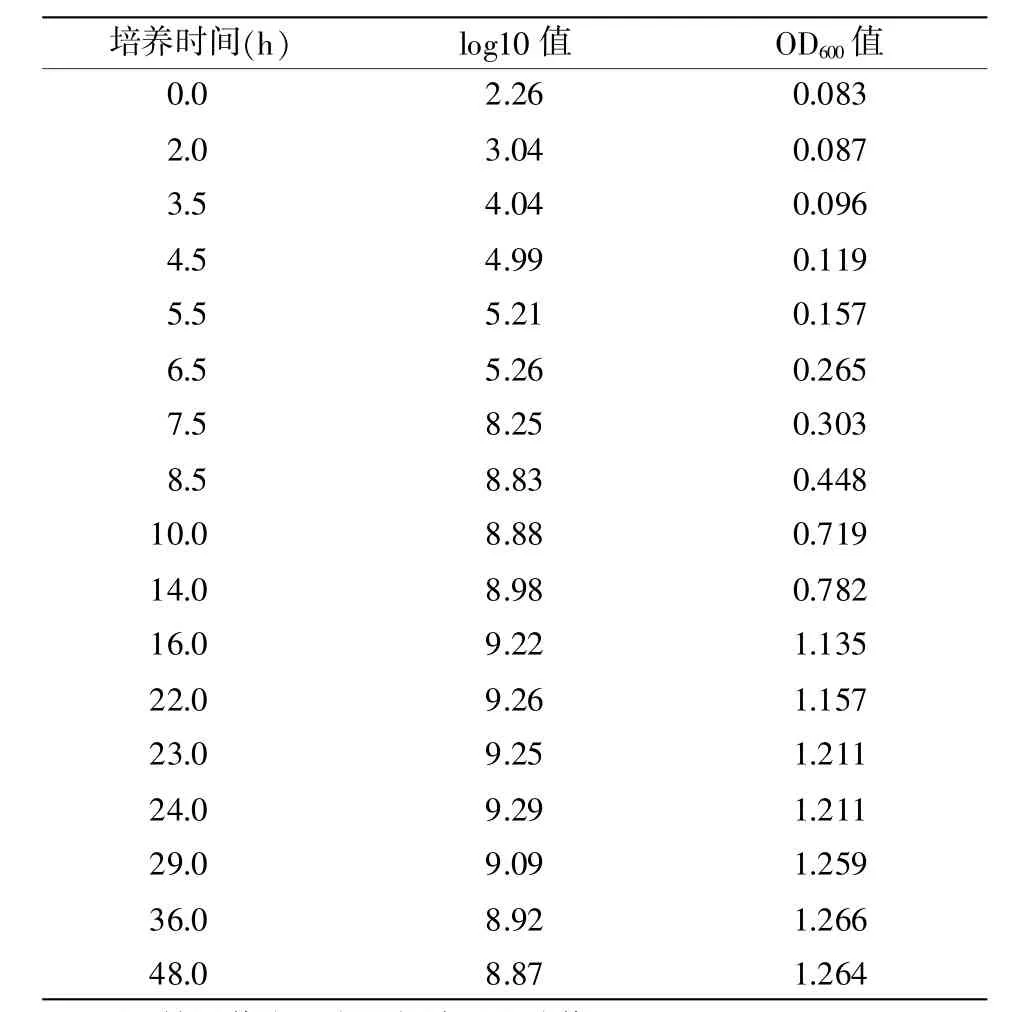
表9 不同培养时间培养基的菌落计数log10值及OD600值
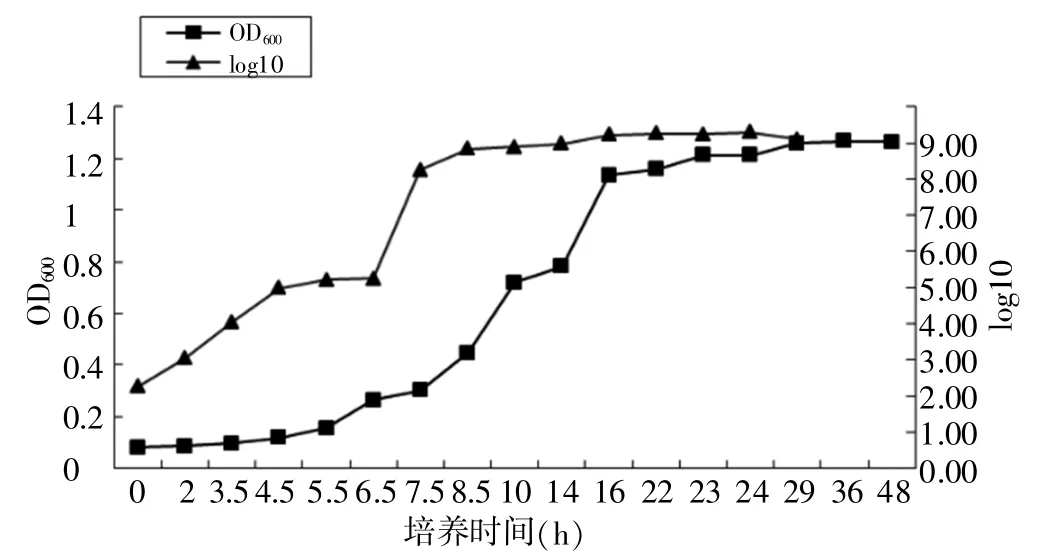
图1 生长曲线

图2 OD600菌落对数值相关曲线
3.2 保护剂的选择
(1)对混合液A进行菌落计数,取平行3次结果的均值为3.6×103CFU/mL,结果详见图3。
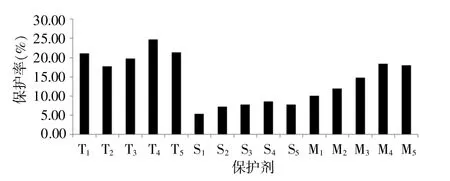
图3 3种保护剂不同添加水平的保护率
由图3可知,T4保护率最高:24.72%;S4保护率最高:8.61%;M4保护率最高:18.33%。但蔗糖5个添加水平的保护率均低于海藻糖和脱脂奶,不将蔗糖作为保护剂组成成分,因此,10%T+25%M的组合记为基础配方I。
(2)混合液B菌落计数取平行3次结果的均值为 1.5×103CFU/mL,结果详见图 4。

图4 PVP和甘氨酸不同添加水平保护率
由图4可知,试验序号4的保护率最高,为49.75%。甘氨酸的添加水平越大,保护剂pH越低,保护率越低,O157的最适pH范围为5.0~8.0,因此,越接近中性值环境(弱酸性),存活率越大。选择添加水平为0.8%;PVP添加4%时,保护率最高。即10%T+25%M+4%PVP+0.8%G为最优基础配方II。
3.3 基质与基础配方II混合比例
从冰箱中取出冻干样品后,恢复至室温,用3mL的PBS复水,静置5 min后计数。分别吸取1 mL于2片无菌平皿中,另取1 mL于9 mL PBS中制成10-1的菌悬液,以此类推,稀释至10-3。不同比例混合后的混合液C的保护率结果详见表10。
由表10结果可知,试验9的菌落计数的标准偏差为0.03,相较于其他组合都低,且保护率为41.49%,因此,配比方式选择试验9,即基质与水的混合比例为1∶7,基质液与保护剂液的混合比例为1∶3。
3.4 均匀性验证
同一实验条件下进行检测,6个批次记为:m1~m6,每批次抽取 10 个样品,记为:n1~n10,检测结果详见表11,分析统计结果详见表12。
由表12可知,
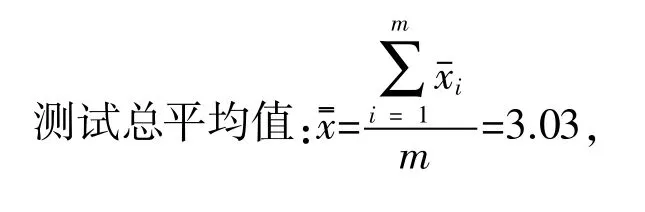


该统计量是自由度(v1,v2)的F分布变量。根据自由度及给定的显著性水平α=0.05,查得F=1.197<Fα=2.201,则组内和组间无显著性差异,即样品均匀。
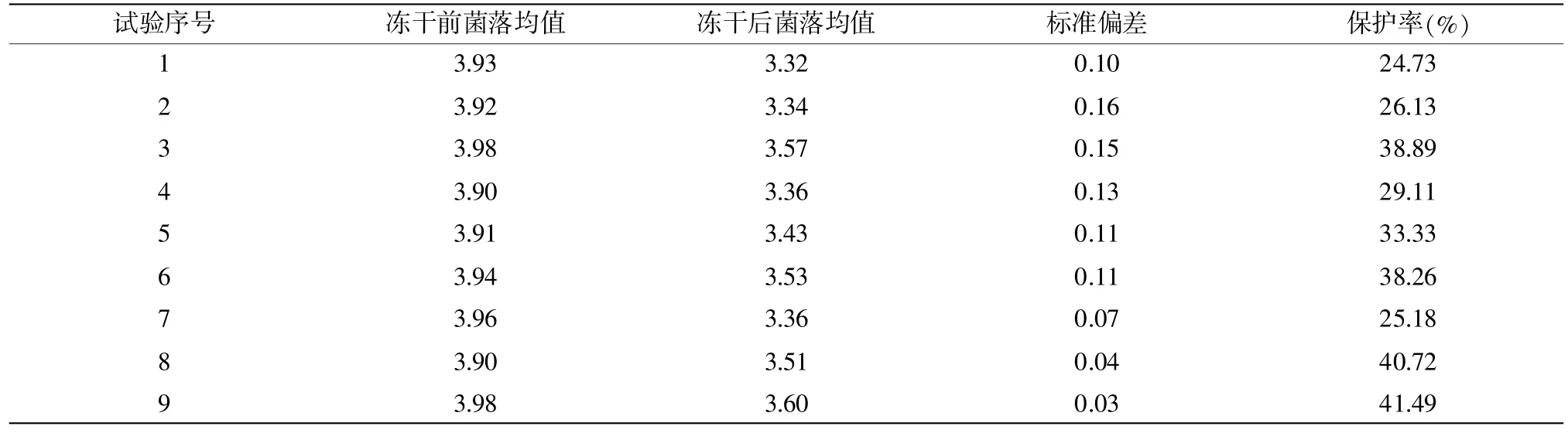
表10 不同比例混合后的混合液C的保护率结果

表11 6批次样品的菌落计数值
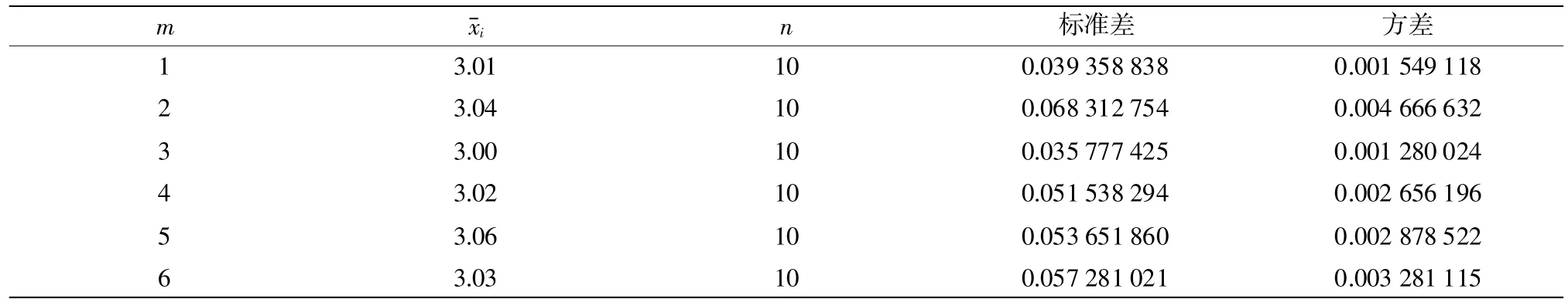
表12 分析统计结果
3.5 不确定度评估(表13)
由表13和式(3)计算合并样本样品标准差:Sp=51 CFU/mL。总体合成的样本差Uc=36 CFU/mL。取置信水平 95%,f(自由度)=10,查 t分布表得:t0.05(10)=2.228,扩展不确定度:U2=t×Uc=2.228×36=80.208 CFU/mL,取整数则U=80 CFU/mL。当测量检验结果用2次测量值平均值表示结果时,其值分布区间在±80CFU/mL之间。
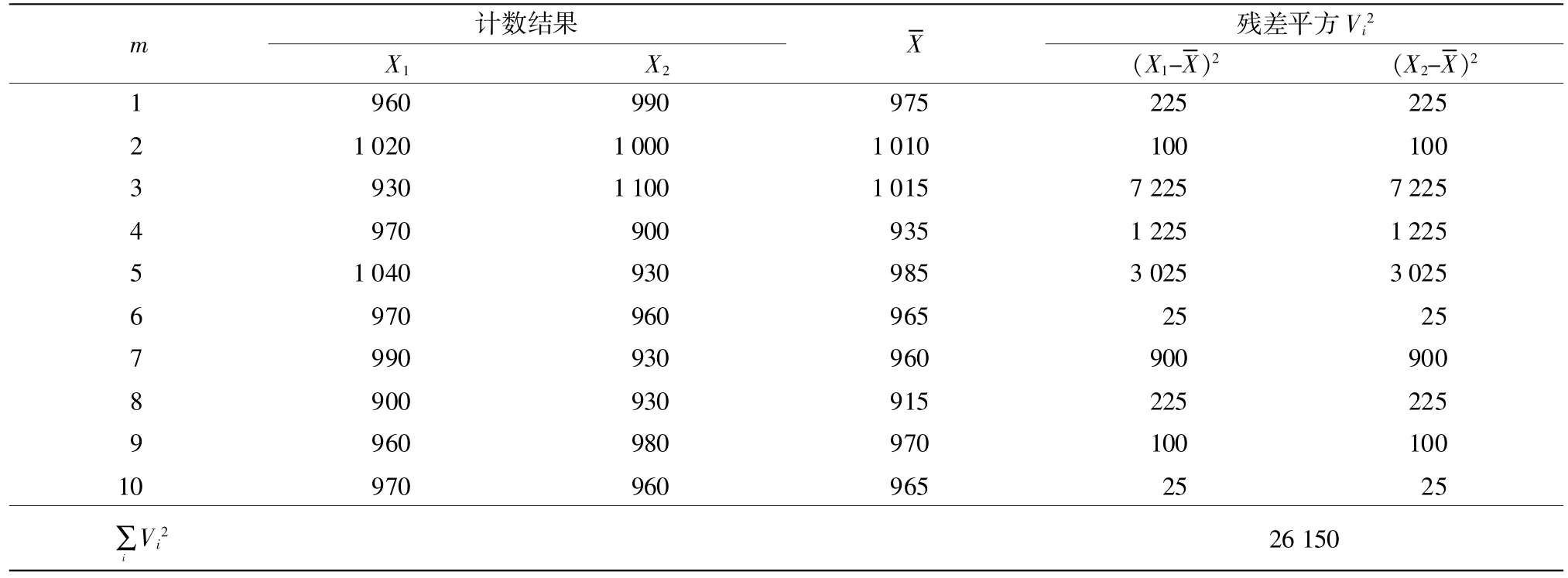
表13 定值方法不确定度的计数结果
3.6 样品的稳定性验证结果
3.6.1 短期稳定性检测(表14、表15)
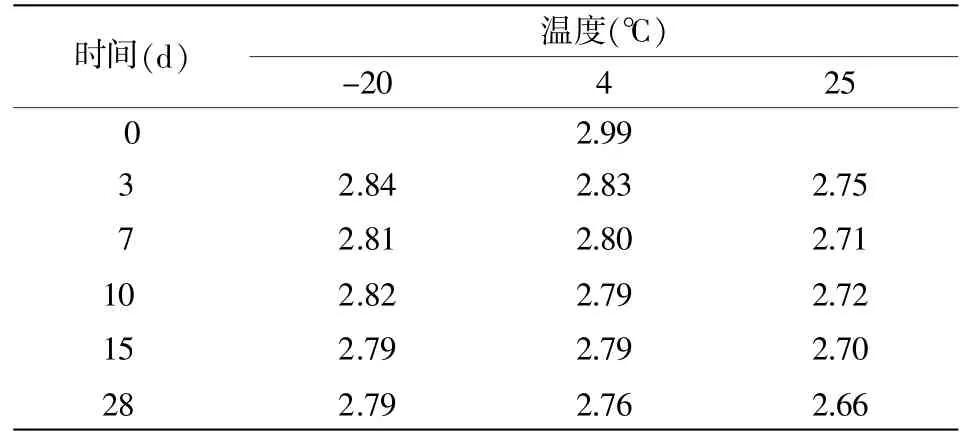
表14 短期稳定性测量数据
由表15可得,保存28 d时,-20℃的温度下|b1|<t0.95,f-2×s(b1),斜率是不显著的,样品未观测到不稳定性;而 4℃及 25℃时:|bn|>t0.95,f-2×s(bn),即样品不稳定。
3.6.2 长期稳定性检测
冷冻干燥后在4℃和25℃保存,样品特性值不稳定,因此,对-20℃进行长期稳定追踪,并以第1个月起的检测值作为统计分析数据,详见表16。
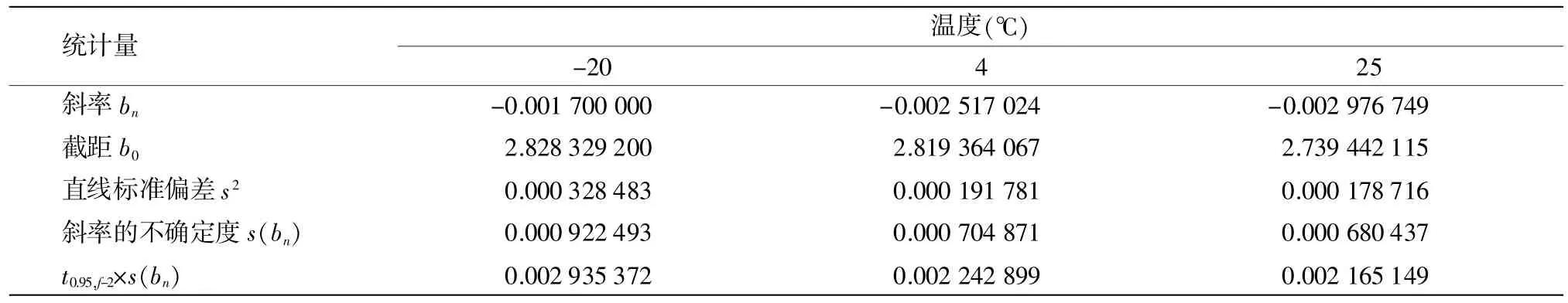
表15 保存28 d数据统计
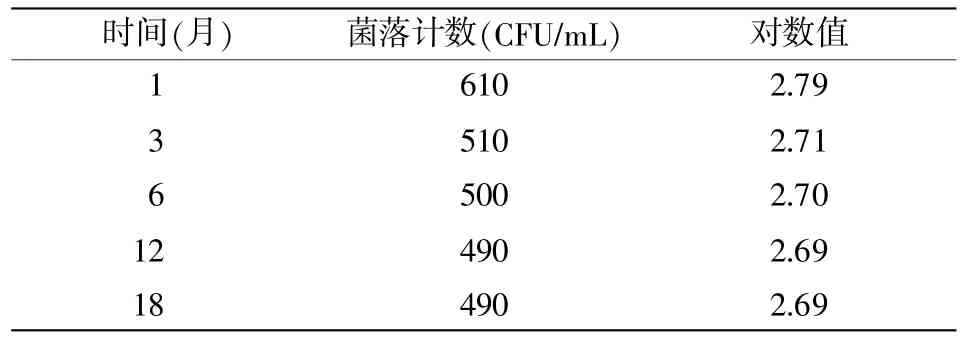
表16 -20℃下长期保持的稳定性测量数据
|b1|=0.000 349 599,s(b1)=0.000 502 220 6,t0.95,f-2=3.182,则 t0.95,f-2×s(b1)=0.001 592 08。 则在-20℃的温度下保存 18 个月时,|b1|<t0.95,f-2×s(b1),斜率是不显著的,即保存第1个月起至第18个月未观测到不稳定性。
4 讨论
4.1 保护剂的选择
单糖在冻结过程中只能提供非常微弱的稳定作用,使得蛋白质在脱水干燥前就发生不可逆变性。二糖既能在冻结过程中起到低温保护剂的功能,又能在干燥脱水过程中起到脱水保护剂的作用[13]。因此,常采用低聚糖,尤其是二糖作为保护剂。还原性二糖以及非还原性二糖在冷冻干燥过程中都具有很好的保护效果,但在贮藏过程中,由于还原性二糖的存在会使得冻干品发生美拉德反应,所以冷冻干燥配方中,蔗糖和海藻糖是最常用的2种保护剂。聚乙烯吡咯烷酮(PVP)起着低温保护剂和脱水保护剂的作用,又是很好的填充剂,还能抑制小分子赋形剂(如蔗糖)的结晶。冻结过程中,溶液的pH也会发生变化,因此,需要在冷冻干燥过程和贮藏过程中,添加能将pH调整到活性物质的最稳定区域的物质(即pH稳定剂),如甘氨酸。
4.2 不确定度评估
本次实验中使用的移液器的扩展不确定度:U=0.1%(k=2);电子天平扩展不确定度U=2.793 4mg。在定值中移液器和电子天平的不确定度可忽略不计。仅对定值方法进行不确定度评估。
4.3 不稳定性追踪
该标物的基质为肉类,且无经过特殊处理,鸡肉中含有一定的脂肪且具有肉类应有的生物特性,真空干燥后仍有一定量的水分,容易受温度的影响而变质,因此,在4℃以及25℃下保存,其特性值不稳定。
