垂枝红千层内生真菌的分离鉴定及其生物活性
2019-02-10李赛妮陈玉婵刘洪新朱牧孜章卫民
李赛妮 陈玉婵 刘洪新 朱牧孜 章卫民

【摘 要】 目的:研究垂枝紅千层内生真菌的分离鉴定及其生物活性,为进一步发掘活性代谢产物奠定基础。方法:通过组织分离法分离培养垂枝红千层内生真菌,通过ITS序列分析对分离的真菌进行鉴定,并采用滤纸片法和SRB法对内生真菌的发酵液提取物进行抗菌和细胞毒活性研究。结果:共分离得到29个菌株,鉴定为17属20种,其中以黑孢霉属(Nigrospora)、间座壳属(Diaporthe)和刺盘孢属(Colletotrichum)为优势类群;菌株A797、A798和A809的发酵提取物,对金色葡萄球菌和枯草芽孢杆菌均具有较好抑制活性(抑菌圈直径≥13 mm);当发酵液提取物的作用浓度为100 μg/mL时,菌株A781、A785和A805对4株受试肿瘤细胞均具有较明显的抑制作用(抑制率≥90%以上)。结论:垂枝红千层内生真菌多样性丰富,部分菌株具有较好的抗菌和细胞毒活性,值得进一步深入研究。
【关键词】 红千层;内生真菌;分离鉴定;抗菌活性;细胞毒活性
【中图分类号】R285.5 【文献标志码】 A【文章编号】1007-8517(2019)23-0016-06
Isolation, Identification andBiological Activities of Endophytic Fungi from Callistemon viminalis
LI Saini CHEN Yuchan LIU Hongxin ZHU Muzi ZHANG Weimin*
State Key Laboratory of Applied Microbiology Southern China/Guangdong Provincial Key Laboratory of Microbial Culture Collection and Application/ Guangdong Open Laboratory of Applied Microbiology/ Guangdong Institute of Microbiology,Guangzhou 510070, China
Abstract:Objective To isolate and identify endophytic fungi from Callistemon viminalis and investigate their biological activities, thus providing a theoretical basis for further searchfor biologically activemetabolites.Method Endophyticfungiwereisolated and purified from C. viminalis by tissue isolation method and identified by analysis of ITS sequences. Antibacterial and cytotoxic activities of fermentation broth extracts of these endophytic fungi were examined by the filter paper dispersion method andthe Sulforhodamine B(SRB), respectively. Results 29 strains were isolated and identified as 20 species in 17 genera, among which Nigrospora, Diaporthe and Colletotrichum were the dominant genera. The fermentation extracts of strains A797, A798 and A809 showed inhibitory activity against Staphylococcus aureusand Escherichia coliwithinhibitionzone diameters of over 13 mm. The strains A781, A785 and A805 exhibited cytotoxic activity against the tested tumor cell lines with inhibitory rates of over 90%when the concentration of their fermentation extracts was 100 μg/mL. Conclusion Endophytic fungi from C. viminalisare rich in diversity and several strains showed antibacterial and cytotoxic activities, which deserved further study.
Keywords:Callistemon viminalis; Endophytic fungi; Isolation and Identification; Antibacterial Activity; Cytotoxicity
植物内生真菌(Endophytic fungi)是一类重要的微生物资源,其生活在植物体内的特殊环境中,在演化过程中与宿主植物形成了互惠共生关系,能产生与宿主相同或相近的代谢产物,甚至能产生新型生物活性物质,在医药、农业以及病虫害的防治等领域具有重要的应用价值,已成为国内外研究的热点领域[1]。
垂枝红千层(Callistemon viminalis)为桃金娘科(Myrtaceae)红千层属(Callistemon)植物,原产于澳大利亚,国内多个地区都有栽种,广泛用于绿化、园艺观赏、入药和制取精油等[2]。红千层属植物的化学成分和生物活性研究表明,其枝叶含有间苯三酚类及黄酮类等化合物[3-5],具有抗菌、抗肿瘤、抗氧化、杀虫和免疫调节等多种生物活性[6-8]。迄今垂枝红千层内生真菌及其代谢产物研究未见报道。为了充分发掘该植物的内生真菌资源,本研究对采自华南植物园的垂枝红千层进行内生真菌的分离和鉴定,探讨垂枝红千层内生真菌的多样性,并对分离到的内生真菌的发酵粗提物进行抗菌和细胞毒活性研究,旨在筛选出具有生物活性的菌株,为进一步研究其活性代谢产物提供理论依据。
1 材料与仪器
1.1 材料
1.1.1 植物材料、供试菌株及细胞株 垂枝红千层健康植株于2016年01月采自广州华南植物园。
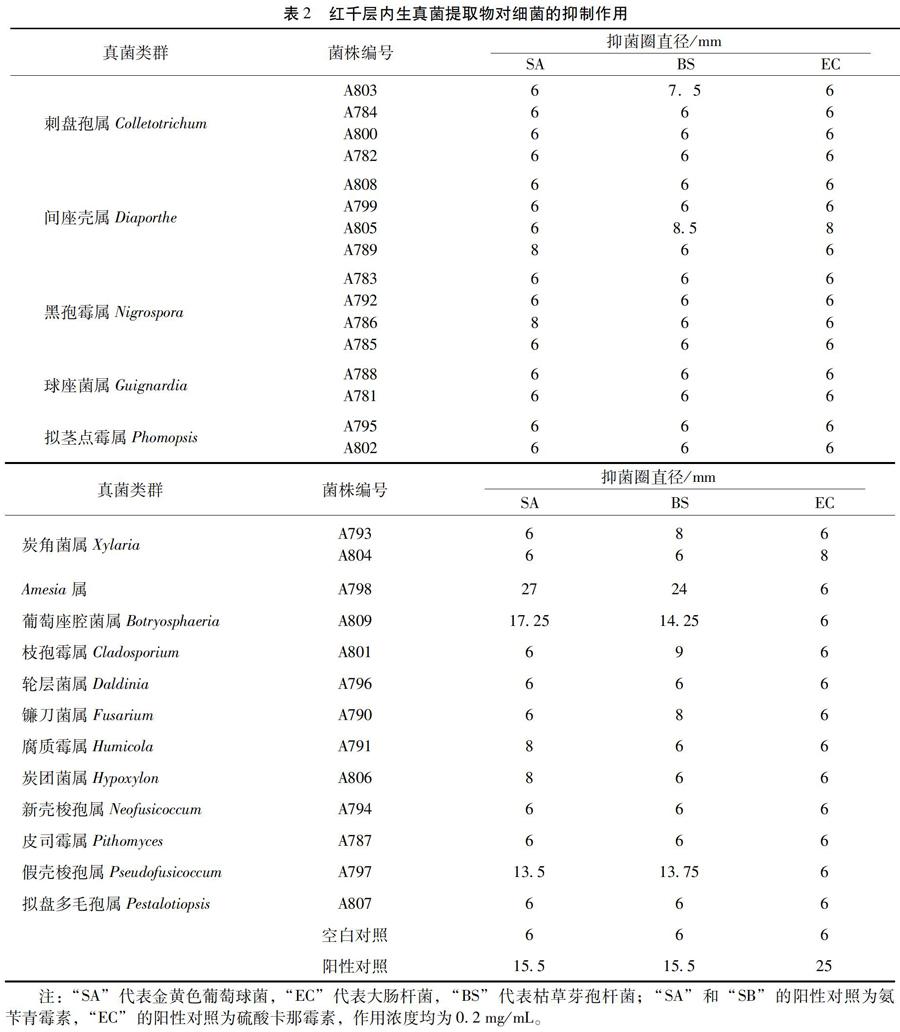
供试指示菌细菌为金黄色葡萄球菌(Staphylococcus aureus,SA) 、大肠杆菌(Escherichia coli,EC)、枯草芽孢杆菌(Bacillus subtilis,BS)。
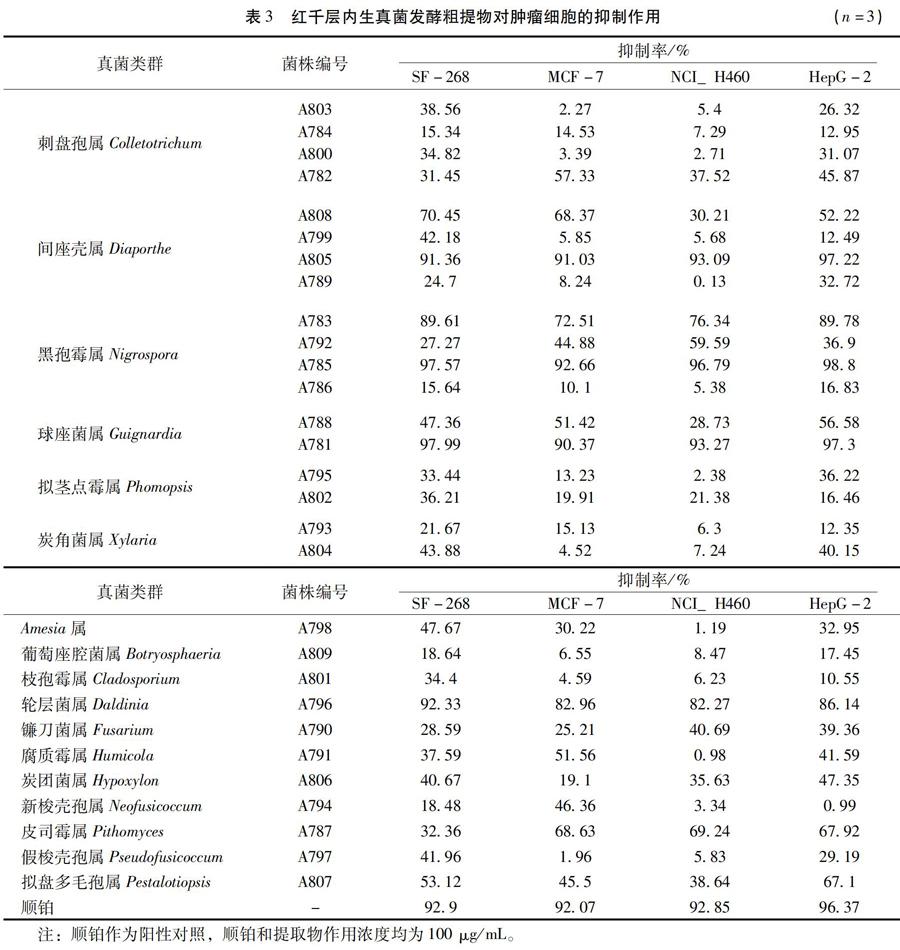
供试肿瘤细胞株为神经胶质瘤细胞(SF-268)、乳腺癌细胞(MCF-7)、大细胞肺癌细胞(NCI-H460)、肝癌细胞(HepG-2)。以上所有菌株和细胞株均保藏于广东省微生物研究所。
1.1.2 培养基分离 培养基为PDA双抗培养基:马铃薯 200g,葡萄糖 20g,KH2PO4 3g,KH2PO4 3g,MgSO4·7H2O 1.5 g,维生素B1 10 mg,琼脂18 g,蒸馏水1 L;灭菌后分别加入100 μg/mL硫酸卡那霉素和氨苄青霉素。
PD液体培养基:马铃薯200g,葡萄糖20g, KH2PO43g,MgSO4·7H2O 0.15g,维生素B110mg,蒸馏水1000mL,pH自然,121℃下灭菌30min。
肿瘤细胞培养基为含有10%胎牛血清和1%双抗(10000 U/mL青霉素和链霉素)的RPMI-1640基础培养基,混合均匀,4℃冰箱保存。
1.1.3 试剂RPMI-1640 培养基、胎牛血清、双抗(10000 U/mL青霉素+链霉素)均购自Gibco公司;磺酰罗丹明B(SRB)、二甲基亚砜(DMSO)、氨苄青霉素、硫酸卡那霉素、顺铂(cisplatin)均购自Sigma公司;乙醇、乙酸乙酯、甲醇等其他分析纯化学试剂购于广州化学试剂厂,用于基因扩增的Taq酶及其他的PCR相关试剂购于广州美基生物科技有限公司。
1.1.4 主要仪器YXQ-WY21-600 电热高压蒸汽灭菌锅,广州市华南医疗器械有限公司;Mastercycler gradient 5331 PCR仪,Eppendorf公司;MGC-250BP-2 培养箱,上海一恒科技有限公司;164-5050 Powerpac Basic Power Supply基础型电泳仪,Bio-Rad公司;DMI3000B倒置显微镜,Leica公司;S-3000N扫描电镜,日立公司;Multiskan酶标仪,Thermo公司;2123-2二氧化碳培养箱,Shellab公司;RE-2000 旋转蒸發仪,上海亚荣生化仪器厂;THZ-C-1摇床,广州市正一科技有限公司。
2 方法
2.1 内生真菌的分离纯化 将采集的新鲜样品用清水冲洗,然后用无菌水漂洗2次,放入75%的乙醇中浸泡1min,取出后用无菌水漂洗3次,再放入0.1%的升汞溶液中浸泡1min,取出后用无菌水漂洗3次,用无菌滤纸吸干水分。叶片用无菌剪刀剪去边缘后剪成约0.5cm × 0.5cm的方块;枝条用无菌手术剪去两端,取中间部位剪成1cm长的小段;用最后一次漂洗用的无菌水涂板作为阴性对照。处理好的样品放入事先准备好的PDA双抗平板培养基中,每个培养皿接种4块相同类型组织块,26℃恒温培养5~7d,待培养基上可观察到从组织块内部向周围长出菌丝时,挑取形态不同的菌落转移到新培养基上继续培养直至纯化后,将菌株转接到装有PDA培养基的斜面上,置于4oC冰箱保存,备用。
2.2 内生真菌的鉴定 采用真菌基因组DNA提取试剂盒(Magen)提取内生真菌的基因组DNA,作为PCR扩增的模板[9]。PCR扩增采用真菌rDNA内转录间隔区(rDNA ITS)通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′,正向)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′,反向)[10]扩增分离菌株的rDNA ITS区。PCR采用40 μL反应体系,通过Ex Taq(TaKaRa)进行,反应条件为94℃预变性5min;94℃变性45s,55℃复性30s,72℃延伸1min,共35个循环;最后72oC延伸5min。反应产物用1%琼脂糖凝胶跑胶验证,将有目的条带的反应产物送上海美吉生物医药科技有限公司测序。获得的序列通过BLAST程序在GenBank上进行相似性序列检索分析,对分离菌株进行鉴定。
2.3 菌株粗提物浸膏的制备 将4 ℃低温保藏的菌株分别接种到PDA平板上,27 ℃活化 3 d,挑取各菌株接种到PD液体培养基中,28 ℃、120 r/min条件下摇床培养 7 d,用四层纱布过滤收集发酵液。用乙酸乙酯等体积萃取发酵液4次,合并萃取液于45℃减压浓缩,得到各菌株粗提物浸膏。取以上各菌株发酵液粗提物适量,称重,备用。
2.4 抗细菌活性测定 将各供试细菌接种于营养琼脂液体培养基中,37℃培养24h,用无菌生理盐水稀释,配制成 1×105~1×107CFU/mL的菌液。吸取 1mL菌液于灭菌的培养皿中,倒入已冷却到合适温度的营养琼脂培养基中,混合均匀,待冷却之后放置己灭菌的直径为 6mm滤纸片,分别吸取提取液 5μL滴加于滤纸片上,以DMSO代替样品提取液作空白对照,金黄色葡萄球菌、枯草芽孢杆菌以氨苄青霉素作阳性对照,大肠杆菌以硫酸卡那霉素作阳性对照。置37℃恒温箱培养16~24h,观察细菌生长情况并测量抑菌圈大小。
2.5 细胞毒活性测定 采用SRB法[11]测定发酵提取物的细胞毒活性。取对数生长期的NCI-H460、SF-268、MCF-7、HepG-2细胞,用胰酶消化,台盼蓝染色计数。台盼蓝排斥实验检测细胞活力大于95%后,用新鲜培养基调整细胞浓度为3×104 个/mL,细胞接种于96孔板,每孔加入180μL的细胞悬液,并设空白孔调零,于37 ℃、5% CO2培养箱培养24h。待细胞贴壁后,每孔加入20μL待测样品,阴性对照加20μL培养基,以顺铂作阳性对照。置CO2培养箱中培养72h后,加入50μL 50%冷三氯醋酸固定细胞,4℃放置1h后用蒸馏水洗涤5次,空气中自然干燥。然后加入由1%冰醋酸配制的SRB溶液(4mg/mL)100μL/孔,室溫中染色30min,去上清,用1%冰醋酸洗涤5次,空气干燥。最后每孔加入200μL浓度为10mmol/mL的Tris溶液,用酶标仪测定570nm处的吸光度(A)值,按以下公式计算提取物对细胞生长的抑制率:
细胞生长抑制率(%) = (1-A样品组/A对照组) ×100%
3 结果
3.1 内生真菌的分离与鉴定 从垂枝红千层的茎、叶中分离到29株内生真菌,将测序后获得的ITS序列提交至NCBI数据库进行BLAST分析并获得登录号,结果见表1。从表1可以看出,分离菌株鉴定为17属20种,未鉴定至种名的有4 株;其中以黑孢霉属(Nigrospora)、间座壳属(Diaporthe)和刺盘孢属(Colletotrichum)为优势类群,共12株,占分离菌株总数的41.37%;而菌株A797和A805与最相似物种的相似度较低,分别是96.3%和93.3%,有待进一步鉴定。
3.2 内生真菌的抗细菌活性 29株内生真菌中有9个属11株真菌的提取物至少对1种供试细菌有抗菌活性(抑菌圈直径≥8 mm),占分离菌株总数的37.9%,对2种供试细菌有抑制作用的活性菌株有3株,占分离菌株总数的10.3 %。其中对SA和BS都具有较好抑制活性(抑菌圈直径≥13 mm)的菌株有3株,分别是菌株A797、A798和A809;所有内生真菌的提取物对大肠杆菌均没有明显的抑制作用。见表2。
3.2 内生真菌的抗肿瘤活性 各菌株发酵液粗提物的体外细胞毒活性测试结果见表3。从表3中可以看出,当粗提物的浓度为100μg/mL时,29株内生真菌中共有6个属10株真菌提取物至少对1种供试细胞株有抑制作用(抑制率≥50%以上),占分离菌株总数的 34.5%;对4株受试肿瘤细胞均具有显著活性(抑制率≥90%以上)的菌株有3株,分别是菌株A781、A785和A805。
4 讨论
红千层属植物的化学成分和生物活性已有大量的研究报道。本研究首次对垂枝红千层的内生真菌多样性及其生物活性进行探索,从中分离获得了29株内生真菌,经ITS序列分析鉴定为17属20种,其中以黑孢霉属、刺盘孢属和间座壳属为优势类群。通过对内生真菌发酵粗提物的抗细菌和抗肿瘤活性测试,发现有9个属11株真菌提取物至少对1种供试细菌有抗细菌活性(抑菌圈直径≥8mm),其中菌株Pseudofusicoccum violaceum A797、Amesia gelasinospora A798和Botryosphaeria dothidea A809的发酵提取物,对金黄色葡萄球菌和枯草芽孢杆菌均具有较好抑制活性(抑菌圈直径≥13mm);细胞毒实验结果表明,当内生真菌粗提物浓度为100μg/mL时,共有6个属10株真菌提取物至少对1 种受试细胞株有抑制作用(抑制率≥50% 以上),其中菌株Guignardia mangiferae A781、Nigrospora sphaerica A785和Diaporthe phaseolorum A805对SF-268、MCF-7、NCI-H460和HepG-2 4种受试细胞的抑制率均在90%以上。结果表明,垂枝红千层内生真菌具有较为丰富的物种多样性,且部分菌株具有较好的生物活性,为进一步研究垂枝红千层内生真菌活性代谢产物奠定基础,并为开发利用垂枝红千层资源提供了科学依据。
参考文献
[1]Schulz B, Boyle C, Draeger S, et al. Endophytic fungi: a source of novel biologically active secondary metabolites[J]. Mycol Res, 2002, 106(9):996-1004.
[2]Goyal PK, Jain R, Jain S, et al. A review on biological and phytochemical investigation of plant genus Callistimon[J]. Asian Pac J Trop Biomed, 2012, 2(3):S1906-S1909.
[3]Gohar AA, Maatooq GT, Gadara SR, et al. One new pyrroline compound from Callistemon viminalis (Sol. Ex Gaertner) G.Don Ex Loudon[J]. Nat Prod Res, 2013, 27(13):1179-1185.
[4]WU L,LUO J, ZHANG Y L, et al. Isolation and biomimetic synthesis of (±)- calliviminones A and B, two novel Diels-Alder adducts, from Callistemon viminalis[J].Tetrahedron Lett, 2015, 56:229-232.
[5]WU L, LUO J, WHANG X B, et al. Calliviminones C-H: six new hetero- and carbon-Diels-Alder adducts with unusual skeletons from the fruits of Callistemon viminalis[J]. Rsc Adv, 2015, 5(114):93900-93906.
[6]Badawy MEI, Abdelgaleil SAM. Composition and antimicrobial activity of essential oils isolated from Egyptian plants against plant pathogenic bacteria and fungi[J]. Ind Crop Prod, 2014, 52(1):776-782.
[7]Khambay BPS, Beddie DG, Hooper AM, et al. Isolation, characterisation and synthesis of an insecticidal tetramethyltetrahydrochromenedione-spiro-bicyclo[3.1.1]cycloheptane from two species of Myrtaceae[J]. Cheminform, 2003, 59(36):7131-7133.
[8]Zubair M, Hassan S, Rizwan K, et al. Antioxidant potential and oil composition of Callistemon viminalis leaves[J]. Sci World J, 2013, http://dx.doi.org/10.1155/2013/489071.
[9]王磊, 章衛民,潘清灵,等. 白木香内生真菌的分离及分子鉴定[J].菌物研究,2009,7(1):37-42.
[10]White TJ, Bruns TD, Lee SB, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protocols, A Guide to Methods and Applications. 1990, 315-322.
[11]Gálvez M, Martín-Cordero C, López-Lázaro M, et al. Cytotoxic effect of Plantago spp. on cancer cell lines [J]. JEthnopharm, 2003, 88(2-3):125-130.
(收稿日期:2019-09-24 编辑:刘 斌)
基金项目:国家自然科学基金项目 (31600271);广东省科技计划项目(2107A020211023);广州市珠江科技新星项目 (201806010080)。
作者简介:李赛妮(1991-),女,汉族,本科,研究方向为微生物资源与应用技术。E-mail:1119606031@qq.com
通信作者:章卫民(1965-),男,汉族,博士,研究员,研究方向为药用微生物资源及其活性物质研究。E-mail:wmzhang58@qq.com
