肺组织硅藻定量分析在实验动物溺死诊断中的应用
2019-02-10赵建罗银洲王玉仲肖成石河胡孙林康晓东徐曲毅成建定刘超
赵建,罗银洲,王玉仲,肖成,石河,胡孙林,康晓东,徐曲毅,成建定,刘超
(1.中山大学中山医学院法医学系,广东 广州 510080;2.广州市刑事科学技术研究所 法医病理学公安部重点实验室,广东 广州 510030;3.十堰市公安局,湖北 十堰 442000;4.广东江门中医药职业技术学院,广东 江门 529000;5.南方医科大学法医学院,广东 广州 510515)
硅藻检验是溺死诊断最常用的实验室检查方法[1-5]。一般认为,在肺、肝、肾、牙齿和骨髓等器官中检出硅藻,是诊断溺死的基本原则[6]。溺死和死后入水时,硅藻均可以随溺液从呼吸道进入尸体肺组织[7]。由于进入方式不同(主动吸入或被动进入),导致溺死和死后入水的尸体肺组织硅藻含量存在差异,溺死者肺组织硅藻含量较高,死后入水者肺组织硅藻含量较低或者不含硅藻[1,8-13]。然而,过去关于肺组织硅藻含量的描述多为直观感受,无明确的分析参数和量化标准[6]。本研究采用较传统硅藻检验方法更灵敏的微波消解-真空抽滤-扫描电镜联用法[14],分析溺死及死后入水者肺组织和溺液的硅藻含量,探讨肺组织硅藻检验在溺死诊断中的应用价值。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组
18只新西兰大白兔(广东省动物实验中心提供),雌雄不限,体质量1.0~3.0kg,随机分为溺死组10只,死后入水组6只,陆地死亡组2只。实验地点为广州市南沙区虎门大桥。本实验设计符合实验动物福利伦理要求。
26只五指山猪(广东省实验动物监测中心),雌雄不限,体质量13.3~15.1kg,随机分组,如表1。

表1 实验猪分组
1.1.2 试剂
硝酸(65%~68%)、过氧化氢(30%)和无水乙醇均为分析纯,购自广州化学试剂厂。
1.1.3 仪器
Multiwave3000微波消解仪(奥地利Anton Parr公司),HL-6多联真空抽滤仪(珠海黑马医学仪器有限公司),FEI QUANTATM600型扫描电镜(荷兰FEI公司),Genesis7000型能谱仪(美国EDAX公司)。
1.2 方法
根据实验分组,模拟溺死、死后入水和陆地死亡[15]。溺死组:实验动物沉入水下0.5m处1min,提出水面30s后重新沉入相同水深处,重复数次直至实验动物溺死,死后在水中浸泡30 min。死后入水组:实验动物注射过量麻醉剂处死,沉入水下0.5m处浸泡30min。陆地死亡组:实验动物注射过量麻醉剂处死。
提取实验兔的全肺组织,提取实验猪肺左尖叶、左心叶、左膈叶、左副叶、右尖叶、右心叶、右膈叶的边缘及中段组织各2 g,提取各水体类型的溺液样本500mL。
提取前所有试剂、工具、器皿均用超纯水冲洗,确认不含硅藻。
采用微波消解-真空抽滤-扫描电镜联用法[14],分析肺组织和溺液的硅藻含量(个/g)。
计算肺组织与溺液硅藻含量的比值(ratio of content of diatoms in lung tissue and drowning fluid,CL/CD)[7]:
CL/CD=肺组织硅藻含量/溺液硅藻含量。
1.3 统计学处理
实验数据应用SPSS 17.0进行统计学分析。对溺死与死后入水组实验兔肺组织的CL/CD值进行t检验,对溺死与死后入水组实验猪各肺叶组织的CL/CD值、不同水体类型中溺死与死后入水实验猪的CL/CD值进行秩和检验。检验水准α=0.05。
2 结 果
陆地死亡的实验兔及实验猪的肺组织中均未检出硅藻。
溺死组实验兔肺组织CL/CD最小值为1.02,最大值为13.69;死后入水组实验兔肺组织CL/CD最小值为0.22,最大值为1.17。由表2可知,溺死组与死后入水组实验兔肺组织CL/CD值的差异有统计学意义(P<0.05),溺死组肺组织CL/CD值大于死后入水组。
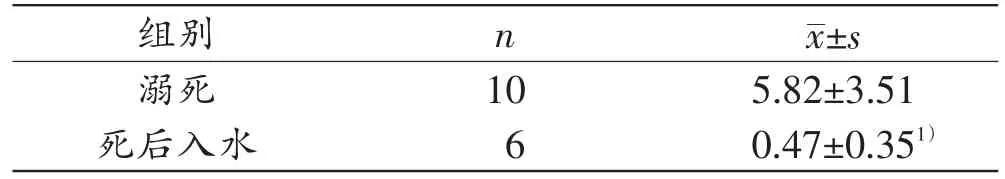
表2 溺死与死后入水组实验兔肺组织的CL/CD值
溺死组实验猪各肺叶组织CL/CD最小值为0.02,最大值为418.76;死后入水组实验猪各肺叶组织CL/CD最小值为0,最大值为1.59。由表3可知,溺死组与死后入水组实验猪各肺叶组织CL/CD值的差异有统计学意义(P<0.05),溺死组各肺叶边缘及中段组织的CL/CD值均大于死后入水组。如表4所示,不同水体类型中,溺死组与死后入水组实验猪之间肺组织CL/CD值的差异均有统计学意义(P<0.05),溺死组CL/CD值大于死后入水组。
表3 溺死与死后入水组实验猪各肺叶组织的CL/CD值(n=12±s)
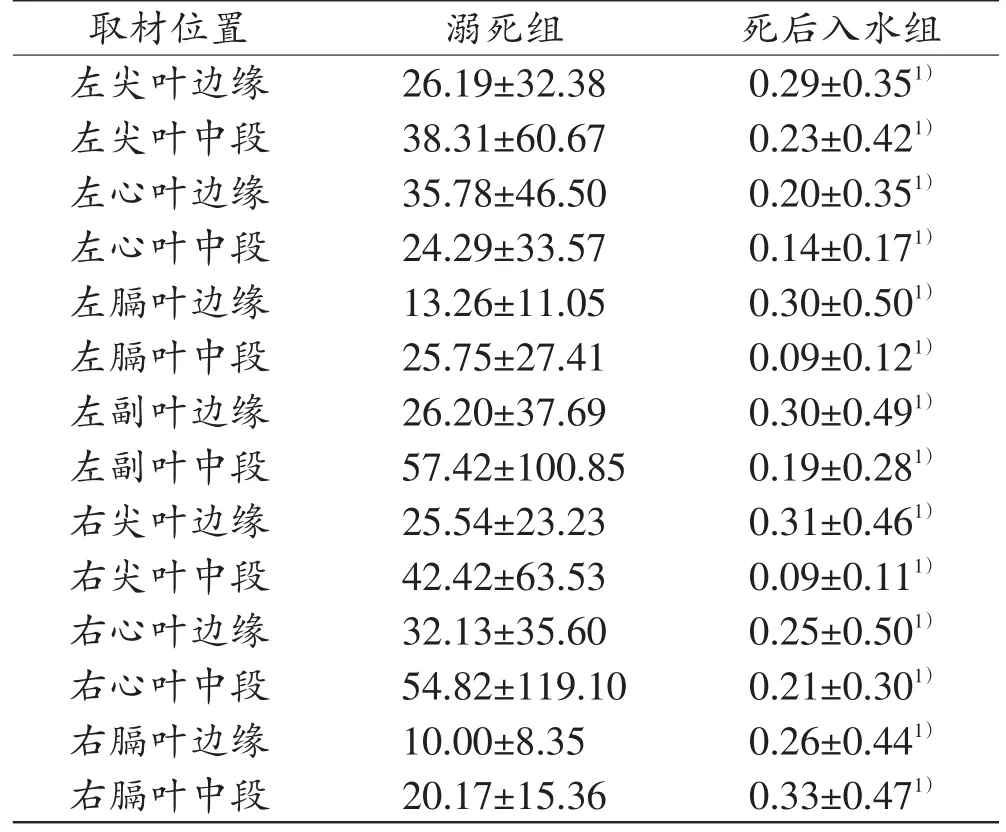
表3 溺死与死后入水组实验猪各肺叶组织的CL/CD值(n=12±s)
注:1)与溺死组比较,P<0.05。
images/BZ_69_206_460_1194_514.png26.19±32.380.29±0 38.31±60.670.23±0 35.78±46.500.20±0 24.29±33.570.14±0 13.26±11.050.30±0 25.75±27.410.09±0 26.20±37.690.30±0 57.42±100.850.19±0 25.54±23.230.31±0 42.42±63.530.09±0 32.13±35.600.25±0 54.82±119.100.21±0 10.00±8.350.26±0 20.17±15.360.33±0左尖叶边缘左尖叶中段左心叶边缘左心叶中段左膈叶边缘左膈叶中段左副叶边缘左副叶中段右尖叶边缘右尖叶中段右心叶边缘右心叶中段右膈叶边缘右膈叶中段.351).421).351).171).501).121).491).281).461).111).501).301).441).471)
表4 不同水体类型中溺死与死后入水实验猪的CL/CD值(±s)
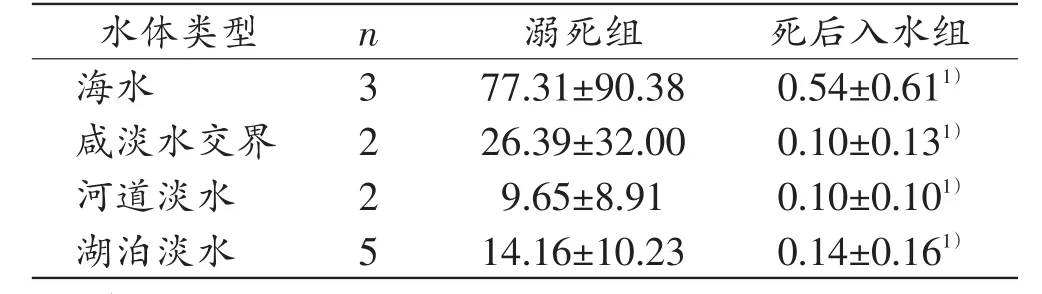
表4 不同水体类型中溺死与死后入水实验猪的CL/CD值(±s)
注:1)与溺死组比较,P<0.05。
死后入水组77.31±90.380.54±0 26.39±32.000.10±0 9.65±8.910.10±0 14.16±10.230.14±0.611).131).101).161)水体类型海水咸淡水交界河道淡水湖泊淡水n3 2 2 5溺死组
3 讨 论
溺死是法医学实践中最难判断的死因之一[16-17]。法医学者们研发了许多用于诊断溺死的标志物[18-23],其中硅藻检验被认为是最可靠、最有效的方法[16]。肺、肝、肾、脾、脑、骨髓、血液、胃内容物等均可以用于硅藻检验。肺组织和至少一个远端器官组织检出硅藻是诊断溺死的基本要求[6,24]。为了排除死后入水进入肺组织的硅藻和外源性硅藻污染,认为10g肺组织中的硅藻多于20个是诊断溺死的依据之一[2,24]。但是,随着硅藻检验方法灵敏度的提高,ZHAO等[7]发现死后入水者肺组织中硅藻含量比传统认为的要高,最高接近2000个/10g肺组织。因此,传统的20个/10g肺组织并不适用于灵敏度高的硅藻新方法检验结果的分析。由于肺组织硅藻含量受溺液影响很大,为了排除溺液的影响,本研究引入了CL/CD值来分析比较溺死与死后入水者肺组织的硅藻含量。CL/CD值体现了肺组织对溺液中硅藻的“净富集”情况。
如表2~3所示,溺死兔、溺死猪肺组织的CL/CD值均高于死后入水组,说明溺死组肺组织对溺液中硅藻的“富集”更为明显。这是由于溺水时,主动呼吸吸入大量的溺液,部分溺液通过肺泡进入血液,导致硅藻在肺组织内富集。溺死猪7个肺叶边缘及中部的CL/CD值均大于死后入水组,说明溺水时实验猪全肺均扩张吸入了大量溺液,是在溺液中缺氧导致呼吸运动加剧的表现。而死后入水者,溺液在水压的作用下进入肺组织,无主动呼吸和溺液渗透作用,那么肺组织的硅藻含量应该少于溺液中的硅藻含量或者与溺液中的硅藻含量相当,CL/CD值分布应在0~1,考虑到溺液中硅藻含量的变化,部分可能大于1。死后入水兔肺组织的CL/CD最大值为1.17,死后入水猪肺组织的CL/CD最大值为1.59。死后入水猪肺组织的CL/CD最小值为0,这是由于死后入水时,硅藻难以到达肺边缘,肺组织中的硅藻主要来源于在水的压力作用下被动进入的呼吸道内的溺液。当CL/CD值在1~1.6时,溺死组与死后入水组存在部分重叠,而在CL/CD>1.6时,所有的均为溺死组实验兔或实验猪。动物实验结果表明,当肺组织硅藻富集明显(CL/CD>1.6)时,是诊断溺死的可靠指标。对CL/CD值在1~1.6的案例进行溺死诊断时,应与多器官的硅藻检验结果相结合进行分析。
无论是在海水、咸淡水交界还是淡水,溺死组CL/CD值均大于死后入水组,CL/CD值可以用于区别溺死与死后入水,CL/CD值具有稳定的特点,不受溺液类型的影响。
溺死与死后入水的区别在于入水后是否有主动呼吸,肺组织硅藻的富集是主动呼吸作用的重要体现。因此,进行硅藻检验时,在多器官检出硅藻的同时引入肺组织CL/CD值这一参数进行分析,能更准确地作出溺死的诊断。
需要注意的是,肺组织的富集作用在溺液中硅藻含量高时才能较好地体现,溺液中硅藻含量低时,富集作用不明显[7]。在进行溺死诊断时,仍然应该与尸体检验、案情调查、毒(药)物检验等结合综合分析。
