非典型电流损伤死亡大鼠血清代谢组学变化
2019-02-10李林峰董贺文柳丹凤田甜代号刘敏
李林峰,董贺文,柳丹凤,田甜,代号,刘敏
(1.四川大学华西基础医学与法医学院,四川 成都 610041;2.司法鉴定科学研究院 上海市法医学重点实验室 司法部司法鉴定重点实验室 上海市司法鉴定专业技术服务平台,上海 200063)
在法医学鉴定实践中,因电击导致死亡的案件时常发生,其原因多为意外,也可见于自杀和他杀[1-2]。根据体表有无明显电流斑,可以将电击伤分为典型与非典型两类[3]。电击死亡的诊断一般是以典型电流斑和皮肤金属化等特征作为主要依据,但在许多情况下,电击局部皮肤不会形成典型的电流斑[4],此类非典型电流损伤的诊断较为困难。另外,部分犯罪嫌疑人行凶后会电击死者尸体形成电流斑,伪装成被害人自行或意外触电死亡[5],而单纯通过形态学检验无法准确区分电流损伤发生在死亡之前还是之后[6],故生前电击死与死后电击的鉴别亦是法医学鉴定实践中的一大难题。近年来,部分学者应用电子显微镜、理化检查、免疫组织化学等方法试图寻找生前非典型电击死亡的特征性变化[7-8],但目前仍然难以准确诊断非典型电击死亡及鉴别生前或死后电流损伤。
WANG等[9]发现,除电流斑等触电部位的直接改变外,电流作用于人体导致损伤甚至死亡的机制更多体现在间接的全身作用,不仅可引起心、脑功能障碍,电流通过各种组织时均能造成一定的损伤及分子生物学改变。而代谢组学是研究生物体被内在或外在因素扰动后整个机体代谢的变化轨迹来反映某种病理生理过程中所发生的一系列生物事件的一门科学,目前已广泛应用于毒(药)物分析、食品营养学等领域[10]。本研究拟建立大鼠生前非典型电击死模型,运用核磁共振氢谱(1H nuclear magnetic resonance spec⁃troscopy,1H NMR)代谢组学方法对大鼠的血清进行分析,寻找差异代谢物,以期为生前非典型电击死的判定及其与死后即刻电击的鉴别提供依据。
1 材料与方法
1.1 主要仪器
600 MHz核磁共振波谱仪(美国Bruker公司),5mm核磁管(美国Wilmad-LabGlass公司)。
1.2 实验动物与分组
健康成年雄性SD大鼠30只,体质量220~250 g,由四川大学实验动物中心提供,随机分为对照组、非典型电击死组、死后即刻电击组、机械性窒息死亡组、机械性损伤死亡组和高温损伤死亡组,每组5只。本研究获得四川大学动物伦理学委员会批准。
1.3 动物模型制作及样品制备
非典型电击死模型:参照WANG等[9,11]方法制作大鼠非典型电击死模型。腹腔注射10%水合氯醛溶液(0.3mL/100g)麻醉后将大鼠左前肢与右后肢用生理盐水浸润,外包以生理盐水浸湿的纱布,用自制的电击装置施以110V交流电电击约3min致死,电击局部均未查见电流斑形成。
死后即刻电击模型:腹腔注射10%水合氯醛溶液(0.3 mL/100 g)麻醉后将大鼠颈椎脱臼处死,死后立即用前述电击方法电击相同部位3 min,电击局部均未查见电流斑形成。
机械性窒息死亡模型:腹腔注射10%水合氯醛溶液(0.3mL/100g)麻醉后将大鼠置于密闭容器内直至死亡。
机械性损伤死亡模型:腹腔注射10%水合氯醛溶液(0.3mL/100g)麻醉后用自制的自由落体打击装置打击大鼠头部,头部与砝码之间以厚约5 cm的海绵隔开,砝码质量5kg,自由落体高度60cm。打击后约1min大鼠死亡。
高温损伤死亡模型:腹腔注射10%水合氯醛溶液(0.3 mL/100 g)麻醉后将乙醇洒于大鼠体表燃烧约1min后致死,皮肤烧伤Ⅰ度~Ⅱ度。
对照组:腹腔注射10%水合氯醛溶液(0.3 mL/100g)麻醉后直接采用颈椎脱臼法将大鼠处死。
建模后,取各组大鼠腹主动脉血液2mL,置于离心管中,静置30min。待血液自然凝固后在室温下以离心半径16cm,3000r/min,离心10min,取上清液分装于冻存管中,于-80℃冰箱中保存。测试前将样本取出,室温解冻,在4℃下以离心半径10cm,14000r/min,离心10min,取400μL上清液,添加99%重水100μL,于5mm核磁管中混匀,在25℃下进行检测。
1.4 核磁共振波谱的采集及数据前处理
本实验采用600MHz核磁共振波谱仪,调用弛豫时间编辑Carr-Purcell-Meiboom-Gill(CPMG)脉冲序列采集小分子信号,并压制水峰,去除大分子蛋白。具体参数:采用预饱和方式抑制水峰,弛豫延迟时间为5 s,谱宽12 335 Hz,采样点数64 000,累加次数64次;自由感应衰减信号经过傅里叶变换转为一维核磁共振波谱(nuclear magnetic resonance spectros⁃copy,NMR)谱图。
用MestReNova 11.0软件(西班牙Mestrelab Re⁃search公司)对一维NMR谱图进行基线调整,相位校正,并于肌酸所在的3.05×10-6处定标,将δ0.5~9.0的谱图进行分段积分(每段0.04×10-6),同时去掉残余水峰(δ4.6~5.2),将所产生的所有积分数据归一化,以Excel文件格式输出保存,用于模式识别分析。
1.5 模式识别分析
将存有全部积分的Excel文件导入SIMCA-P 11.0软件(瑞典Umetrics公司)进行模式识别分析。采用置换检验对模型进行验证,其中R2X代表组分X的反差,Q2为两两样本比较的准确率,代表模型的预测能力;根据样本量的大小,将置换数量设为20或50;R2、Q2终点越接近,R2与Q2斜率越接近,Q2小于 0时,认为模型可靠。输出各组比较变量重要性投影值(variable importance in projection,VIP)并筛选出各样本中VIP大于1所对应的化学位移的不同积分值。
1.6 统计学分析
将筛选出的积分值导入SPSS 19.0软件进行单因素方差分析,将存在统计学差异的化学位移及所对应的峰可能的类型带入人类代谢组数据库(Human Me⁃tabolome Database,HMDB)进行对比,筛选得到的代谢物视为有差异的标志代谢产物。检验水准α=0.05。
2 结 果
2.1 一维核磁共振氢谱(1D-1H NMR)谱图初步对比
经观察比较,发现非典型电击死组与机械性窒息死亡组、机械性损伤死亡组、高温损伤死亡组、对照组的1D-1H NMR谱图在δ1.15~1.25、δ3.15~3.30、δ3.60~3.72、δ4.0~4.1、δ5.2~5.3谱峰存在明显差异(图1)。
非典型电击死组与死后即刻电击组、对照组的1D-1H NMR谱图在δ1.3~1.4、δ1.45~1.55、δ2.35~2.45、δ3.2~3.3、δ3.4~3.5、δ3.5~3.6、δ3.75~3.80、δ4.1~4.2、δ5.2~5.3谱峰存在明显差异(图2)。
2.2 标志代谢物筛选结果
得到的1D-1H NMR谱图经基线调整、相位校正、定标、积分、归一化等处理后,运用SIMCA-P 11.0软件输出多种模式下各组相应的得分图及载荷图,比较后发现OSC-PLS-DA模式识别效果最好。
2.2.1 非典型电击死组与机械性窒息死亡组、机械性损伤死亡组、高温损伤死亡组、对照组间的比较
在OSC-PLS-DA模式下得到的得分图与载荷图提示,非典型电击死组及对照组与机械性窒息死亡组、机械性损伤死亡组、高温损伤死亡组之间分别比较,均存在一些离原点越远、分布较分散且孤立的差异性化学位移(图3~5)。

图1 非典型电击死组与机械性窒息死亡组、机械性损伤死亡组、高温损伤死亡组、对照组的1D-1H NMR谱图

图2 非典型电击死组与死后即刻电击组、对照组的1D-1H NMR谱图

图3 非典型电击死组(♦)与机械性窒息死亡组(▲)、对照组(■)比较的OSC-PLS-DA得分图及载荷图
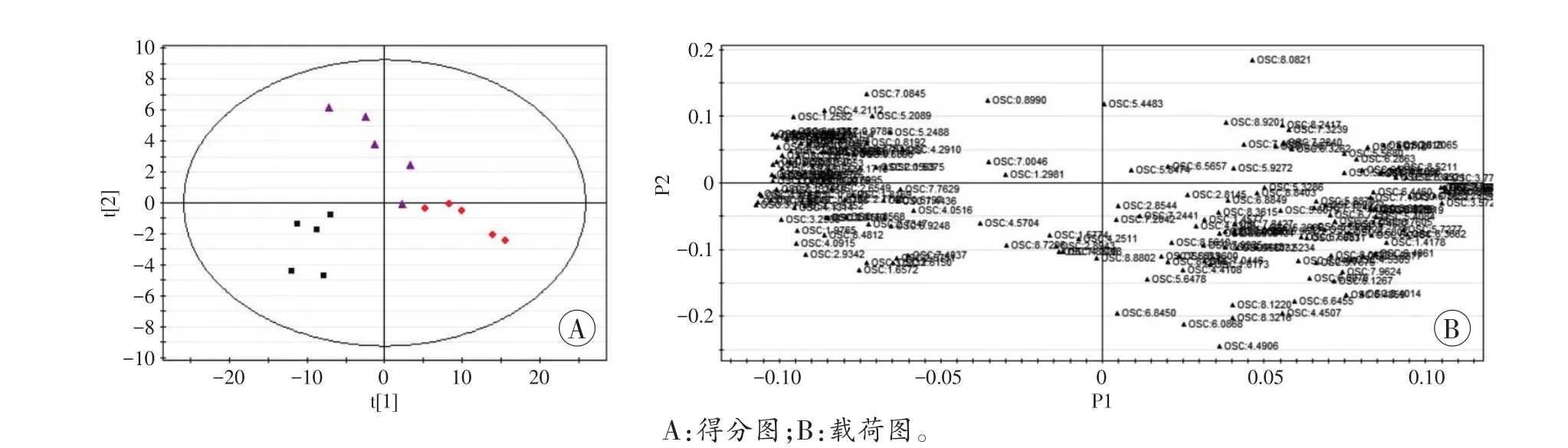
图4 非典型电击死组(♦)与机械性损伤死亡组(▲)、对照组(■)比较的OSC-PLS-DA得分图及载荷图
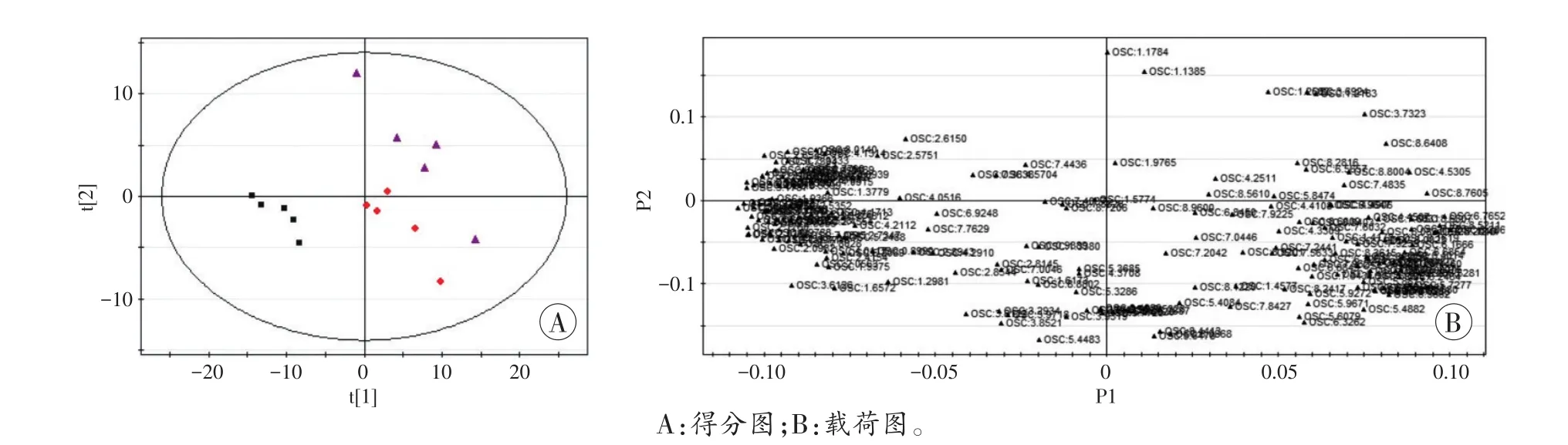
图5 非典型电击死组(♦)与高温损伤死亡组(▲)、对照组(■)比较的OSC-PLS-DA得分图及载荷图
根据各分组相应的得分图及载荷图结果,筛选VIP>1的化学位移,经单因素方差分析选择差异具有统计学意义的化学位移,对照HMDB数据库后,共筛选出4个位点上的差异物质(表1),包含醇类、酚类、糖类、氨基酸类等多种小分子物质。非典型电击死组与其他死因组及对照组间上述化学位移比较,P值均<0.05。
2.2.2 非典型电击死组与死后即刻电击组、对照组间的比较
在OSC-PLS-DA模式下得到的得分图与载荷图提示,非典型电击死组、死后即刻电击组和对照组间两两比较均存在差异性化学位移(图6~8)。
根据各组相应的得分图及载荷图结果,筛选VIP>1的化学位移,经单因素方差分析选择差异具有统计学意义的化学位移,对照HMDB数据库后,共筛选出8个位点上的差异物质(表2),包含糖类、氨基酸类、酯类、核酸等多种小分子物质。非典型电击死组与死后即刻电击组及对照组间上述化学位移点比较,P值均<0.05。

表1 非典型电击死组与其他死因组及对照组间标志性代谢物筛选结果
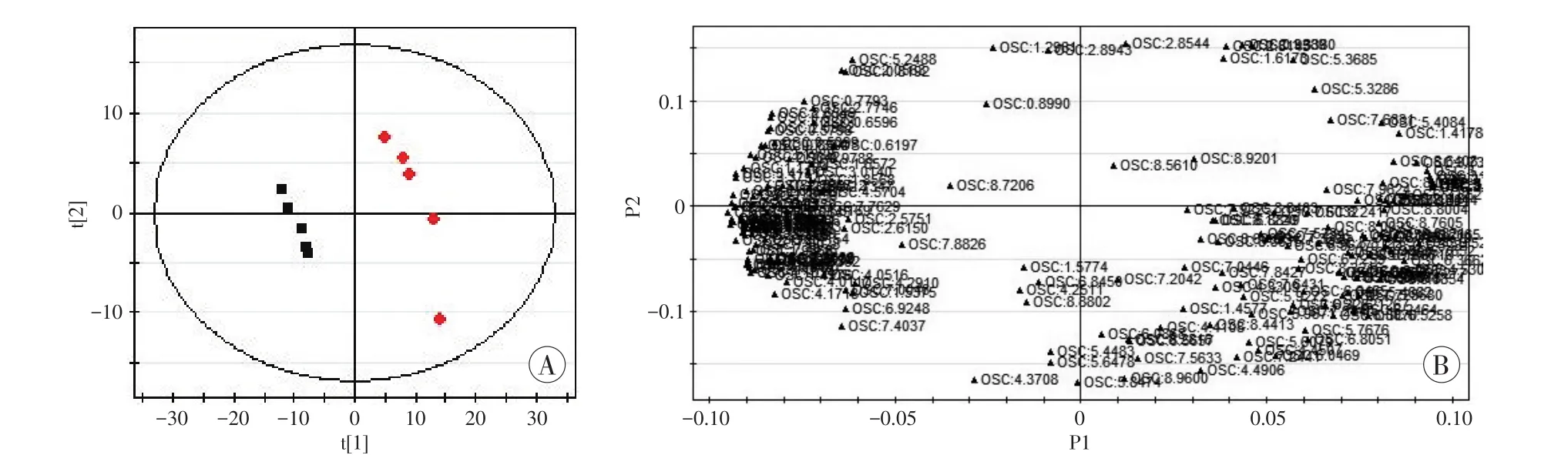
图6 非典型电击死组(♦)与对照组(■)比较的OSC-PLS-DA得分图及载荷图

图7 死后即刻电击组(♦)与对照组(■)比较的OSC-PLS-DA得分图及载荷图

图8 非典型电击死组(■)与死后即刻电击组(♦)比较的OSC-PLS-DA得分图及载荷图

表2 非典型电击死组与死后即刻电击组及对照组间标志性代谢物筛选结果
3 讨 论
3.1 代谢组学在非典型电击死诊断中的价值
电击发生时除电流本身对心、脑等重要器官有直接作用,还可使电击局部产生电烧伤、呼吸肌强直或痉挛导致窒息,同时,与带电物体的接触及电击后倒地、摔跌等均可能导致死者出现机械性损伤[6],因此无电流斑非典型电击死的诊断及与高温损伤死亡、机械性窒息死亡、机械性损伤死亡之间的鉴别一直是法医学领域的研究热点。PRINDEZE等[12]研究发现,电击伤可引起全身多器官组织细胞产生病理学变化,进而改变细胞内各种细胞因子及效应蛋白的产生和表达,影响机体的新陈代谢。本研究对非典型电击死组代谢产物与机械性窒息死亡组、机械性损伤死亡组、高温损伤死亡组的代谢产物进行比较,发现非典型电击死组与机械性窒息死亡组、机械性损伤死亡组、高温损伤死亡组之间均存在差异性化学位移点,说明利用代谢组学技术能够将非典型电流损伤死亡与前述死亡原因区分开。经进一步统计学分析,共筛选出4个具有鉴别价值的化学位移点及其对应的多种代谢物,涉及能量代谢、糖代谢等多种代谢途径,而这些差异性改变在其他死亡原因组内均未查见,具有诊断非典型电流损伤死亡的潜力。本研究结果提示,1H NMR代谢组学技术有望为非典型电击死的诊断提供实验依据。
3.2 代谢组学在生前电击死与死后即刻电击死鉴别中的价值
王晔等[13]研究发现,生前电击死模型与死后电击模型相比,骨骼肌中HSP70 mRNA及C-fos mRNA的表达存在一定差异;袁增琼等[14]研究结果显示,肌肉细胞特异性泛素蛋白连接酶1的表达亦在生前电击死组与死后电击组之间存在差异性变化。但目前仍无法准确区分生前电流损伤死亡与死后即刻电击。本研究对非典型电击死组代谢产物与死后即刻电击组、对照组代谢产物进行比较,共筛选出8个具有生前非典型电击死鉴别价值的化学位移点及对应的多种代谢物,涉及糖代谢、能量代谢、氨基酸代谢、核酸代谢等多种代谢途径。本研究结果说明,1H NMR代谢组学技术能够在一定程度上鉴别生前非典型电击死与死后即刻电击。
本研究将代谢组学技术应用于非典型电流损伤死亡的诊断及鉴别中,为寻找、发现具有鉴别价值的差异性生物标志物提供了全新的方向。然而,本研究虽然发现了存在鉴别价值的差异性化学位移点,但这些化学位移点同时代表着多个不同的代谢物,后续研究可利用二维核磁共振图谱或其他代谢组学方法推断具体的代谢物,进而明确标志性代谢物所涉及的代谢通路。
