基于GC/TOF-MS代谢组学方法的人参反藜芦研究
2019-02-10郭丽娜
郭丽娜,郑 茜
(山西医科大学药学院中药教研室,太原 030001;*通讯作者,E-mail:guolinaaa@126.com)
十八反是中药的配伍禁忌,沿用千年,最早记录十八反的是陶弘景《本草经集注》,书中记载了19种药物:甘草反甘遂大戟芫花海藻,藜芦反细辛芍药人参丹参沙参玄参苦参,乌头反半夏瓜蒌贝母白蔹白及,目前公认的十八反药物来源于此。人参与藜芦的应用历来存在争议。藜芦是一种有毒中药,历代医药家论述藜芦时都注意到其辛苦有大毒,金元时期的朱丹溪云:“服参一两,入藜芦一钱,其功尽废”。《神农本草经集注》中藜芦项下注有“反细辛,芍药,五参”。《本草纲目》中又注有“弘景曰:沙参与人参、玄参、丹参、苦参是为五参”[1]。《中国药典》指出上述诸参不宜与藜芦同用[2]。然而,古方中配伍反药用于治疗病症的记载仍有存在[3]。据不完全统计,明清以来大约130位医家用相反药物的情况,其中人参和藜芦同用者见7例[4]。另外,国外有研究提出,人参与藜芦配伍可用于治疗肥胖病[5]。综上,中药十八反在药理毒理及物质基础研究都取得一些进展。但从总体来看,集中以一些毒效指标为主要的研究策略,缺乏从整体(临床患者、实验动物)、细胞水平及分子水平的系统研究,且对药物作用于机体产生毒性的机制探讨较少[6]。
“代谢组学”(metabolomics)的概念于2000年首次被Fiehn等[7]提出,这项强有力的研究手段和中医药学的结合,将探索出中医药复杂理论体系研究的新方法与新途径[8-10]。通过对代谢组学的形成、基本思想、特点优势、分析策略与技术以及在中医药若干科学问题研究中的应用现状等进行分析与论述,并对其进一步应用于中医药研究及揭示中药作用机制等方面进行分析与探讨,以期为采用代谢组学方法和技术揭示中医药现代科学内涵提供指引和参考[11]。基于以上讨论,本研究利用基于气相色谱/飞行时间质谱(gas chromatography/time-of-flight mass spectrometry, GC/TOF-MS)的代谢组学方法,研究不同组合给药对于动物的毒性差异,及整体代谢的影响,从而使在处方应用上有一定的参考价值,使药物配伍在机制上有依据。
1 材料与方法
1.1 药材与试剂
藜芦(购自亳州药材总公司),人参(产地吉林,购自上海康桥中药饮片有限公司),分别为百合科藜芦VeratrumnigrumL.的干燥根茎、五加科人参PanaxgingsengC. A.Mey.的干燥根与根茎。
水合氯醛(国药集团化学试剂有限公司)20 g,加入200 ml纯水,混匀至完全溶解,制成10%水合氯醛液用于麻醉,现用现配。Na2HPO4·12H2O(同上)16.4 g、NaH2PO4·2H2O(同上)5.2 g加水溶解后,再定容至950 ml,最后加入50 ml甲醛(同上),制成甲醛固定液。GOP、GTP、BUN、Cr试剂盒(南京建成生物工程研究所),气相色谱/飞行时间质谱联用仪(GC/TOF-MS,Agilent6890/5975B,Agilent科技有限公司),气相毛细管色谱柱(DB-5 MS,Agilent科技有限公司),微型漩涡混合器(Vortex-Genie 2,美国Scientific Industries,Inc),全自动生化分析仪白立7080(上海日和贸易有限公司),BioTek PowerWave XS酶标仪;N-O-双(三甲硅基)三氟乙酰胺(BSTFA,含1%TMCS)、甲氧胺、尿素酶、L-2-氯苯丙氨酸、十七酸(美国Sigma-Aldrich公司),甲醇、氯仿(CHCl3)、吡啶(国药集团化学试剂有限公司)。
1.2 实验方法
1.2.1 药物的配制 取2.5 g藜芦和25 g人参浸泡1 h后微沸提取1 h,纱布滤过后再加入8倍量水微沸提取0.5 h,合并两次的提取液得到滤液1。另外,分别取7.5 g藜芦和75 g人参按照上述方法煎煮,分别得到滤液2和滤液3。静置24 h后,抽滤。滤液1浓缩至20 ml,此为合煎液;滤液2浓缩至60 ml,取出20 ml再浓缩至10 ml,称为浓缩液1;滤液3浓缩至60 ml,取出20 ml浓缩至10 ml,称为浓缩液2。合并浓缩液1和浓缩液2得到合并液。剩余浓缩液1和浓缩液2分别为藜芦、人参单煎液。每组17只,给药量0.2 ml/10 g,正常组给相同剂量的蒸馏水。
1.2.2 动物及给药 昆明种小鼠102只(18-22 g),雄性,由上海中医药大学实验动物中心提供,许可证号SCXK(沪)2012-0002。饲养于12 h昼夜交替的环境,适应性喂养一周。将所有小鼠随机分为6组:正常对照组、单煎藜芦组、单煎人参组、人参藜芦前后给药组、人参藜芦合并组、人参藜芦合煎组,每组17只。根据预实验及相关文献[12-18]确定2.5 g/kg作为单煎藜芦的浓度,人参浓度为25 g/kg。分别按照0.2 ml/10 g灌胃给予藜芦单煎液、人参单煎液、人参藜芦合煎液、人参藜芦合并液,人参藜芦前后给药组先给人参单煎液,1 h后给予藜芦单煎液,正常对照组给予蒸馏水。单次给药后禁食12 h后处理动物,心脏取血静置一段时间后,以4 000 r/min离心10 min,分离上层血清置1.5 ml离心管中,-40 ℃储存备用,将血清衍生化后待GC-MS进样分析。
1.2.3 GC/TOF-MS进样及数据处理 气相色谱和质谱条件:进样口温度260 ℃,进样量1.0 μl;不分液进样,载气,高纯氮(99.999%);流速,1.0 ml/min;接口温度280 ℃;色谱柱,DB-5MS毛细管柱;色谱柱升温程序见表1。离子源温度230 ℃,四级杆温度150 ℃,溶剂延迟,5 min;电子碰撞电离电压,70 eV,质谱全扫描范围(m/z):30-550,采用全扫描方式。
血清衍生化及进样:取出血清样本,室温解冻摇匀,吸100 μl血清于1.5 ml的离心管中,加入十七酸作为内标,加入300 μl甲醇 ∶氯仿=3 ∶1作为代谢物提取溶剂,漩涡震荡30 s,将混合液置于-20 ℃冰箱,10 min帮助蛋白沉淀,10 000 r/min离心10 min,吸取上清液300 μl于1.5 ml的高回收进样瓶中,在室温下将其真空干燥,氮气吹干。吹干后加入15

表1 GC/TOF-MS色谱柱温箱升温程序Table 1 GC/TOF-MS temperature programming
mg/ml甲氧胺80 μl,封盖器封口,震荡30 s后,于30 ℃下摇床中反应90 min,反应结束后加入80 μl BSFTA(含1%TMCS),振荡30 s,在70 ℃的烘箱里反应,反应结束后振荡10 s,室温放置1 h后,待GC-MS进样分析。
数据前处理与模式识别:原始数据经Agilent MSD工作站NIST软件转化为NetCDF格式后,导入R软件中,采用XCMS工具箱处理,该程序将自动执行基线校正、峰辨识、峰对齐等计算过程,最终得到一个由指定的峰指数、样品名称、峰面积组成的三维矩阵表。将得到的三维矩阵导入Simca-P11.5软件进行多维统计分析,经过中心化、标准化后进行主成分分析(principal component analysis,PCA)和偏最小二乘法判别分析法(partial least square-discriminant analysis,PLS-DA),用来考察样本总体代谢物谱图分布状况,以观察样品的聚集、离散及离群点。寻找与疾病最相关的代谢差异物,权重系数变量重要性投影(variable importance in projection,VIP)越大,表明该变量对模型的贡献最大,采用VIP>1表示多维统计上有差异的代谢物。
2 结果
2.1 全部实验组代谢谱比较的PCA得分和PLS-DA得分
给药后,每组仅有10只小鼠的数据有效。正常对照组、单煎人参组、单煎藜芦组、前后给药组、合并组、合煎组的代谢谱在非监督的PCA下差异不明显,在监督的PLS-DA下空白组和给药组有较为明显的差异,且单煎人参组对生物的代谢影响大于单煎藜芦组(见图1,2),分析原因可能是人参浓度过高的,其大补元气的作用更强。从图中还可看出两种药物的组作用明显强于单味药。
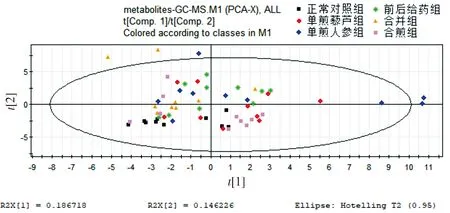
图1 全部组别代谢谱比较的PCA得分图Figure 1 PCA score plot of metabolic profiles in all groups
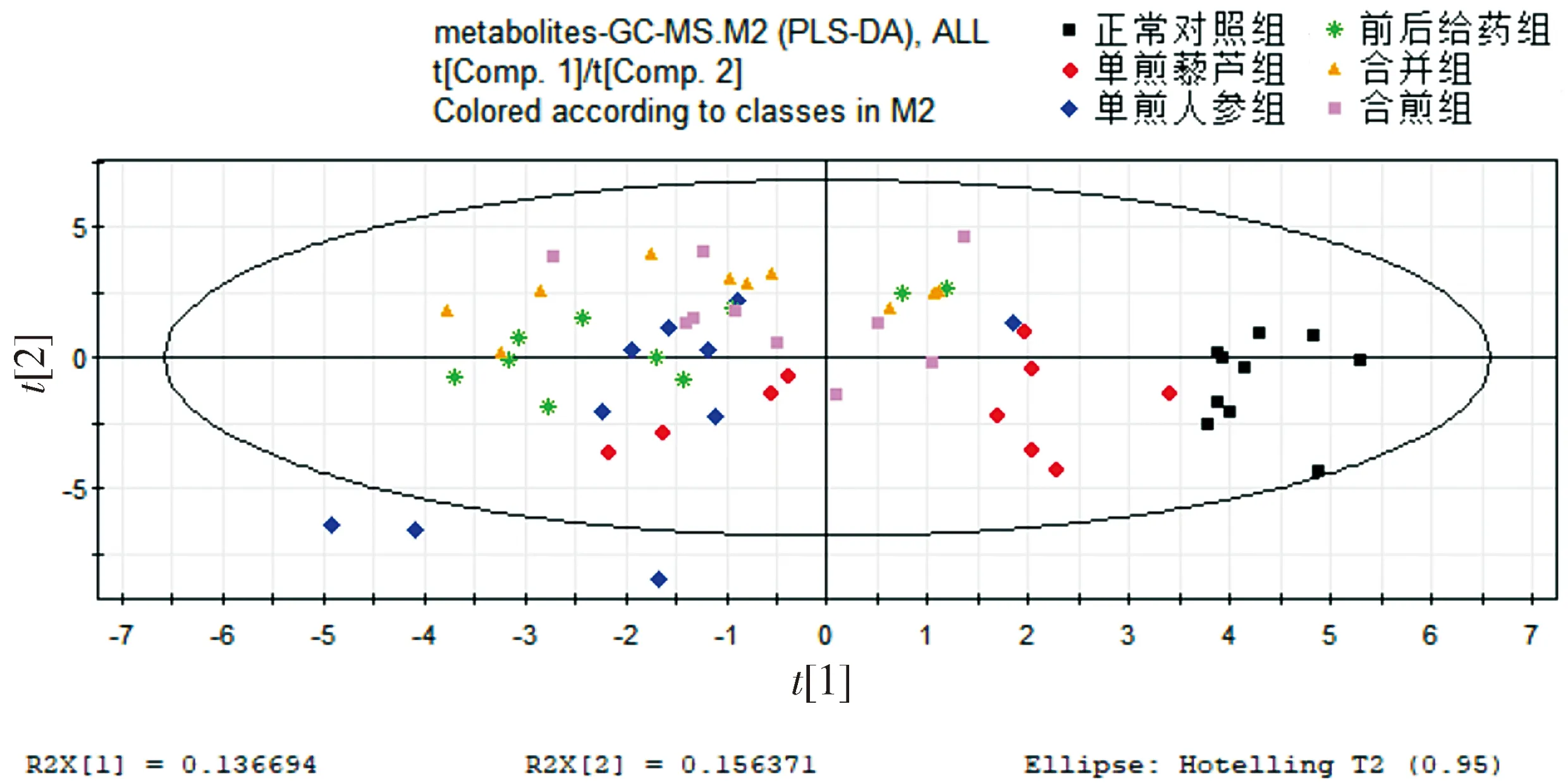
图2 全部组别代谢谱比较的PLS-DA得分图Figure 2 PLS-DA score plot of metabolic profiles in all groups
2.2 单煎藜芦组和合煎组代谢谱比较的PCA得分和PLS-DA得分
合煎组比单煎藜芦组多人参,十八反仍是研究的重点,观察药物合用是否对生物体有影响。从图可知两组的代谢谱图有明显差异,在PLS-DA模式下差异明显(见图3)。这种差异是必然的,因为多一味人参,且其浓度很大。当然不排除人参和藜芦合用之后对生物体的作用增强。
进而发现了9种差异代谢物,合煎组和单煎藜芦组之间的代谢物有较为明显的差异,血清代谢差异物结果见表2。
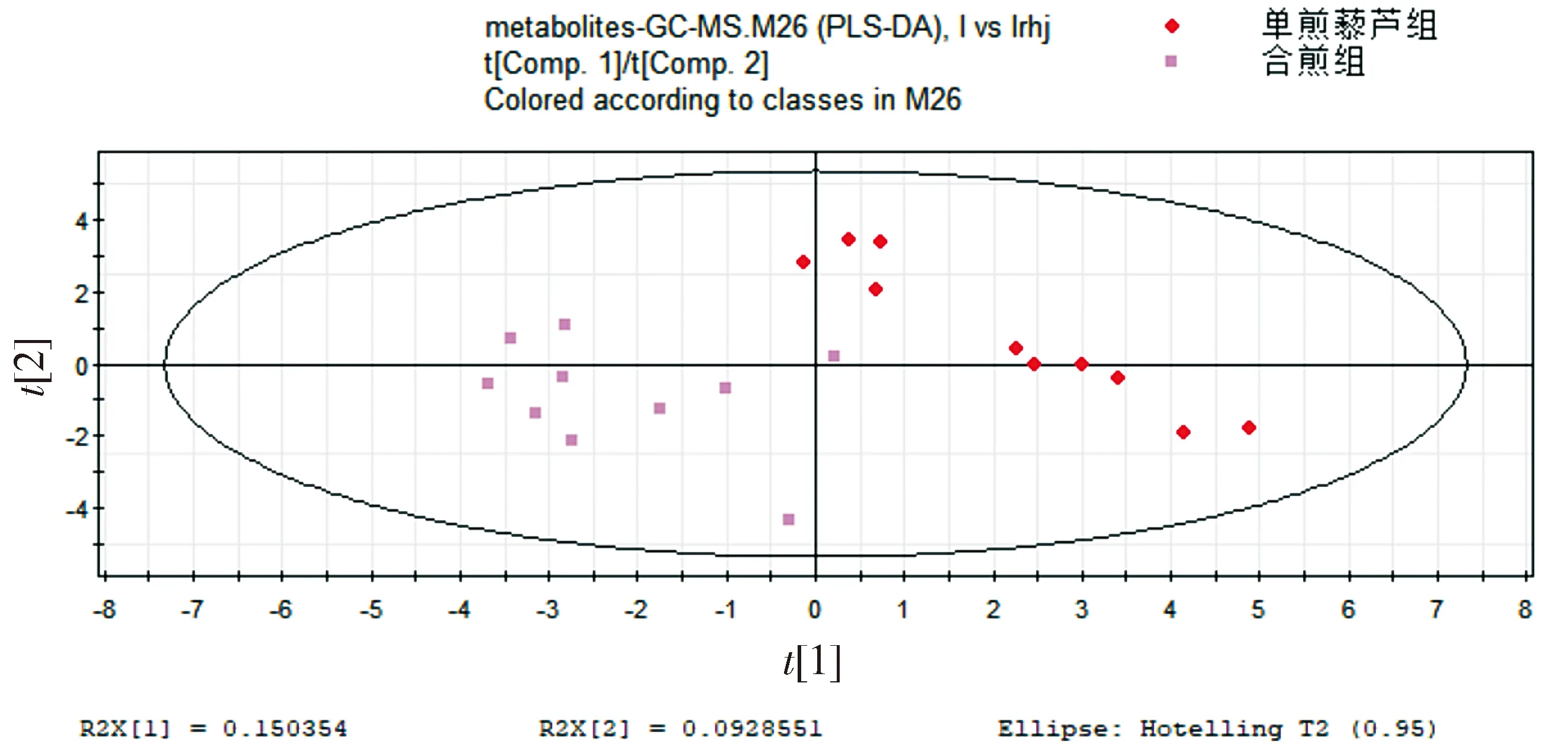
图3 合煎组、单煎藜芦组代谢谱比较的PLS-DA得分图Figure 3 PLS-DA score plot of metabolic profiles in mixed-decoction group and veratrum nigium group
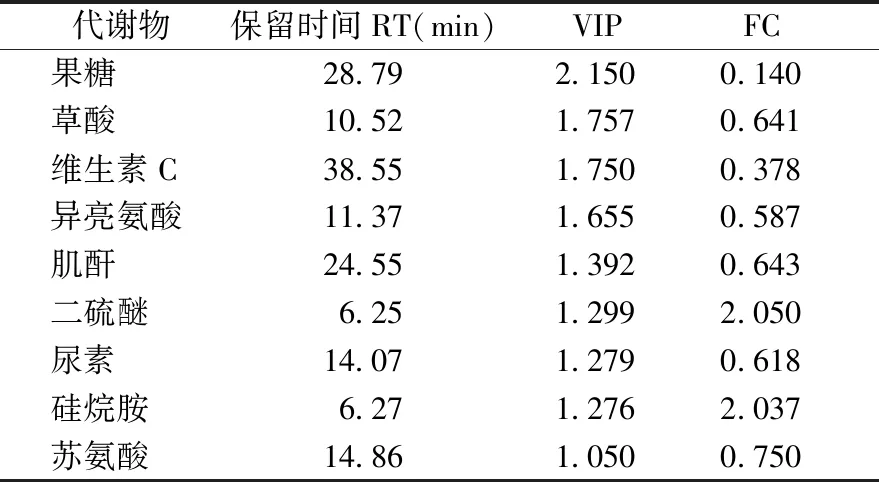
表2 合煎组、单煎藜芦组代谢差异物Table 2 Differential metabolites in mixed-decoction group and veratrum nigium group
2.3 前后给药组和合并组代谢谱比较的PCA得分和PLS-DA得分
前后给药组和合并组都属于人参和藜芦单煎后再给药,区别是合并组比前后给药组人参和藜芦先接触1 h对生物体产生影响。从图可知两组的代谢谱图有明显差异,在PLS-DA模式下差异明显(见图4)。这说明人参和藜芦合并后药物成分发生了变化,或者前后给药组的人参先接触机体后发挥作用1 h,再给药藜芦发挥作用,区别于合并之后对机体的影响。
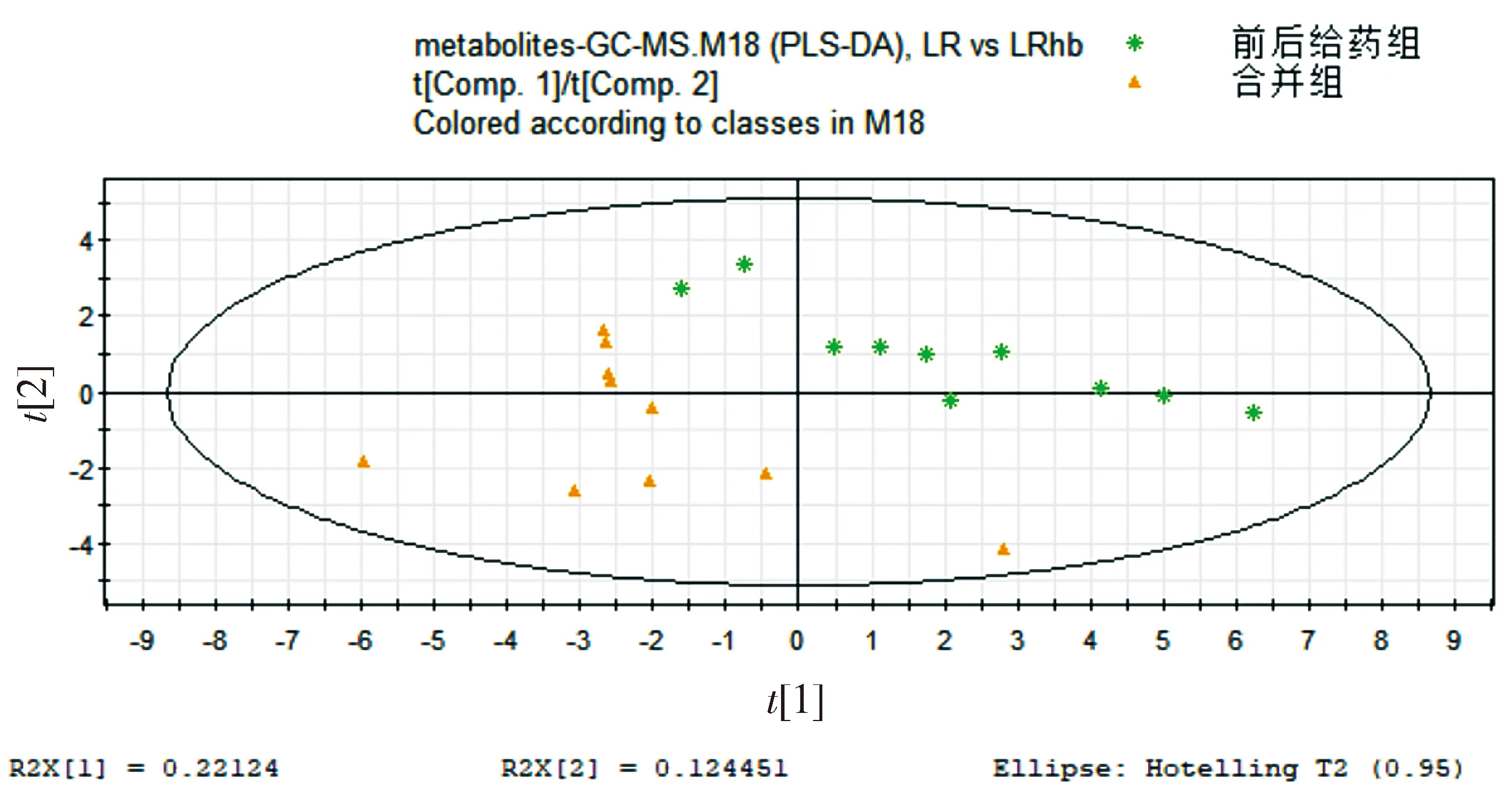
图4 前后给药组和合并组代谢谱比较的PLS-DA得分图Figure 4 PLS-DA score plot of metabolic profiles in combination group and mixture group
进而发现了11种差异代谢物,前后给药组和合并组之间的代谢物有较为明显的差异,血清代谢差异物结果见表3。

表3 前后给药组、合并组代谢差异物表Table 3 Differential metabolites in mixture group and combination group
2.4 合并组和合煎组代谢谱比较的PCA得分和PLS-DA得分
为了观察合并组、合煎组对生物体的影响,经过PCA和PLS-DA考察代谢图谱分布状况。从图5可知两组的代谢谱图有明显差异,在PLS-DA模式下差异明显。合并和合煎的区别在于一个是单煎后药液合并,一个是两种原药材一起煎煮。其中人参和藜芦的浓度是相同的,但可能在煎煮方式的不同,使得药物成分发生变化。
进而发现了14种差异代谢物,合并组和合煎组之间的代谢物有较为明显的差异,血清代谢差异物结果见表4。
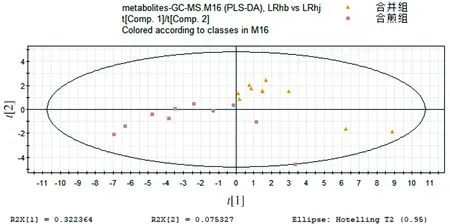
图5 合并组和合煎组代谢谱比较的PLS-DA得分图Figure 5 PLS-DA score plot of metabolic profiles in mixture group and mixed-decoction group
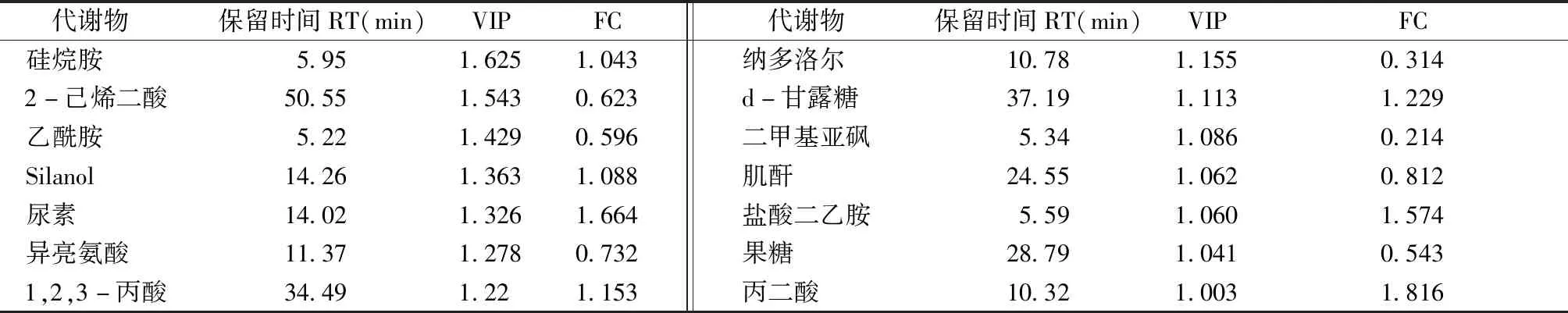
表4 合并组、合煎组代谢差异物表Table 4 Differential metabolites in mixture group and mixed-decoction group
2.5 前后给药组、合并组和合煎组
前后给药组、合并组、合煎组中人参和藜芦的浓度都相同,区别在于单煎后人参先给药藜芦后给药、单煎人参藜芦合并后给药、合煎后给药。在PCA模式下三组的代谢谱差异明显,而在PLS-DA模式下更明显。从图6,7中可以看出前后给药组和合并组在Comp2上可以区分,而这两组与合煎组则在Comp1上可以明显区分,且合煎组对生物体的影响明显大于另外两组。
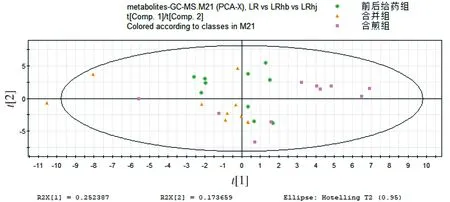
图6 合并组、前后给药组、合煎组组别代谢谱比较的PCA得分图Figure 6 PCA score plot of metabolic profiles in mixture group, combination group and mixed-decoction group
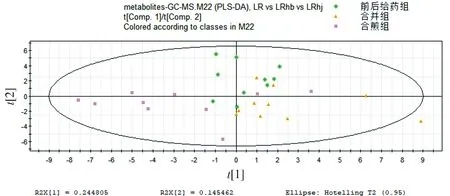
图7 合并组、前后给药组、合煎组组别代谢谱比较的PLS-DA得分图Figure 7 PLS-DA score plot of metabolic profiles in mixture group, combination group and mixed-decoction group
3 讨论
给药前每组有17只小鼠,给药后由于药物作用或者灌胃技术等原因,每组只剩10只小鼠收集到有效血清以供数据监测,这也说明人参剂量过大、藜芦中的藜芦碱等毒性成分或者人参与藜芦配伍的原因都使小鼠造成一定程度的死亡或者小鼠的血清收集量过少,这也为“人参反藜芦”理论提供了某些依据。
代谢组学的对比主要针对三类比较,即单煎藜芦组和合煎组、合并组和合煎组、前后给药组和合并组。合并组和合煎组的区别在于煎药方式,一个是单煎藜芦、人参后合并,一个是人参、藜芦一起煎煮。两种药物在高温下是否会相互作用,从PLS-DA结果中可以看出是有差异的,从内源性代谢物角度看,异亮氨酸有明显差异,异亮氨酸是支链氨基酸,目前已有相关研究表明支链氨基酸与胰岛素抵抗、2型糖尿病、癌症和心血管等疾病密切相关,说明在生物体内当以上多种内源性产物代谢发生紊乱时,都会产生与其相关的代谢性疾病[19]。差异性内源性代谢物肌酐和尿素分别是肌肉代谢和蛋白质代谢的产物,反映肾脏的功能,对肾脏代谢废物的能力产生影响。果糖的差异性变化说明不同的煎煮方式导致糖类代谢水平发生了变化。
合并组和前后给药组都是单煎药物给药,区别在于前后给药组的藜芦要晚1 h接触机体,且从两者的PLS-DA结果中看出两者合并之后药物成分可能发生了变化。
合煎组和单煎藜芦组的对比在于观察人参和藜芦配伍是否对生物体有不同的影响。两组之间的代谢物有较为明显的差异,内源性差异代谢物异亮氨酸、尿素和肌酐说明两种煎煮方式扰乱了氨基酸代谢和能量代谢以及肾脏功能代谢,表明人参和藜芦相互作用确实对生物体的代谢情况有一定的影响。
从各组的PLS-DA模式上可以看出,人参对生物体的影响大于藜芦组,可能是人参剂量过大造成的,也有可能藜芦没有表现出毒性即预实验结果并未重复。杨亮等[16]利用UPLC-Q/TOF-MS技术,由主成分分析图OPLS-DA可见,合煎液、合并液及合并液再煎液三组样品得到明显的区分。王宇光等[20]利用主成分分析法(PCA)和正交偏最小二乘判别分析法(OPLS-DA),得出合并液与合煎液化学指纹图谱的差异能够得到明显的区分。因此,结合相关文献报道,可以得出结论,合煎液和合并液在代谢谱上是有差异的。综上所述,这三组比较均扰乱了氨基酸的生物合成及代谢、机体的能量代谢、肌肉代谢、蛋白质代谢及糖代谢,为藜芦和人参配伍后内源性代谢物靶标的发现提供依据。
人参和藜芦自《本草经集注》中提出之后,历来存在争议,对该问题的研究也该逐步深入。古今中外许多医家仍旧将其合用来治疗相关疾病,当代研究更是从各种角度寻找其作用机制。另外,体外化学成分研究表明[21],配伍后藜芦定的含量均升高,分析其原因可能为人参皂苷类成分有助溶作用,增加了藜芦定的溶解度而使其含量增加,也可能是化学反应导致相关成分溶出速率增加。但是不得不承认,现有结果仍不能对两者的应用提供任何证明,其扑朔迷离的状态仍然无法解决。古训宜尊古而不可泥古,应持科学态度进行临床验证。代谢组学技术在中药的研究中已取得了一定的成果,但也应看到,当前代谢组学的研究还处于模式识别和生物标记物鉴定层次,应该结合其他学科如蛋白组学、基因组学、转录组学等进行综合的认识与制定标准。相信不久将来,人参和藜芦的应用必将得到科学的阐明,中药十八反作用机制和物质基础的“黑匣子”必将被揭开,从而为中药临床合理用药提供科学的依据。
