金银花种子质量检验方法与分级标准研究△
2019-02-10王书云袁王俊刘亚芳李书敏刘丽君李梦焕李钦
王书云,袁王俊,刘亚芳,李书敏,刘丽君,李梦焕,李钦*
1.河南大学 药学院/河南省高校杜仲工程研究中心,河南 开封 475004;2.哈尔滨医科大学 药化教研室/省部共建生物医药工程重点实验室,黑龙江 哈尔滨 150081
忍冬LonicerajaponicaThunb.是忍冬科Caprifoliaceae忍冬属多年生藤本植物[1],其干燥花蕾或初开的花入药为金银花,有“中药中的抗生素”之称,广泛用于治疗各种疾病,包括关节炎、糖尿病、发热、感染、疼痛和肿胀等,主要化学成分有:有机酸、黄酮、氨基酸、核苷酸和醇类等[2-4]。除药用外,金银花也被广泛应用于食品、化妆品及保健品等行业。
金银花为我国40种常用大宗药材品种之一,种质资源丰富,河南、河北、山东等地均有大量栽培,但习惯认为山东产量最大,而河南品质最佳[5]。金银花一年开3~4茬花,合理的栽培技术对金银花产量有较大影响。目前,金银花种植主要以茎枝扦插为主,扦插繁殖可缩短进入丰产期的年限,但长期使用易致种质退化,而用种子繁育幼苗适应性强、易驯化,对长距离引种及良种选育具有重要应用价值[6]。研究发现金银花种子有较强的休眠特性,自然条件下不经处理发芽率极低[7],限制了种子繁育的生产和规模化应用。课题组前期研究发现金银花种子的休眠机制,并找到快速解除休眠的方法,为种子繁育技术在金银花种植及品种培育中的广泛应用提供可靠依据。
良好的种质资源是种苗繁育的基本保障,但不同来源的金银花种子质量差异悬殊,对金银花种子育苗的广泛应用有很大程度的影响。目前对金银花种子的研究主要集中在种子特性、休眠机制及提高萌发率等方面[7-10],未见种子质量等级研究的相关报道,本课题组收集了全国主产区的20份金银花种子,开展了金银花种子质量检测方法和质量分级标准研究,初步制订了金银花种子的质量分级标准和等级评定方法,为行业或国家标准的制定提供依据。
1 材料
1.1 样品
用于质量检验方法研究的种子,于2017年10月底采自新乡市封丘县东仲宫村金银花GAP种植基地。用于质量标准研究的种子,于2017年10月采自金银花主产区(河南、山东、河北三省8个县),共20份,样品具体信息见表1。所用种子均为采集的全成熟金银花果实经反复揉搓果肉,用水冲洗,纱布过滤,水沉去除漂浮在水面上的种子,剩余种子取出、阴凉处晾干,经河南大学药学院袁王俊副教授鉴定为金银花L.japonicaThunb.的种子。
1.2 仪器
SMZ-161-BLED体式显微镜(麦克奥迪实业集团有限公司),BSA224S电子天平(北京赛多利斯科学仪器有限公司),BPH-9082恒温培养箱(上海一恒科学仪器有限公司),粉碎机(GR150A,合肥荣事达小家电有限公司)。
1.3 种子质量检验方法研究
1.3.1 种子真实性鉴定 随机取适量健康饱满的金银花种子,先肉眼观察种子颜色、形态、大小及表面特征,再用体式显微镜仔细观察其性状特征并拍照记录,并用镜台测微尺测量种子的长、宽、厚度,记录并计算平均值和范围[11]。
1.3.2 扦样 参照《中国农作物种子检验规程》(GB/T 3543.2-1995)“农作物种子检验规程——扦样”,用“四分法”扦取样品。净度分析样品取样量应≥2500粒种子,送检样品量为净度分析样品量的10倍。
1.3.3 净度分析 扦取的样品过18目筛,去除小颗粒杂质及果皮,然后放在净度工作台上,分开净种子、废种子、果皮和果柄、泥沙以及其他杂质,分别称质量,平行重复3次,计算净度,公式如下:
种子净度=净种子/(净种子+废种子+果皮与果柄+泥沙及其他)×100%
(1)
1.3.4 千粒质量测定 按照百粒法、五百粒法和千粒法3种方法来测定种子的质量。Ⅰ百粒法:随机取100粒净种子,称质量,平行重复6次;Ⅱ五百粒法:随机取500粒净种子,称质量,平行重复6次;Ⅲ千粒法:随机取1000粒净种子,称质量,平行重复3次。根据称量结果,计算出标准差及变异系数,测定值的重复间变异系数<4.0%有效。
1.3.5 水分测定 用低温恒温烘干法和高温恒温烘干法2种方法测定种子。随机取4份净种子,每份约2 g,其中2份直接放入洁净干燥的称量瓶中,剩余2份分别粉碎后放入洁净干燥的称量瓶中。分别将称量瓶放置在(105±2)℃(低温恒温烘干法)、(130±2)℃(高温恒温烘干法)恒温烘箱,间隔1 h取出,真空干燥器中冷却至室温后称质量,直至连续2次称质量差不超过0.02 g。测定时样品暴露在空气中的时间应<2 min,称量并记录质量变化,重复3次,含水量计算公式如下:
种子含水量=(烘干前供试样质量-烘干后供试样质量)/烘干前供试样质量×100%
(2)
1.3.6 胚率测定 随机取净种子100粒,于水中浸泡12 h,用解剖刀沿种子脊部两侧的凹沟切开,观察其胚,重复3次,按公式(3)计算。
胚率=有胚种子数/供试种子数×100%
(3)
1.3.7 生活力测定 随机取净种子50粒,于25 ℃浸泡种子6 h,沿胚的中轴线将种子切成两半,用不同浓度的TTC溶液35 ℃避光染色,TTC浓度:0.1%、0.2%、0.3%、0.5%、0.7%,染色后1、2、3、4、5、6、12、24 h,分别记录生活力,以沸水煮过之后种子为空白对照,重复3次,按公式(4)计算。
生活力=有生活力总胚数/供试种子数×100%
(4)
1.3.8 相对电导率测定 随机称取净种子0.5、1.0、1.5 g,分别用蒸馏水和双蒸水冲洗3遍,浸泡在50 mL双蒸水中,于25 ℃恒温箱中,分别测定初始电导率记为:a1,浸泡2、4、8、12、24、32 h时的电导率记为:a2,将种子和浸泡液煮沸30 min后冷却至室温的电导率记为:a3,重复3次,按公式(5)计算相对电导率。
相对电导率=(a2-a1)/(a3-a1)×100%
(5)
1.3.9 发芽试验 随机取净种子100粒,室外沙藏75 d后取出,于25 ℃恒温培养箱中培养,统计种子发芽率,种子以种皮开裂,胚根凸出为萌发标准。
发芽率=20 d内全部发芽种子数/供试种子数×100%
(6)
1.4 种子分级标准研究
依据上述金银花种子质量的检验方法,分别对种子的净度、千粒质量、含水量、胚率、生命活力、相对电导率、发芽率7个指标进行测定。采用SPSS 19.0统计分析软件对测得数据进行相关性分析、主成分分析和K-均值聚类分析。
2 结果与分析
2.1 真实性鉴定
金银花种子近椭圆形或三角状卵形,稍扁,种子长1.7~4.0 mm,宽1.0~3.0 mm,厚0.5~2.0 mm。顶端稍圆,基部稍尖,表面灰褐色或褐色,种皮革制,种子背面中部有凸起的脊,脊两侧有2条明显的凹沟,腹面脊不明显,种脐位于极轴一端(图1)。
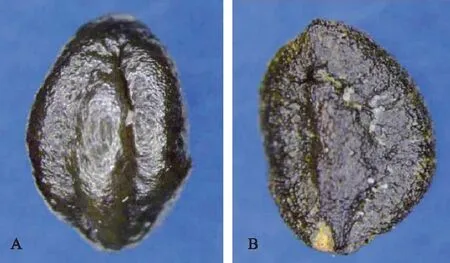
注:A为种子背面;B为种子腹面。图1 体视显微镜下金银花种子表面特征图
2.2 扦样
采用“四分法”扦取金银花种子试样,种子净度分析试验所需试样质量不少于8.4 g(不少于2500粒种子),送检样品质量不少于为84.0 g。
2.3 净度分析
金银花种子净度分析结果见表2,3次平行重复金银花种子的增失差均未偏离原始质量的5%,因此,该方法和程序准确可靠。
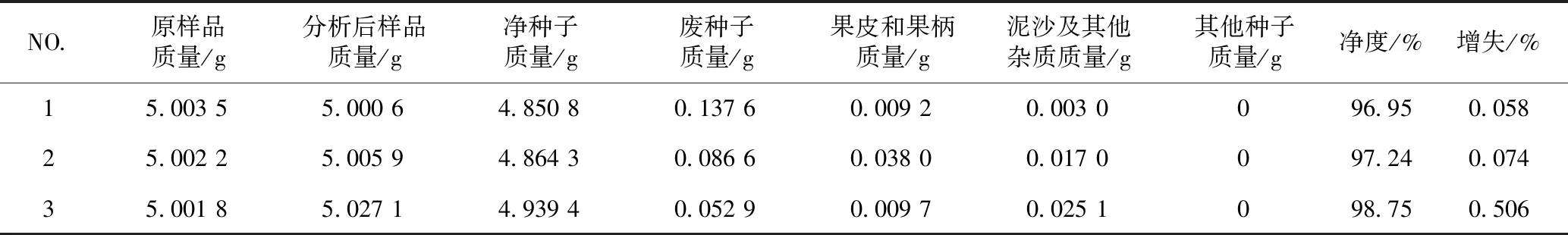
表2 金银花种子净度分析
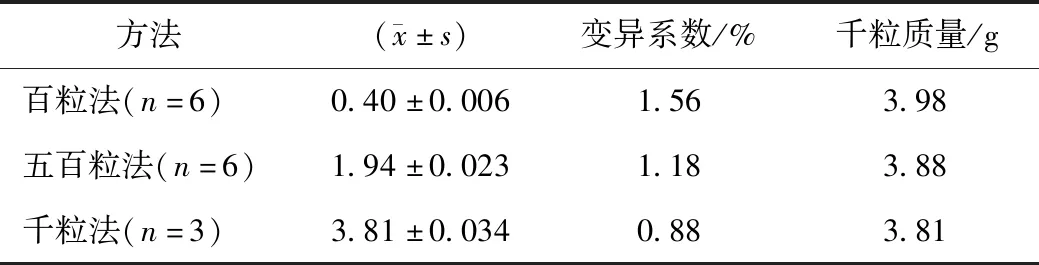
表3 金银花种子千粒质量测定
2.4 千粒质量测定
千粒质量测定结果见表3,百粒法、五百粒法、千粒法变异系数分别为1.56%、1.18%、0.88%,均未超过4.0%,所以百粒法、五百粒法、千粒法均可用于金银花种子的质量测定。为减少实际工作量,以百粒法作为种子千粒质量的测定方法。
2.5 水分测定
不同方法测定的种子水分结果见表4,单因素方差分析结果显示,种子整粒低温恒温(105±2)℃、整粒高温恒温(130±2)℃均在烘干3 h后水分含量无显著变化,粉碎低温恒温(105±2)℃烘干2 h后无显著变化,粉碎高温恒温(130±2)℃烘干1 h后水分含量变化不显著,并且4种方法测定的结果无显著性差异,综合考虑实验操作的便捷性及稳定性,确定以整粒低温恒温(105±2)℃烘干3 h作为金银花种子含水量的测定方法。
2.6 胚率测定
没有胚或胚发育不成熟的种子基本不会萌发,种子的胚率及成熟胚是保证种子萌发的基本条件,因此测定种子胚率对于评定种子的质量来说十分重要。金银花种子胚率测试结果发现,胚率达到91%,基本满足萌发需要。
2.7 TTC染色法测定种子生命活力
2.7.1 生活力鉴定标准 根据TTC染色法的原理与染色结果(见图2),确定种子有无生命活力的标准如下:符合下列染色情况之一的列为有生活力的种子:1)种胚全部为红色,胚顶端颜色偏深的,如图2A;2)胚轴为淡红色,胚顶端或胚两端为深红色,如图2B、2C;3)整体染色较浅,如图2D;符合下列染色情况之一的列为无生活力的种子:1)胚轴为浅粉色,胚顶和胚两端为白色,如图2E;2)胚全部为白色,如图2F。
表4 不同烘干时间金银花种子水分测定
注:不同大写字母表示同一列数据间差异具有统计学意义,不同小写字母表示同一行数据间差异具有统计学意义,下同。
2.7.2 生命活力测定结果 不同TTC浓度、染色时间、(35±1)℃的恒温培养箱中测定的种子生命活力结果见表5。各浓度正常染色5 h后,染色种子数量均无显著增加,用沸水煮过的种子无法正常染色。0.1%、0.2%和0.3% TTC浓度之间染色结果均存在显著性差异,其中0.3% TTC染色效果最好;而0.3%、0.5%、0.7% TTC浓度之间染色结果均无显著性差异,因此,3种染色浓度均可采用。为节约成本,故确定金银花种子生命活力的测定方法:(35±1)℃恒温培养箱中0.3% TTC染色5 h。

表5 不同染色时间TTC染色法测定金银花种子生命活力
2.8 相对电导率测定
种子相对电导率测定结果见表6。结果显示,相对电导率随浸泡时间的增加而增大;0.5、1.0、1.5 g种子浸泡24 h后相对电导率与32 h无显著差异;0.5、1.0、1.5 g种子浸泡24 h的相对电导率变异系数分别为1.80%、1.30%和2.20%。故确定将1.0 g种子在50 mL双蒸水中浸泡24 h后测定相对电导率。
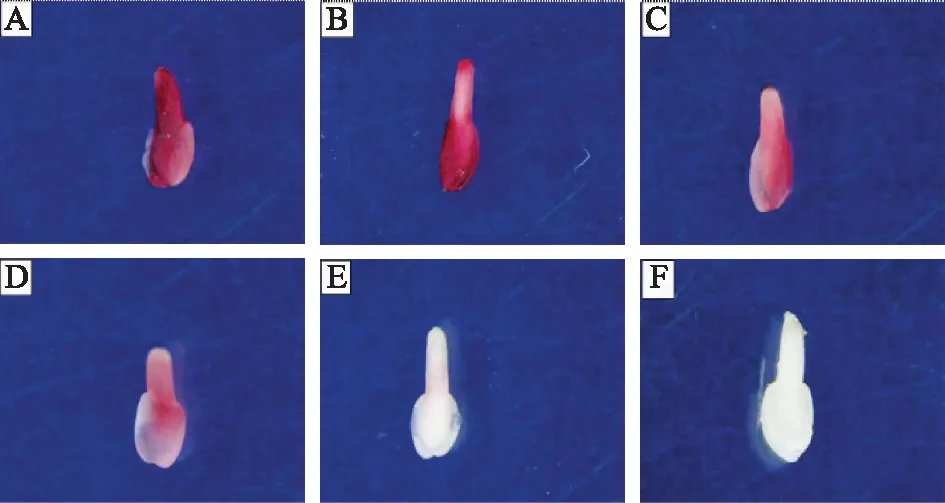
注:A~D.有生命活力的胚;E~F.无生命活力的胚。图2 金银花种胚TTC染色图

表6 不同浸泡时间金银花种子相对电导率测定结果
2.9 发芽试验
课题组前期对金银花种子休眠机制和快速解除休眠方法进行系统研究,本研究采用将种子于4 ℃条件下低温层积75 d后,25 ℃光照恒温培养箱中纸床培养测定萌发率,以种皮开裂,胚根凸出为萌发标准;首次计数为置床后第7天,末次计数为第20 d,以20 d内全部种子发芽数计算萌发率。
2.10 种子质量检验方法
本研究从净度、千粒质量、含水量、胚率、生命活力、相对电导率、发芽率试验7个指标对金银花种子质量进行研究,最终确定适用于金银花种子质量的检验方法,见表7。

表7 金银花种子质量检验方法
2.11 种子分级标准
2.11.1 种子质量检测结果 运用表7所示的金银花种子质量检验方法,测定从主产区收集的20份种子的净度、千粒质量、含水量、胚率、生活力、相对导电率、发芽率7个质量指标,结果见表8。
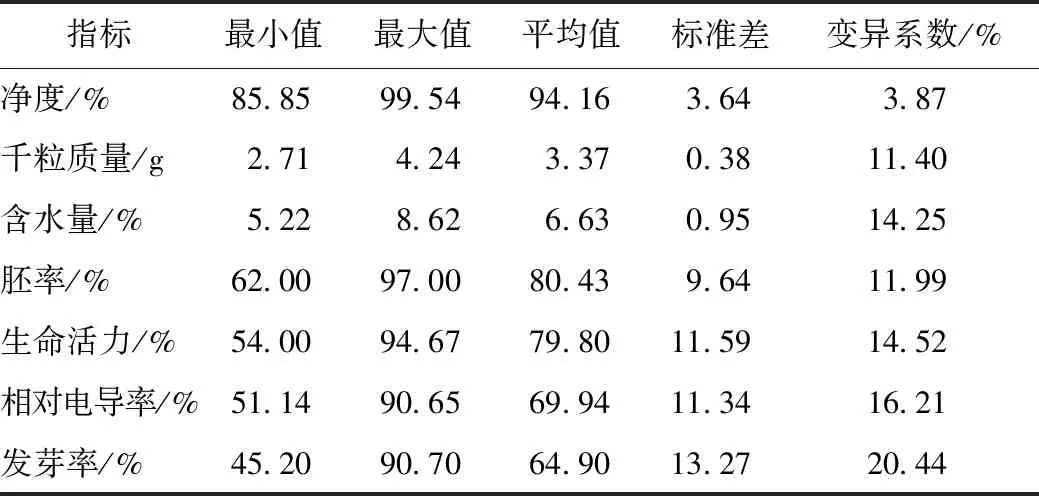
表8 20份不同来源的金银花种子质量分析结果(n=20)
2.11.2 分级指标的确定
2.11.2.1 相关性分析 20份种子质量指标的相关性分析结果见表9。结果显示:胚率与生命活力、相对电导率、发芽率显著相关,r为0.774、-0.435、0.425;发芽率与胚率、生命活力、相对电导率显著相关,r为0.425、0.440、-0.610,故胚率、生命活力和相对电导率均能在一定程度上反应种子的活力,表征种子的发芽潜能,可用于种子质量快速检验。
2.11.2.2 主成分分析 根据20份种子的质量检验结果进行主成分分析,计算出各主成分的特征向量和贡献率,并根据向量的绝对值将不同质量指标划分到不同的主成分之中,结果见表10。主成分因子1、2、3特征值均大于1,累计贡献率达到78.97%,有很强的代表性,因此采用这3个主成分因子对金银花种子质量进行评价。决定第一主成分大小的主要是胚率、生命活力、含水量和发芽率4个指标,其中胚率的特征向量高达0.892,是金银花种子分级的最主要指标。第二主成分大小的决定性因素是相对电导率和千粒质量,其值为0.955。决定第三主成分大小的主要是净度,其值为0.909。在相关性分析和主成分分析结果的基础上,结合生产实践经验和检验的可操作性,拟定净度、千粒质量、含水量、胚率和发芽率5个指标作为质量分级的指标。
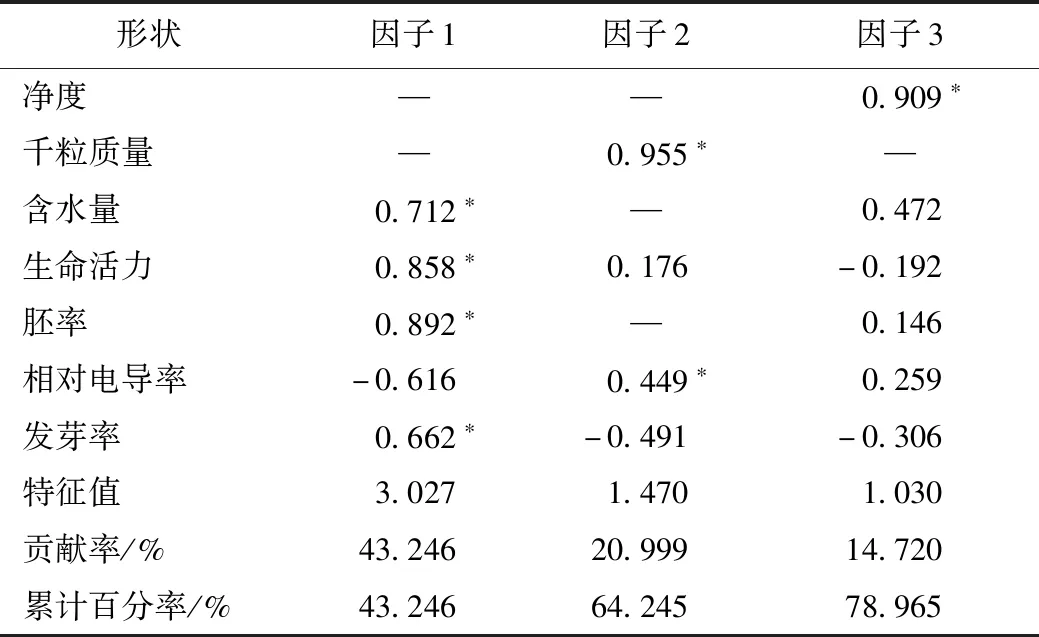
表10 各质量检验指标的特征值及贡献率
注:*指标在各因子中的最大值;—表示指标对该因子基本无影响。
2.11.2 质量分级标准及评定方法 采用SPSS 19.0分析软件对20批金银花种子净度、千粒质量、含水量、胚率和发芽率5个指标进行K-均值聚类分析,将种子质量分为3个等级,其余为不合格。综合指标K聚类分析结果见表11,最终制定的金银花种子质量分级标准见表12。具体等级评定方法如下:根据表12种子净度、千粒质量、含水量、胚率、发芽率和性状特征进行单项指标的定级,Ⅲ级以下定为等外。6项指标均在表12同一质量级别时,直接定级;6项指标有1项在Ⅲ级以下,定为等外;若不在同一级别,按低的级别定级。

表11 综合指标K聚类分析结果
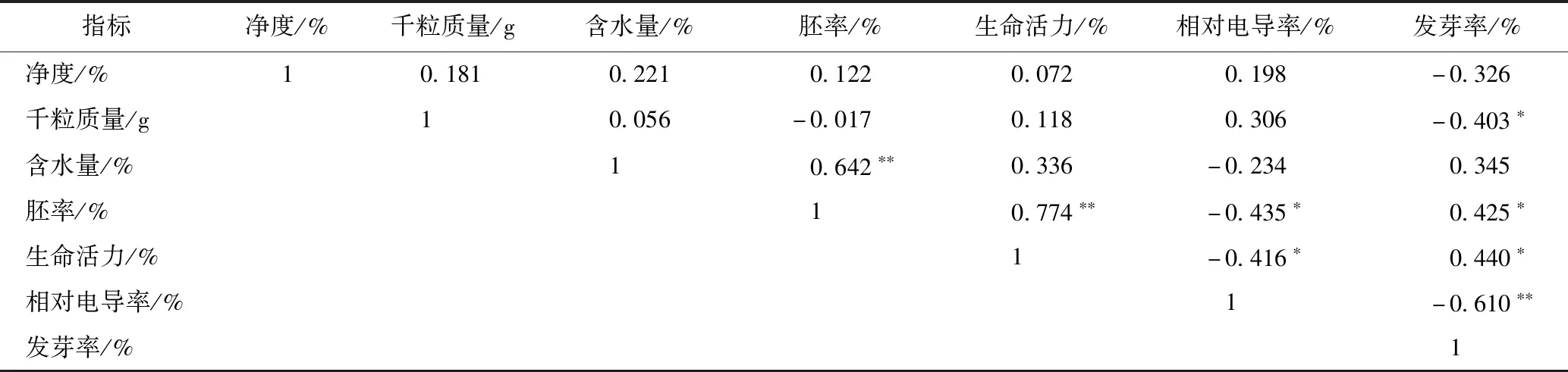
表9 20份不同来源的金银花种子质量检测指标间的相关性分析
注:*P<0.05,**P<0.01。

表12 金银花种子质量分级标准
3 结论与讨论
本课题组开展了金银花种子质量检验方法的研究,并对不同来源的金银花种子质量指标进行检验,通过相关性分析、主成分分析和K-均值聚类分析,确定以净度、千粒质量、含水量、胚率、发芽率和性状特征6项指标初步制定金银花种子质量分级标准和具体等级评定方法。
主成分分析筛选出胚率、生命活力、含水量、发芽率、千粒质量、净度和相对电导率对金银花种子质量影响较大,而我们最终选择了净度、千粒质量、含水量、胚率、发芽率和性状特征作为质量分级的标准。虽然数据分析时未对种子的性状特征进行统计分析,但性状特征是种子交易时最直观的重要参考,因此,最终把性状特征作为种子质量标准的依据之一。发芽率直接反映种子在田间的出苗率,以其为最重要的质量指标与生产需求相符合[12]。本实验中发芽率也是最重要的指标,其特征向量绝对值为0.662。主成分分析支持生命活力作为金银花种子质量的重要依据,本文通过TTC染色法检测种子的生命活力,多数情况下,生命活力与发芽率有高度相关性,但检测结果发现有数份种子生命活力较高,但发芽率不高。金银花种子虽有休眠特性,但种子成熟后通过GA3处理,可解除休眠(课题组前期研究结果),20 d内发芽率就可完成检查,因此,最终选择了直接检测发芽率而放弃生命活力作为金银花种子质量标准的依据。
