大尖囊蝴蝶兰内生真菌和细菌的分离与鉴定
2019-02-10陈耀丽俞龙春宋希强
陈耀丽,俞龙春,钱 悦,宋希强,张 哲,2
(1.海南大学 林学院/热带特色林木花卉遗传与种质创新教育部重点实验室,海口 570228;2.海南耀德农业科技有限公司,海口 570228)
植物体是一个广泛存在着各种生命物质的微生态系统,微生物是其中的重要组成部分,它们分布于植物体内外,种类及数量极为丰富,包括细菌、真菌、放线菌等,对于植物微生态系统平衡的维持起到重要的作用[1]。植物中的内生菌是指其生活史的部分或全部阶段均生活在植物内部,并与植物建立了和谐共生、互利互惠关系的菌类,主要包括真菌和细菌,它们不仅可以促进植物的健康生长,还可控制植物病害的发生和发展,是重要的微生物资源[2]。内生真菌是兰科植物生长发育各个阶段不可或缺的关键因素[3],能够直接参与植物根系甚至整株植物的生理代谢活动,保障植物的生长、个体间的竞争以及病原体的防护,而相应地植物也会为真菌提供光合作用的产物[4-5]。内生细菌也是兰科植物内生微生物的重要组成部分,研究表明内生细菌能够直接促进植物种子萌发、光合形态建成及生长发育[6-7];此外,有些内生细菌是促生细菌(Mycorrhiza helper bacteria),能与菌根真菌特异性结合,刺激菌根真菌的孢子萌发和菌丝生长,能够促进菌根真菌在宿主植物根部的定殖和生长,加强菌根化,从而间接促进植物生长及增强抗逆性[8-9];有些内生细菌还能释放出拮抗物质,可以阻止或减缓病原微生物的入侵,降低病虫害的风险[10-11]。大尖囊蝴蝶兰(Phalaenopsisdeliciosa)为多年生附生草本兰科植物,广泛分布于我国及东南亚的热带地区。笔者以大尖囊蝴蝶兰新鲜营养根为实验材料,对其内生真菌和细菌进行分离与纯化,并通过形态筛选和分子鉴定,旨在分析大尖囊蝴蝶兰内生真菌和细菌的组成及多样性,并探讨这些内生真菌和细菌的开发价值。
1 材料与方法
1.1 试验材料大尖囊蝴蝶兰根部材料于2015年7月采自海南昌江霸王岭国家级自然保护区,随机选择15个健康植株,每株剪取2个长约2 cm的根段,共采集30个根段。装入PE管密封,带回实验室后24 h内进行内生真菌和细菌的分离。
1.2 内生真菌和细菌的分离与纯化内生真菌方面:用自来水清洗干净供试根段表面的污垢及附着物,无菌水冲洗30 s。75%乙醇分别消毒15,30,45和60 s,2%次氯酸钠分别消毒30,60,90和180 s,之后用无菌水冲洗4次。消毒后的根段均匀切成0.3~0.5 cm的小段,接种于配制好的PDA培养基上,28 ℃培养箱恒温培养。将得到的菌株继续使用PDA培养基纯化3次,并于28 ℃黑暗培养。将最后一次冲洗的无菌水涂布于PDA培养基中,做空白对照,用于检测消毒是否彻底。采用斜面低温保存法保存菌株,将纯菌株接种至PDA斜面培养基上,于28 ℃下黑暗培养,待菌落长出,观察无污染后,置于4 ℃的冰箱中保存,用于后续分子鉴定。
内生细菌方面:用自来水清洗干净供试根段表面的污垢及附着物,无菌水冲洗30 s并置于滤纸上晾干。将供试根段切成小段并称取0.1 g,用75%乙醇分别消毒15,30,45和60 s,然后置于2%的次氯酸钠消毒30,60,90和180 s,最后用无菌水冲洗4遍。将根段置于研钵中,加0.9 mL无菌水和适量石英砂,充分研磨后,用移液枪吸取匀浆液,经梯度10-1,10-2,10-3,10-4和10-5g·L-1稀释,取各浓度的浆液各50 μL,滴入配制好的NA培养基,每个处理重复3次。用灭菌后的涂抹棒将NA培养基上的浆液涂抹均匀,28 ℃恒温培养3~5 d。待有菌长出,根据菌落形态均匀、颜色、大小、透明度、边缘整齐度以及菌苔的干湿程度等情况挑取具有代表性的菌落使用NA培养基连续纯化3次。将最后一次冲洗的无菌水涂布于NA培养基中,做空白对照,用于检测消毒是否彻底。本实验中,10-1g·L-1浓度下细菌菌体相互覆盖重叠,不利于挑选细菌;10-5g·L-1浓度下细菌数量较少,因此,选择(10-2~10-4) g·L-1浓度的菌液进行保存处理。采用斜面低温保存法保存菌株,将纯菌株接种至NA斜面培养基上,于28 ℃下黑暗培养,待菌落长出,观察无污染后,放于4 ℃的冰箱中保存,用于后续分子鉴定。
1.3 DNA提取及PCR扩增真菌DNA提取:参考GUO等[12]的改良CTAB法。细菌DNA提取:将纯化的细菌接种到NA液体培养基中摇床培养(180 r·min-1) 1 d,之后使用细菌试剂盒(DP302-02, 北京天根生化科技有限公司)进行基因组DNA提取。
真菌扩增采用的引物为ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)。采用20 μL 的PCR反应体系,包含6 μL ddH2O,各1 μL引物,1 μLTaq酶,1 μL DNA模板和10 μL 2×PCRmix;反应程序:94 ℃预变性5 min,之后35个循环(包括94 ℃变性30 s, 55 ℃复性45 s, 72 ℃延伸1 min),最后72 ℃延伸10 min。
细菌采用16S rDNA通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R (5'-GGTTACCTTGTTACGACTT-3')。采用50 μL PCR反应体系,包含19 μL ddH2O,各2 μL引物,2 μLTaq酶,2 μL DNA模板和25 μL 2×PCRmix;反应程序:94 ℃预变性3 min,之后35个循环(包括94 ℃变性1 min; 55 ℃复性1 min; 72 ℃延伸1.5 min),最后72 ℃延伸10 min。
1.4 PCR产物检测及测序PCR产物检测采用1.6%琼脂糖进行电泳检测,选取条带清晰的PCR产物,委托北京诺赛基因组研究中心有限公司Sanger测序实验室测序。
1.5 数据处理及分析将测序得到的ITS或16s rDNA序列汇总成本地数据库,用QIIME 1.8.0完成序列的预处理和可操作分类单元(Operational taxonomic units, OTUs)的划分及代表序列挑选[13-14]。将OTU代表序列在GenBank中进行在线BLAST(www.ncbi.nlm.nih.gov/BLAST)比对,分别将相似性大于99%,介于95%和99%的序列列为参考种和参考属[15]。采用邻接法(Neighbor-joining method)构建内生真菌的系统发育树[16-17]。空位被编码为丢失数据,Bootstraps值设为1 000。
2 结果与分析
2.1 内生真菌和细菌的分离与纯化最佳表面消毒时间:以对照组是否残余菌落的最低消毒时间为原则,真菌方面使用75%乙醇消毒30 s,之后用2%次氯酸钠消毒90 s为最佳消毒组合(表1)。细菌方面以75%乙醇消毒30 s,2%次氯酸钠浸泡30 s为最佳消毒组合。菌株数量:通过分离纯化培养,共获得代表性内生真菌菌株38株,内生细菌菌株54株。
2.2 内生真菌的分子鉴定38株代表性内生真菌菌株经分子鉴定可划分为5个OTUs (Pd-fun1~Pd-fun5) (表1),隶属于1门2纲4目4科5属,包括球二孢属(Lasiodiplodia)、曲霉属(Aspergillus)、镰刀菌属(Fusarium)、假赤壳属(Pseudocosmospora)和多丝菌属(Setophoma)。其中优势属为球二孢属,占总菌株数的33.33%;次优势属为曲霉属,占26.68% (表1)。代表性内生真菌菌株形态(图1),系统发育树(图2)。
表1 大尖囊蝴蝶兰内生真菌代表性菌株序列的相似性比较
Tab.1 rDNA-ITS sequence similarity between representative strains and reference taxa of the endophytic fungi inPhalaenopsisdeliciosa
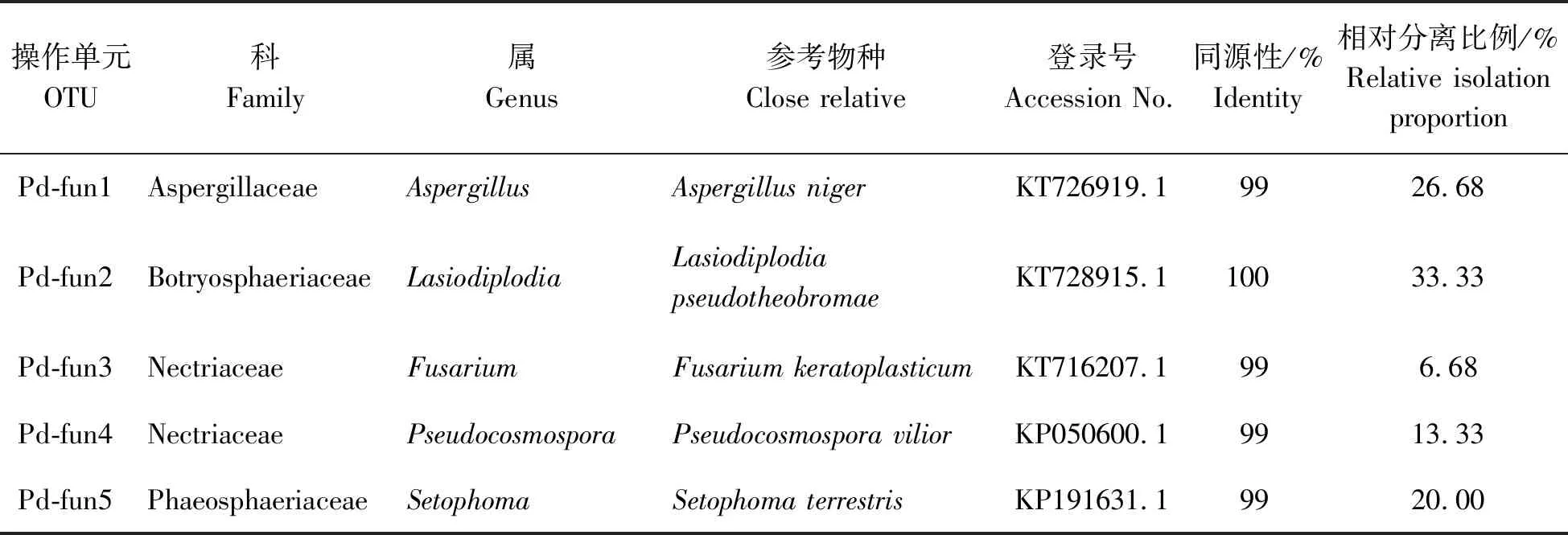
操作单元OTU科Family属Genus参考物种Close relative登录号Accession No.同源性/%Identity相对分离比例/%Relative isolation proportion Pd-fun1AspergillaceaeAspergillusAspergillus nigerKT726919.19926.68Pd-fun2BotryosphaeriaceaeLasiodiplodiaLasiodiplodia pseudotheobromae KT728915.110033.33Pd-fun3NectriaceaeFusariumFusarium keratoplasticumKT716207.1996.68Pd-fun4NectriaceaePseudocosmosporaPseudocosmospora viliorKP050600.19913.33Pd-fun5PhaeosphaeriaceaeSetophomaSetophoma terrestrisKP191631.19920.00
图1 大尖囊蝴蝶兰内生真菌代表菌株的菌株形态
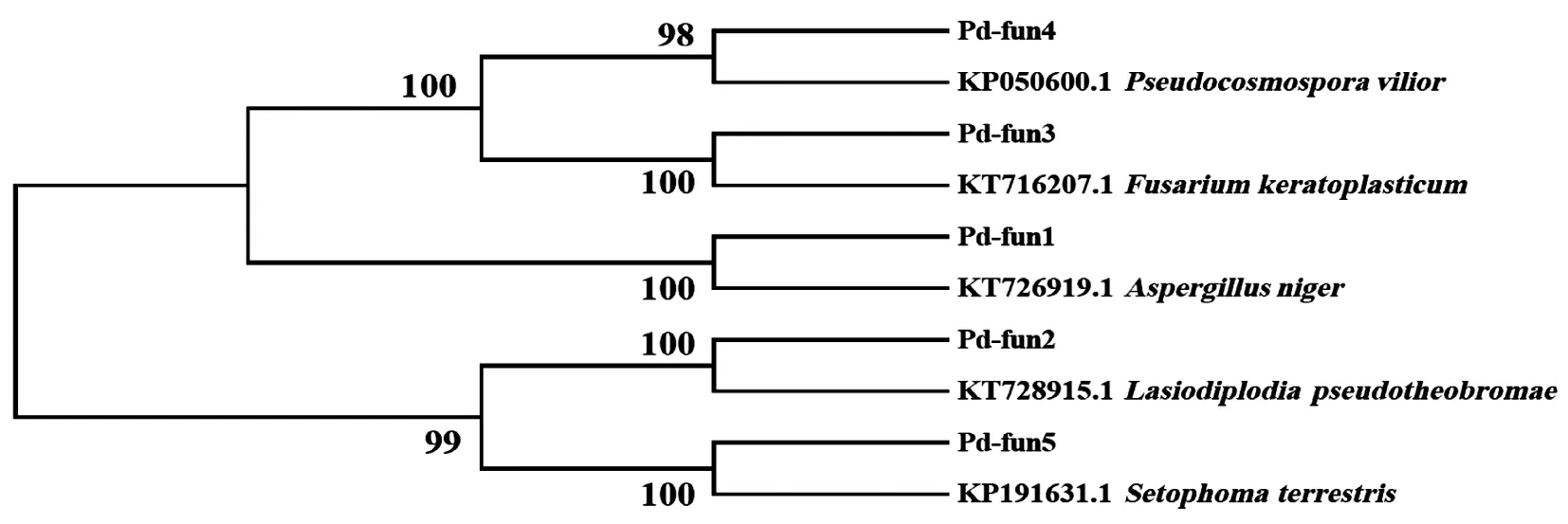
图2 大尖囊蝴蝶兰内生真菌ITS序列的系统发育树
2.3 内生细菌的分子鉴定54株代表性内生细菌菌株经分子鉴定可划分为17个OTUs (Pd-bac1~Pd-bac17) (表2),隶属3门5纲6目9科12个属,分别是无色菌属(Achromobacter)、土壤杆菌属(Agrobacterium)、不动细菌属(Acinetobacter)、芽孢杆菌属(Bacillus)、金黄杆菌属(Chryseobacterium)、肠杆菌属(Enterobacter)、赖氨酸芽孢杆菌属(Lysinibacillus)、类芽孢杆菌属(Paenibacillus)、泛菌属(Pantoea)、沙门氏菌属(Salmonella)、志贺氏菌属(Shigella)和葡萄球菌属(Staphylococcus)。其中优势属为芽孢杆菌属,占总菌株数的24.07%,次优势属为肠杆菌属,占16.67%(表2)。部分代表性内生细菌菌株形态(图3),系统发育树(图4)。
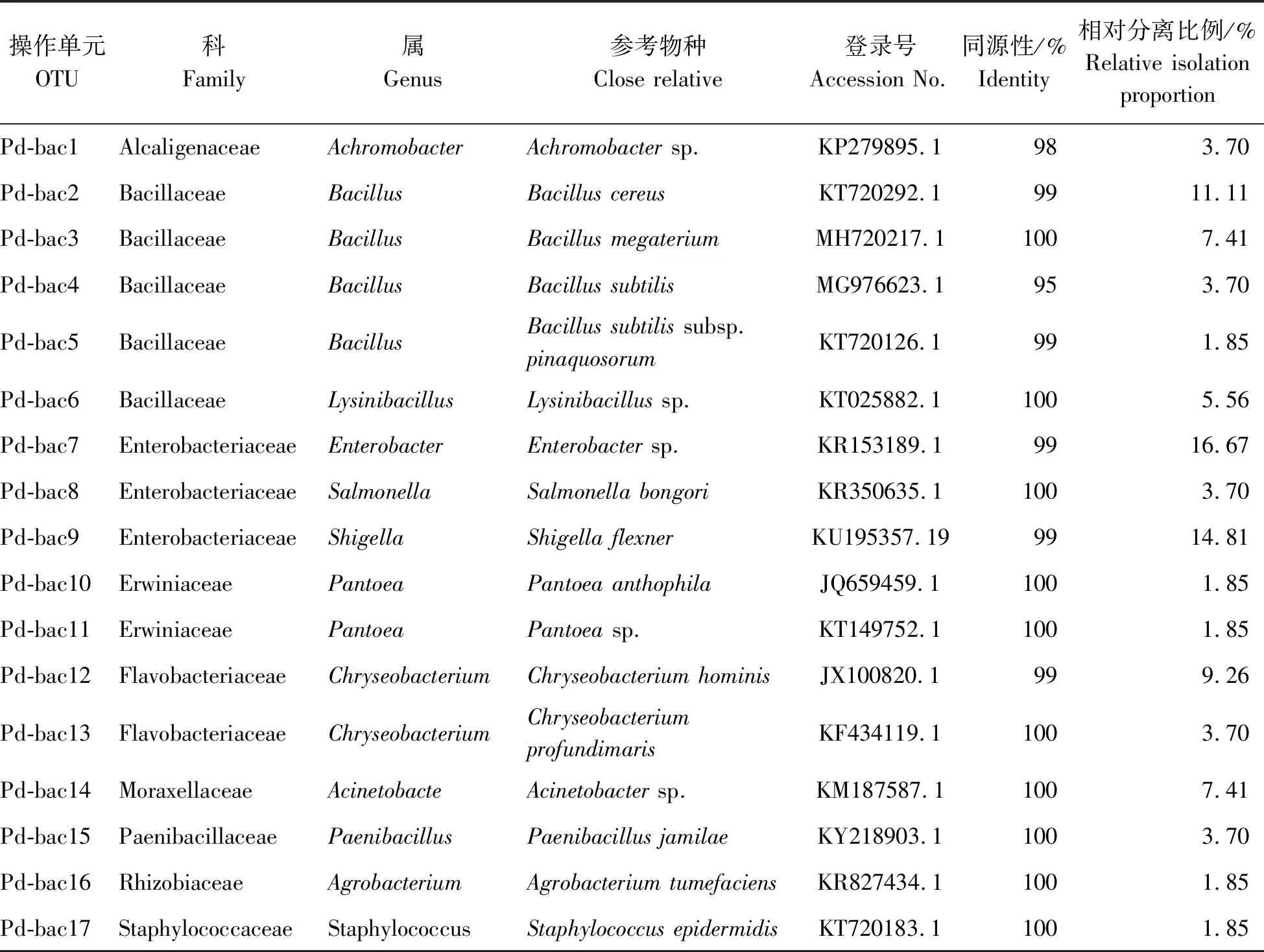
表2 大尖囊蝴蝶兰内生细菌代表性菌株序列相似性比较

图3 大尖囊蝴蝶兰内生细菌的代表菌株形态
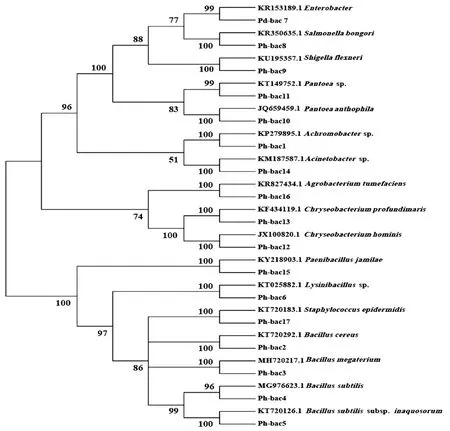
图4 大尖囊蝴蝶兰内生细菌16s rDNA序列的系统发育树
3 讨 论
本研究的大尖囊蝴蝶兰根部内生真菌的分离率较低,与其他研究结果相似,都反映了热带附生兰科植物内生真菌的低侵染率[18]。对很多附生兰科植物而言,菌丝团的分离相当困难,因为其根系并没有被菌根真菌大量侵染[19]。尤其是在热带地区,附生兰科植物中观察到的菌丝团往往很快就会被消解掉[20]。
大尖囊蝴蝶兰内生真菌的5个OTUs均属于子囊菌门(Ascomycetes),其中优势属为球二孢属(Lasiodiplodia)和曲霉属(Aspergillus)。目前研究表明,大部分的兰科植物内生真菌都属于担子菌门(Basidiomycete)和子囊菌门(Ascomycetes)[21]。尽管目前普遍认为兰科植物大都与丝核菌类(Rhizoctonia-like fungi)真菌共生,主要涉及担子菌门的角担菌科(Ceratobasidiaceae)、胶膜菌科(Tulasnellaceae)和蜡壳菌科(Sebacinaceae),这些类群被归为菌根内生真菌[22]。但近年来不断有研究发现担子菌门的其他种类,甚至子囊菌门真菌也可以与兰科植物形成兰科菌根[22]。另外,子囊菌门也是兰科植物中分离频率最高的内生真菌[23]。陈娟等[24]研究了5种药用兰科植物的可培养内生真菌多样性,241株菌株被鉴定属于子囊菌门,仅有10株菌株属于担子菌门。陈娟等[25]、王亚妮[26]发现兰科石斛属(Dendrobium)中分离出的大部分内生真菌同样属于子囊菌门(约占总种类的80%),仅有少数属于担子菌门。柯海丽等[27]从五唇兰(Phalaenopsispulcherrima)根部分离到的内生真菌大部分也属于子囊菌门。
尽管非菌根内生真菌与兰科植物是否存在共生关系还不明确,但有研究表明许多非菌根内生真菌也具备多方面的促生能力,是不可忽视的微生物资源。例如,子囊菌门镰刀菌属的部分种类可刺激兰花种子发芽[28];帅红艳[29]发现镰刀菌对铁皮石斛(Dendrobiumcatenatum)幼苗也具有促生作用;Chen等[30]发现镰刀菌能提高环草石斛(D.loddigesii)的生长速度和生物量。Wang等[31]从华石斛(D.sinense)根部分离到的木霉属(Trichoderma)菌株能够极显著促进华石斛组培苗的生长,能够协助华石斛植株提高矿质营养和内源激素含量,并提高光合性能。本研究从大尖囊蝴蝶兰的根部分离到的镰刀菌属真菌可能极具开发潜力,球二孢属和炭角菌属也是兰科植物中常见的内生真菌,其与兰科植物的关系还需要进一步探索。
兰科植物内生细菌方面的研究也是内生微生物研究的热点问题之一,目前从兰科植物的不同器官(根、茎、叶等)均成功分离到了内生细菌。据不完全统计,这些内生细菌隶属于近60属[32]。本研究的大尖囊蝴蝶兰内生细菌菌株划分为17个OTUs,隶属12个属,其中优势属为其芽孢杆菌属(Bacillus)和肠杆菌属(Enterobacter)。与已报导的兰科物种比较,大尖囊蝴蝶兰内生细菌多样性较高,例如,华石斛根部分离出的内生细菌仅有7个属,优势属是芽孢杆菌属[33];从五唇兰(P.pulcherrima)根部分离的内生细菌有芽孢杆菌属、伯克氏菌属、草酸菌属(Pandoraea)等7个属,其中优势属为芽孢杆菌属[7]。Wilkinson等[34]研究了13种地生兰的内生细菌,结果发现假单胞菌属(Pseudomonas)细菌是最优势属,并认为兰科植物内生细菌的种类和数量会随生境、宿主种类和根龄的不同而变化。此外,还有研究发现,附生兰与地生兰的内生细菌种类有所差异,其中附生兰的基生根与气生根内的细菌种类也不同,而气生根内的细菌更丰富,也更适合细菌的定殖[35]。
内生细菌对兰科植物具有多种多样的促生作用。从杓唇石斛(Dendrobiummoschatum)根部分离的鞘氨醇菌属(Sphingomonas)和分枝菌属(Mycobacterium)细菌可显著提高种子的萌发率[6];芽孢杆菌属细菌则被证明可以防治叶斑病[11]、产IAA[36]、促进种子的萌发和植株生长[7];土壤杆菌属、类芽孢杆菌属、泛菌属和伯克氏菌属等菌种也发现具有促进植株生长的作用[7];念珠蓝细菌属(Nostoc)兼具固氮和光合作用等[37]。因此,从大尖囊蝴蝶兰根部分离到的芽孢杆菌属细菌可能极具开发潜力,假单胞菌属、土壤杆菌属、类芽孢杆菌属、泛菌属和伯克氏菌属等菌种也具一定的研究价值,在今后的工作中,应重点关注这些类群与大尖囊蝴蝶兰的互利共生机理。
致谢:海南霸王岭林业局王进强工程师在野外试验中提供了帮助;海南大学吴文碟、吴姝漪和李静静在微生物分离和纯化方面提供了指导和协助,一并致谢!
