濒危兰科植物DNA条形码鉴定体系的建立与优化
2019-02-10潘英文王安石李佳潼谢添伟陈施明刘福秀林明光
潘英文,张 凌,王安石,李佳潼,谢添伟,陈施明,刘福秀,林明光
(海口海关 热带植物隔离检疫中心,海口 570311)
由于处于非生育期的许多兰科植物种类间形态差别很小,仅凭形态特征较难分类。近年来,遗传标记技术作为一种物种形态学分类鉴定手段被广泛应用于属间、种间、品种间的分类鉴定和亲缘关系的研究中。分子标记RAPD和AFLP技术等主要针对兰属原生种、变种、品种间进行有关亲缘关系、遗传多样性的判断和分析,除兰属外,还涉及了兜兰属、万代兰属等。国外学者利用核糖体ITS序列分析兰花野生种的起源和进化趋势,国内学者也利用RAPD技术对春兰等我国传统兰花品种进行遗传变异和亲缘关系的研究[1-2]。杨光穗等[3]利用SRAP分子标记技术对8种海南野生兰属植物的遗传多样性和亲缘关系进行分析。ISSR体系也初步用于研究蝴蝶兰的亲缘关系,在石斛属植物品种鉴定研究中也应用了分子标记技术,但仅仅用于亲缘关系的分析,还达不到物种检测鉴定的技术要求。目前,兰科植物大多采用DNA条形码方法如atpF-atpH,rbcL,rpoB,rpoC1,psbA-trnH,matK和核糖体ITS等序列来加以鉴定[4-11],但缺乏系统性的研究。越来越多的研究结果表明,靠1个片段很难对所有的植物物种进行准确鉴定,针对特定品种采用多个不同的基因片段进行综合分析鉴定将是今后的主要研究方向。因此,笔者通过对现有序列和数据的比对分析,从前人研究系统发育的序列中选择适当片段,并加以组合,同时开发新的基因片段,旨在建立濒危兰科植物DNA条形码的鉴定体系,为鉴定濒危兰科植物提供新的方法。
1 材料与方法
1.1 材料供试材料来自海口海关热带植物隔离检疫中心种质资源圃保存的濒危兰科植物,分别是金钗石斛Dendrobiumnobile,卷萼兜兰Paphiopedilumappletonianum,春兰Cymbidiumgoeringiivar.goeringii,矮万代Vandapumila,云南火焰兰Renantheraimschootiana,小兰屿蝴蝶兰Phalaenopsisequestris,短序脆兰Acampepapillosa,香花指甲兰Aeridesodorata,金线兰Anoectochilusroxburghii,广东石豆兰Bulbophyllumkwangtungense,三褶虾脊兰Calanthetriplicata,牛角兰Ceratostylishainanensis,短序隔距兰Cleisostomastriatum,流苏贝母兰Coelogynefimbriata,扇脉杓兰Cypripediumjaponicum和节茎石仙桃Pholidotaarticulata。选取植株叶片为材料,每植株采集2~3片叶,放入已编号的封口袋中并立即拿回实验室放入-70 ℃冰箱内贮存。引物由北京六合华大基因科技有限公司合成。
1.2 DNA提取方法采用改良CTAB法[12]提取DNA。使用Thermo Nanodrop 2000核酸分析仪测定提取的DNA样品230,260,280 nm处的光吸收值,根据OD260/OD280和OD260/OD230的比值确定DNA纯度。取5 μL样品DNA加上Loading buffer后,使用w=1%琼脂糖凝胶,在0.5×TBE缓冲液中,3 V·cm-1恒压电泳1~2 h(Power PAC3000电泳仪,BIO-RAD)。根据电泳结果检测DNA质量。
1.3 引物设计根据已知兰科植物的ITS,matK和psbA-trnH序列,利用其保守位点和变异位点,用 Primer Premier 5软件,设计兰科植物的通用引物序列,引物序列见表1。

表1 PCR反应引物序列
1.4 PCR反应体系优化PCR反应体系:10 μL 2×PrimeStar Max premix( TaKaRa), 0.4 μmol·L-1引物, 6~10 mg·L-1模板DNA, 用ddH2O补充至20 μL。反应程序:94 ℃预变性8 min; 94 ℃变性45 s,48~58 ℃(温度变化梯度2 ℃)退火45 s,72 ℃延伸1 min,35个循环; 72 ℃延伸6 min,4 ℃保存。扩增产物用w=1%琼脂糖凝胶电泳检测,以DL2000 marker ( TaKaRa) 为参照,凝胶成像系统下观察并拍照。
2 结果与分析
2.1 PCR反应体系优化从图1可知,ITS序列PCR扩增退火温度为54 ℃时,扩增条带清晰,亮度较高,稳定性好。从图2~3可知,matK和psbA-trnH序列PCR扩增退火温度为50 ℃时,扩增条带清晰,亮度较高,稳定性好。退火温度过低时,非特异结合增加,容易产生弥散状背景,降低测序效率。但过高时,引物与模板又不易结合,PCR 反应效率降低,目标条带亮度降低。
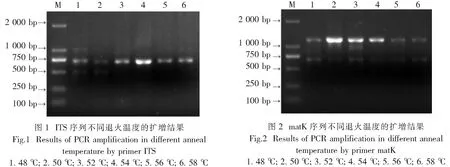

2.2 PCR扩增和检测从图4~6可知,使用优化后的PCR反应体系对兰科16个代表属的ITS,matK和psbA-trnH序列进行扩增,扩增条带清晰,亮度较高,稳定性好,均获得理想带型。PCR 扩增效率和测序效率均较高,除ITS 的测序效率为98.7%,其他片段的扩增和测序效率均为100%。片段长度方面,psbA-trnH的长度最短,为624~641bp,其次是ITS,为716~735 bp,matK 最长,为1 195~1 220 bp。该反应体系稳定可靠,能满足DNA条形码检测鉴定的实验要求。
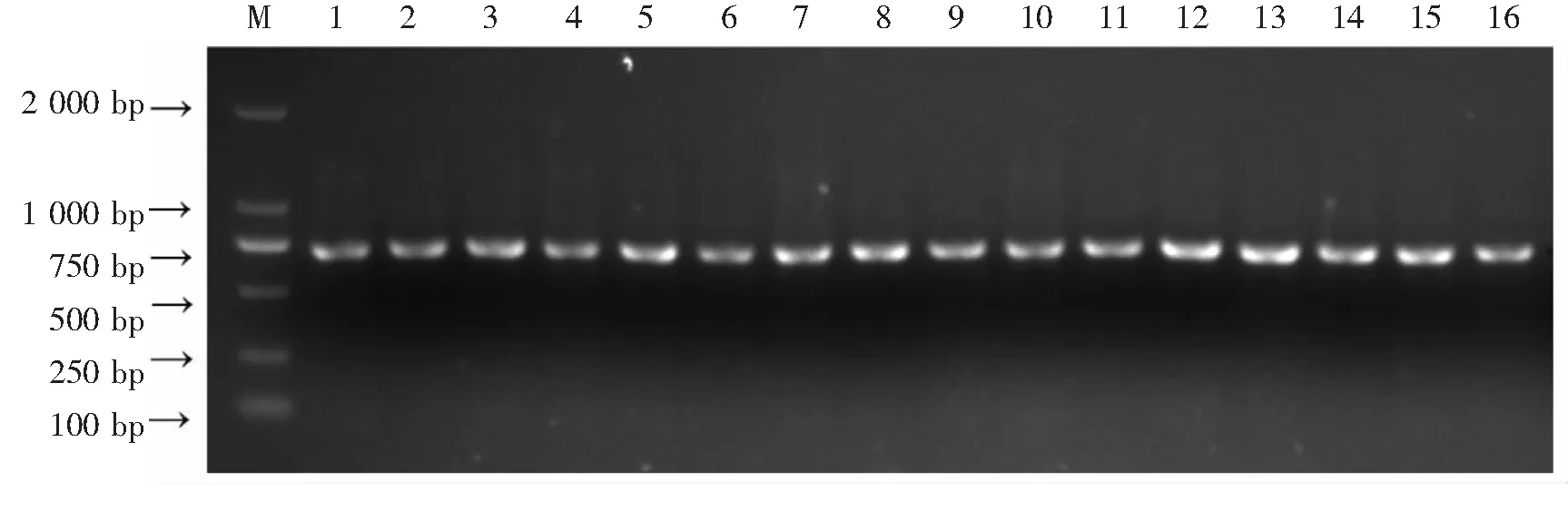
图4 ITS引物的PCR扩增结果
1.金钗石斛;2卷萼兜兰;3.春兰;4.矮万代;5.云南火焰兰;6.小兰屿蝴蝶兰;7.短序脆兰;8.香花指甲兰;9. 金线兰;10. 广东石豆兰;11. 三褶虾脊兰;12. 牛角兰;13. 短序隔距兰;14. 流苏贝母兰;15. 扇脉杓兰;16. 节茎石仙桃
Fig.4 Results of PCR amplification by primer ITS
1.Dendrobiumnobile; 2.Paphiopedilumappletonianum; 3.Cymbidiumgoeringiivar.goeringii;4.Vandapumila; 5.Renantheraimschootiana; 6.Phalaenopsisequestris; 7.Acampepapillosa; 8.Aeridesodorata; 9.Anoectochilusroxburghii; 10.Bulbophyllumkwangtungense; 11.Calanthetriplicata; 12.Ceratostylishainanensis; 13.Cleisostomastriatum; 14.Coelogynefimbriata; 15.Cypripediumjaponicum; 16.Pholidotaarticulata

图5 matK引物的PCR扩增结果
1.金钗石斛;2卷萼兜兰;3.春兰;4.矮万代;5.云南火焰兰;6.小兰屿蝴蝶兰;7.短序脆兰;8.香花指甲兰;9. 金线兰;10. 广东石豆兰;11. 三褶虾脊兰;12. 牛角兰;13. 短序隔距兰;14. 流苏贝母兰;15. 扇脉杓兰;16. 节茎石仙桃
Fig.5 Results of PCR amplification by primer matK
1.Dendrobiumnobile; 2.Paphiopedilumappletonianum; 3.Cymbidiumgoeringiivar.goeringii;4.Vandapumila; 5.Renantheraimschootiana; 6.Phalaenopsisequestris; 7.Acampepapillosa; 8.Aeridesodorata; 9.Anoectochilusroxburghii;10.Bulbophyllumkwangtungense;11.Calanthetriplicata; 12.Ceratostylishainanensis; 13.Cleisostomastriatum; 14.Coelogynefimbriata; 15.Cypripediumjaponicum; 16.Pholidotaarticulata

图6 psbA-trnH引物的PCR扩增结果
1.金钗石斛;2卷萼兜兰;3.春兰;4.矮万代;5.云南火焰兰;6.小兰屿蝴蝶兰;7.短序脆兰;8.香花指甲兰;9. 金线兰;10. 广东石豆兰;11. 三褶虾脊兰;12. 牛角兰;13. 短序隔距兰;14. 流苏贝母兰;15. 扇脉杓兰;16. 节茎石仙桃
Fig.6 Results of PCR amplification by primer psbA-trnH
1.Dendrobiumnobile; 2.Paphiopedilumappletonianum; 3.Cymbidiumgoeringiivar.goeringii;4.Vandapumila; 5.Renantheraimschootiana; 6.Phalaenopsisequestris; 7.Acampepapillosa; 8.Aeridesodorata; 9.Anoectochilusroxburghii; 10.Bulbophyllumkwangtungense; 11.Calanthetriplicata; 12.Ceratostylishainanensis; 13.Cleisostomastriatum; 14.Coelogynefimbriata; 15.Cypripediumjaponicum; 16.Pholidotaarticulata
3 讨 论
扩增成功率是DNA条形码应用的主要限制因素,兰科植物中间变异类型极其丰富,容易受到反应条件变化的影响,增加了兰科植物种内和种间遗传距离的重叠程度,导致其识别效率和扩增成功率下降,因此,对其PCR反应条件进行摸索和优化十分必要。引物的优劣直接关系到 PCR扩增的特异性及成功与否,退火温度是影响PCR 反应的关键因素,退火温度的高低对DNA条形码鉴定基因序列扩增的带型和背景深浅有明显的影响。本实验采用国际上通用的兰科植物DNA条形码基因ITS,matK和psbA-trnH序列的变异位点和保守位点设计引物,并利用它对兰科16个代表属的DNA条形码鉴定体系进行优化,取得了较好的效果。DNA 条形码技术在实际应用中尚存在许多问题需要解决,包括DNA条形码基因的选择以及种内和种间变异范围界定。目前,还未见任何一个单一序列能完全鉴别出不同类型的兰科植物。在本实验的反应体系和条件下获得的目的条带清晰、明亮,可作为鉴别濒危兰科植物物种的DNA 条形码组合。
