NOC2L基因重组慢病毒表达载体的构建及其在293T细胞中的表达
2019-02-07易雪丽陆飞燕陈晓颖曾怡
易雪丽 陆飞燕 陈晓颖 曾怡


【摘要】目的 构建NOC2L基因重组慢病毒并使其在293T细胞中表达。方法 通过设计引物及PCR扩增获得NOC2L全基因片段,将 pCDH-GFP载体分别用XbaⅠ和BamHⅠ双酶切制备线性化载体;NOC2L全基因片段和线性化载体经切胶回收后,通过同源重组反应将NOC2L全基因片段连接到线性化的pCDH-GFP载体上,构建pCDH-NOC2L-GFP慢病毒表达载体;通过菌落PCR、质粒双酶切、测序等方法对构建的NOC2L基因重组慢病毒表达载体进行鉴定,利用构建的pCDH-NOC2L-GFP包装NOC2L慢病毒并使用该慢病毒感染293T细胞。结果 菌落PCR、质粒双酶切和测序结果显示成功将NOC2L基因连接到pCDH-GFP载体上,使用构建成功的pCDH-NOC2L-GFP转染293T细胞,能够成功转染及包装NOC2L基因重组慢病毒,同时包装好的NOC2L基因重组慢病毒能够成功感染293T细胞并过表达293T细胞中的NOC2L基因。
结论 采用本研究方法能成功构建 NOC2L基因重组慢病毒表达载体。
【关键词】NOC2L;NIR;慢病毒表达载体
中图分类号:R373 文献标志码:A DOI:10.3969/j.issn.1003-1383.2019.12.003
【Abstract】Objective To construct recombinant lentivirus expressing NOC2L gene,and to analyze its expression in 293T cells.
Methods The full-length NOC2L gene was obtained by PCR amplification from human cDNA library.The pCDH-GFP plasmid was digested with XbaⅠ and BamHⅠ to generate a linearized vector.After the NOC2L full-length gene fragment and the linearized vector were purified by gel extraction,the NOC2L full-length gene fragment was ligated into the linearized pCDH-GFP vector by homologous recombination.Positive clones of the recombinant pCDH-NOC2L-GFP lentivirus expression plasmid were identified by double restriction enzyme digestion and Sanger sequencing.The NOC2L lentivirus was packaged with the constructed pCDH-NOC2L-GFP plasmid and the 293T cells were infected with the NOC2L lentivirus subsequently.
Results Colony PCR,double restriction enzyme digestion and sequencing results showed that the NOC2L gene was successfully cloned into the pCDH-GFP vector.The recombinant pCDH-NOC2L-GFP plasmid was successfully transfected into 293T cells,and the NOC2L recombinant lentivirus was also successfully packaged.Meanwhile,the NOC2L recombinant lentivirus can successfully infect 293T cells and overexpress the NOC2L gene.
Conclusion The NOC2L recombinant lentivirus expression vector was successfully constructed by this method.
【Key words】NOC2L;NIR;lentivirus expression vector
NOC2L有6个转录物,94个直向同源物,是一个核仁相关的转录抑制因子。其编码的NIR蛋白是一种新的组蛋白乙酰转移酶抑制剂(INHAT)。组蛋白的乙酰化和去乙酰化在真核细胞的基因表达调控中起着关键作用,组蛋白乙酰转移酶(histone acetyltransferase,HAT)和 组 蛋 白 去 乙 酰 化 酶(histone deacetylase,HDAC)可以影响组蛋白的乙酰化[1]。NIR直接与核小体和核心组蛋白结合,防止HAT的乙酰化,从而起到INHAT的作用,且这一作用不被HDAC抑制剂阻断。p53作为其相互作用的配偶体,NIR通过与p53结合来调节p53的转录活性,抑制p53下游基因的转录[2]。进一步研究结果显示,有丝分裂激酶B(Aurora B)作为NIR的另一种相互作用的配偶体,能与NIR直接结合,形成一个含有Aurora B、NIR和p53的蛋白质复合物。Aurora B通过NIR间接地与p53结合,促进Aurora B介导的p53在DBD的多个位点磷酸化,从而抑制p53的转录活性[3]。除了p53之外,NIR还可以与TAp63相结合,进而抑制TAp63的转录活性[4]。NOC2L与其他的INHAT一样,在正常细胞的生长、增殖和分化中发挥重要作用。Titus等人研究了NOC2L甲基化与乳腺癌的关系,结果显示在Her2、LumA和LumB亚型的乳腺肿瘤中,NOC2L基因高甲基化,在基底样乳腺肿瘤中低甲基化[5]。而有关研究显示NOC2L可能為胰腺癌的易感基因[6]。因此我们期望能通过构建NOC2L基因重组慢病毒表达载体,为进一步研究NOC2L基因与各种肿瘤发生相关机制奠定基础。
1 材料与方法
1.1 试剂及仪器
pCDH-GFP质粒载体、包装质粒psPAX2和包膜质粒pMD2.G为南京医科大学卢春教授惠赠。293T细胞株为本实验室保存,PCR引物由Takara生物公司合成,PCR试剂盒、DL 15 000 DNA Marker、DL 10 000 DNA Marker、DNA切胶回收试剂盒、real-time PCR (qPCR)试剂盒购自Takara生物公司,限制性内切酶购自NEB公司,EasyGeno重组试剂盒、DH5α感受态细胞、质粒小量提取试剂盒购自北京天根生化科技有限公司,DMEM培养基、胎牛血清、胰酶、lipofectamine2000购自赛默飞世尔科技(中国)有限公司。研究中主要使用下列仪器:5424R高速冷冻离心机(德国Eppendorf公司),PTC-200 PCR仪(美国Bio-Rad公司),DYY-6C 电泳仪(北京市六一仪器厂),NanophtoometerP360超微量分光光度计(美国IMPLEN公司),XRS凝胶成像系统(美国Bio-Rad公司)。
1.2 方法
1.2.1 NOC2L基因片段制备
根据GenBank基因库中登记的NOC2L基因序列设计PCR引物,引物序列如下:
上游引物:ATGGCAGCTGCGGGGAGCCGCAAGAG
下游引物:TCAACACAATGGCCCTGCCTCCCAC
以人全基因组cDNA为模板进行扩增,得到NOC2L基因全长片段。50 μL反应体系如下:模板1 μL,Taq 0.5 μL,2×GC Buffer 25 μL,dNTP Mix 8 μL,上游引物 0.5 μL,下游引物0.5 μL,ddH2O补足50 μL。反应条件如下:94℃预变性3 min,94℃变性30 s,60℃退火30 s,72℃延伸150 s,72℃加长延伸5 min,-20℃保存备用。
以NOC2L基因序列及pCDH-GFP载体序列设计PCR引物,在NOC2L基因片段5端和3端分别加入与线性化载体两端重叠的序列,引物序列如下:
上游引物:CCTCCATAGAAGATTCTAGAGCCACCATGGCAGCTGCGGGGAGCCGCAAGAGGCGCCTGGCGGAGCTGACGGTG
下游引物: TCCTTCGCGGCCGCGGATCCTCACGTAGAATCGAGACCGAGGAGAGGGTTAGGGATAGGCTTACCGTCGTCCTCTGAGAGCTGC
以前述获得的NOC2L全基因PCR扩增产物为模板进行扩增,使扩增的NOC2L基因片段上下游分别带有与线性化载体两端互补的序列,反应体系及条件同前述。扩增产物用DNA切胶回收试剂盒按说明书回收并纯化凝胶产物,并用紫外分光光度计进行浓度的测定。-20℃保存备用。
1.2.2 线性化载体制备
用限制性内切酶XbaⅠ和BamHⅠ对pCDH-GFP质粒载体进行双酶切。双酶切反应体系如下:载体1 μg,XbaⅠ1 μL,BamHⅠ1 μL,Cutsmart buffer 5 μL,以ddH2O补足50 μL。反应条件如下:双酶切体系37℃ 15 min后再65℃ 20 min使酶失活。双酶切产物用DNA切胶回收试剂盒按说明书回收并纯化凝胶产物,并用紫外分光光度计进行浓度的测定。-20℃保存备用。
1.2.3 同源重组
将线性化的载体及插入片段进行同源重组。10 μL重组反应体系如下:线性化载体0.01 pmol,插入片段0.05 pmol,2×EasyGeno Assembly Mix 5 μL,以ddH2O补足至10 μL。重组反应体系如下:50℃反应15 min,冰上冷却5 min。取5 μL上述重组反应产物加入50 μL DH5α感受态细胞后冰浴30 min;42℃热激90 s后冰浴150 s;加入350 μL LB液体培养基37℃180 rpm摇45 min;从中取100 μL接种于含氨苄青霉素的LB固体培养基筛选阳性克隆;从培养16 h的平板上挑取单菌落接入4 mL含氨苄青霉素的LB液体培养基中180 rpm、37℃震荡培养1 h;取1 μL培养液为模板进行菌落PCR鉴定;鉴定使用引物及反应体系均同1.2.1;菌落PCR结果为阳性克隆的继续180 rpm、37℃震荡培养16 h后按照质粒小量提取试剂盒说明书进行质粒提取。将提取质粒按照1.2.2经双酶切鉴定阳性后,送广州艾基生物有限公司进行测序验证。
1.2.4 NOC2L慢病毒包装
将构建的pCDH-NOC2L-GFP与包装质粒psPAX2和包膜质粒pMD2.G利用Lipofectamine 2000共转染293T细胞,同时将pCDH-GFP与包装质粒psPAX2和包膜质粒pMD2.G利用Lipofectamine 2000共转染293T细胞作为阴性对照。转染8 h后将无血清DMEN更换为完全培养基,分别于48 h和72 h观察荧光蛋白GFP表达情况,同时48 h和72 h分别收取上清,混合后离心吸取上层上清用0.45 μm滤器进行过濾,所得滤液即为包装好的NOC2L病毒液,-80℃保存备用。
1.2.5 NOC2L慢病毒感染293T细胞
把293T细胞按照1×105个细胞/孔接种入6孔板中,37℃培养24 h。将包装好的NOC2L慢病毒及阴性对照慢病毒置于冰上融化。6孔板中的293T细胞吸弃上清后,取200 μL完全融化的慢病毒加入到6孔板中,加入无血清DMEM补足2 mL培养体积。培养8 h后将含有慢病毒的无血清培养基更换为完全培养基。继续培养至96 h后观察荧光蛋白GFP表达情况,同时收集细胞提取RNA反转录为cDNA后使用qPCR检测NOC2L表达情况。
1.3 统计学方法
采用SPSS 18.0软件进行统计学分析,计量资料符合正态分布,采用相对表达量2-△△Ct法比较基因的表达差异。组间比较采用两独立样本t检验,检验水准α=0.05,双侧检验。
2 结 果
2.1 NOC2L基因片段制备
以人全基因组cDNA为模板进行扩增后,进行1%琼脂糖凝胶电泳,在约2800 bp处出现条带,与预期目的条带位置相符,电泳结果见图1。以该NOC2L全基因组片段为模板进行扩增,进行1%琼脂糖凝胶电泳,在约2800 bp处出现条带,产物经切胶回收后,获得30 μL浓度为23.30 ng/μL的插入片段。
2.2 线性化载体制备
对pCDH-GFP质粒进行双酶切后,进行1%琼脂糖凝胶电泳,在约7500 bp处出现条带,电泳结果见图2。双酶切产物经切胶回收后,获得30 μL浓度为24.20 ng/μL的线性化载体。
2.3 同源重组
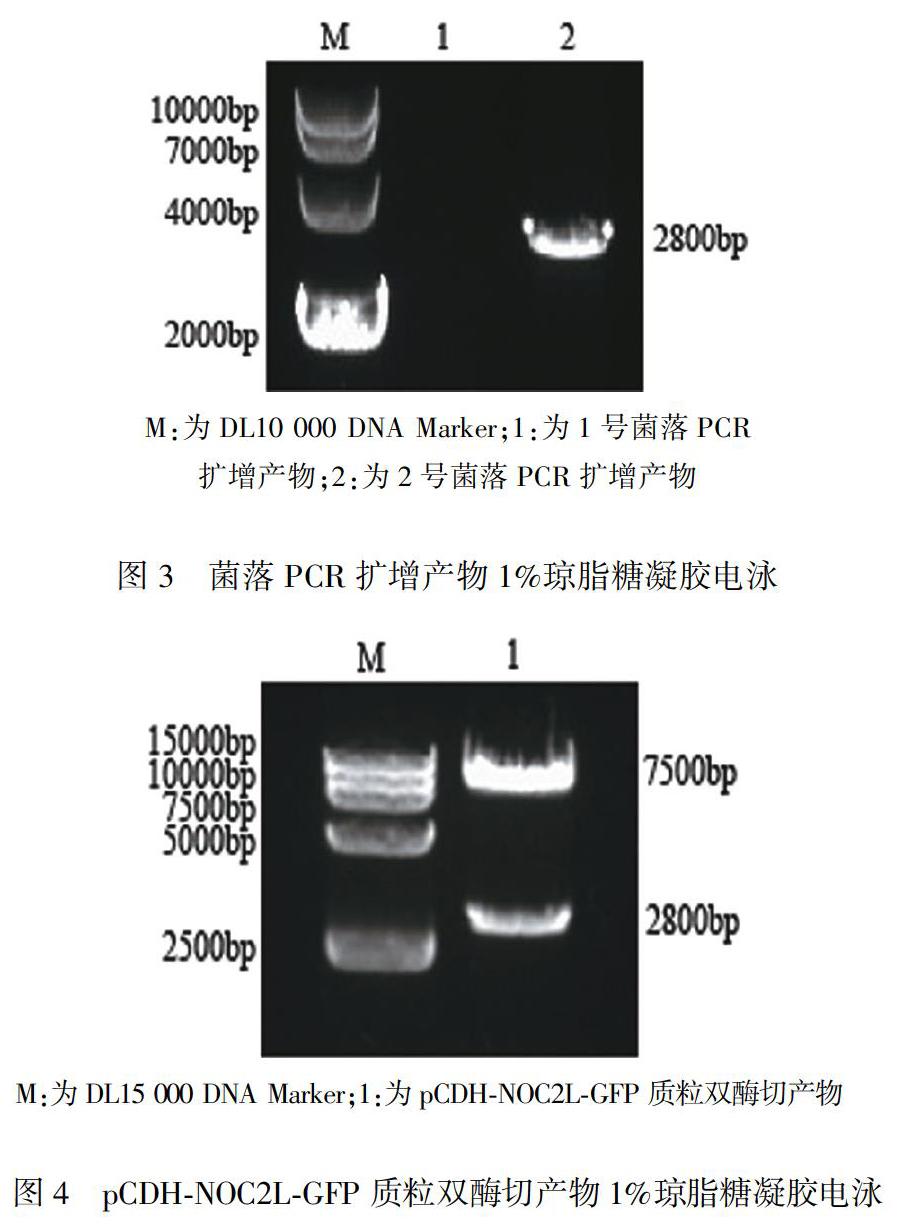
将NOC2L基因片段及线性化载体进行同源重组后,转化DH5α感受态细胞,接种至含氨苄青霉素的LB固体培养基筛选阳性克隆。过夜培养后平板上有2个菌落生长,分别挑取单个菌落摇菌后进行菌落PCR验证,1%琼脂糖凝胶电泳显示只有1个菌落在约2800 bp处出现目的条带,电泳图结果见图3。取菌落PCR阳性菌液继续培养后进行质粒小量提取,将提取质粒进行双酶切验证,1%琼脂糖凝胶电泳显示在2800 bp及7500 bp处分别出现条带,电泳图结果见图4。送菌落PCR及双酶切鉴定均为阳性的克隆质粒到广州艾基生物有限公司进行测序,结果回报显示,重组的pCDH-NOC2L-GFP中的NOC2L序列与GenBank中登记的NOC2L基因100%同源。
2.4 NOC2L慢病毒包装
转染48 h后pCDH-NOC2L-GFP组及pCDH-GFP组均可看到荧光蛋白GFP表达,荧光视野及明场视野对比图见图5。
2.5 NOC2L慢病毒感染293T细胞
感染96 h后pCDH-NOC2L-GFP组及pCDH-GFP组均可看到荧光蛋白GFP表达。提取RNA反转录为cDNA后使用qPCR检测NOC2L表达,检测结果显示两组间差异有统计学意义(P<0.001),pCDH-NOC2L-GFP组相对于pCDH-GFP组NOC2L上调。见表1。
3 讨 论
NOC2L除了作为INHAT发挥作用外,还有研究证实其是皮肤发育的关键调节因子,其编码的NIR调节表皮发育中的角蛋白、整联蛋白和层粘连蛋白等必需因子的表达[7]。p63基因是p53家族成员之一,与p53有高度的同源性,是一种序列特异性转录因子,可调节上皮干细胞维持和上皮分化。p63可以编码具有反式激活域、氨基端全长的TAp63亚型和氨基端截短的ΔNp63亚型[8~9]。研究显示,NIR的中心部分可以与TAp63的反式激活结构域和C末端寡聚化结构域结合,抑制其乙酰化[4]。NIR主要定位于细胞核中,称为Noc2p,参与60S核糖体亚基的成熟,在不同的人类细胞系中普遍表达,主要是通过影响p53的修饰而不是影响p53的蛋白水平起作用[10]。p53是一种调节各种重要生物过程的转录因子,包括细胞凋亡、细胞周期停滞和衰老。p53可分为野生型p53与突变型p53,当野生型p53转变为突变型p53时,p53作为原癌基因在肿瘤的发生发展中起作用,目前超过50%的人类癌症中都发现了p53突变[11~13]。MDM2 作为p53 的下游效应基因,可以与p53的转录活性区,即 N端结合,从而抑制p53对其下游基因的转录促进功能[14]。而Heyne等人的研究结果显示,NIR可以直接与MDM2结合,与p53一起形成三元复合物。其中NIR作为INHAT起着阻断p53与MDM2乙酰化的作用,与MDM2合作抑制p53诱导的反式激活[15]。NOC2L参与对p53及其下游效应基因表达的调控,同时已有研究证明NOC2L的异常表达与多种肿瘤的发生有联系,因此我们认为NOC2L可能通过调节p53及其下游基因表达参与到多种肿瘤的发生发展过程中。同时我们期望能够通过NOC2L慢病毒來构建稳转细胞系以研究NOC2L与各种肿瘤发生发展的相关机制。
慢病毒载体是以人类免疫缺陷病毒(HIV)为基础发展起来的基因治疗载体,该载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达,具有感染效率高、感染谱广和稳定表达等优势[16]。目前,慢病毒已经非常广泛地被用于构建稳定表达的哺乳动物细胞系,在构建慢病毒载体时可以在质粒中插入萤光素酶基因、绿色和红色荧光蛋白基因等报告基因,通过这些报告基因对构建的稳转细胞系进行筛选,有效提高转染效率。陈平等研究证实联合使用慢病毒表达载体和流式细胞仪分选技术可以快速筛选出稳定表达绿色荧光蛋白的293T细胞系[17]。本研究构建了NOC2L基因重组慢病毒表达载体,载体质粒中插入有绿色荧光蛋白基因报告基因,可以通过报告基因对构建的稳转细胞系进行筛选,提高转染效率。我们下一步将利用构建的载体研究NOC2L基因在不同肿瘤中对p53及其下游基因的调控情况,以明确NOC2L在各种肿瘤发生机制中所起的作用。
参 考 文 献
[1]吴军,王亚洲,杨圣伟,等.组蛋白乙酰转移酶p300/CBP抑制剂的研究进展[J].药学进展,2019,43(2):118-126.
[2]Hublitz P,Kunowska N,Mayer UP,et al.NIR is a novel INHAT repressor that modulates the transcriptional activity of p53[J].Genes Dev,2005,19(23):2912-2924.
[3]Wu L,Ma CA,Zhao Y,et al.Aurora B interacts with NIR-p53,leading to p53 phosphorylation in its DNA-binding domain and subsequent functional suppression[J].J Biol Chem,2011,286(3):2236-2244.
[4]Heyne K,Willnecker V,Schneider J,et al.NIR,an inhibitor of histone acetyltransferases,regulates transcription factor TAp63 and is controlled by the cell cycle[J].Nucleic Acids Res,2010,38(10):3159-3171.
[5]Titus AJ,Way GP,Johnson KC,et al.Deconvolution of DNA methylation identifies differentially methylated gene regions on 1p36 across breast cancer subtypes[J].Sci Rep,2017,7(1):11594.
[6]Klein AP,Wolpin BM,Risch HA,et al.Genome-wide meta-analysis identifies five new susceptibility loci for pancreatic cancer[J].Nat Commun,2018,9(1):556.
[7]Duteil D,Tourrette Y,Eberlin A,et al.The histone acetyltransferase inhibitor Nir regulates epidermis development[J].Development,2018,145(6).pii:dev 158543.
[8]Belyi VA,Ak P,Markert E,et al.The origins and evolution of the p53 family of genes [J].Cold Spring Harb Perspect Biol,2010,2(6):a001198.
[9]申藝坤,陈强,李亚.p63与增殖性皮肤病相关性研究进展[J].河北医科大学学报,2015,36(2):244-246.
[10]Wu J,Zhang Y,Wang Y,et al.Transcriptional repressor NIR functions in the ribosome RNA processing of both 40S and 60S subunits[J].PLoS One,2012,7(2): e31692.
[11]Kruse JP,Gu W.Modes of p53 regulation[J].Cell,2009,137(4): 609-622.
[12]Riley T,Sontag E,Chen P,et al.Transcriptional control of human p53-regulated genes[J].Nat Rev Mol Cell Biol,2008,9(5):402-412.
[13]王樾,吴文涌,吴正升.靶向MDM2-p53相互作用的抗癌治疗研究进展[J].安徽医科大学学报,2018,53(7):1149-1154.
[14]LevBar-Or R,Maya R,Segel LA,et al.Generation of oscillations by the p53-Mdm2 feedback loop: a theoretical and experimental study[J].Proc Natl Acad Sci U S A,2000,97(21):11250-11255.
[15]Heyne K,Frster J,Schüle R,et al.Transcriptional repressor NIR interacts with the p53-inhibiting ubiquitin ligase MDM2[J].Nucleic Acids Res,2014,42(6): 3565-3579.
[16]赵晓彪,李光耀,刘孟刚,等.大鼠Tmub1基因过表达慢病毒载体的构建[J].重庆医学,2016,45(13):1744-1746.
[17]陈平,胡涛,薛敬礼,等.利用慢病毒载体快速建立表达外源基因的哺乳动物细胞系[J].生物技术通报,2011(7):210-213.
(收稿日期:2019-09-25 修回日期:2019-11-25)
(编辑:王琳葵 梁明佩)
