H62铜合金镀金接触件镀层破损 条件下的腐蚀仿真
2019-02-06王泗环郁大照王腾
王泗环,郁大照,王腾
(海军航空大学,山东 烟台 264000)
缝隙腐蚀是一种常见的局部腐蚀现象,发生于金属与金属或金属与非金属表面形成的缝隙或间隙中。缝隙腐蚀位置较为隐蔽,腐蚀及腐蚀产物会降低结构强度,引起连接失效,既缩减结构件服役寿命,又带来安全隐患[1-4]。电连接器是一种通过插针插孔接触件形成电信号连接的电子设备,在各类设备中大量使用。为增强其接触性能,接触件往往采用基底材料镀层结构。在实际使用中,由于存在振动、温湿度等外界环境和人为的反复插拔、划痕等,会导致镀层破损、接触不再牢靠,形成盲孔结构,在适合的环境下就会发生腐蚀[5-7]。尤其对于南海岛礁高温、高湿、高盐雾的恶劣环境,机载电子设备极易发生腐蚀,已成为影响驻岛周期的主要薄弱环节之一[8]。因此,研究此类腐蚀现象对设计及使用中的腐蚀防护有重要意义。由于镀层破损形成的盲孔结构处于缝隙环境下,在考虑腐蚀作用时,仍可将此种腐蚀作为缝隙腐蚀去研究,相关缝隙腐蚀理论仍适用。
对于缝隙腐蚀,国内外已进行大量研究。Rosenfeld等[9]研究了缝隙宽度和深度对2Cr13不锈钢在0.5 mol/L NaCl溶液中腐蚀速率的影响,发现缝隙宽度为0.1~0.15 mm时的腐蚀最为敏感。M. Abdulsalam[10]等研究了温度变化对缝隙腐蚀的影响。A. Conde[11]等研究了在不同浓度NaCl溶液中304不锈钢的缝隙腐蚀速率。胡骞等[12]利用电化学噪声和电化学阻抗技术研究了Q235碳钢的缝隙腐蚀情况,发现缝隙外、内表面积对缝隙腐蚀的孕育和发展有重要影响。樊玉光等[13]利用C0MSOL软件模拟0Cr18Ni10Ti在50 ℃、3.5% NaCl溶液中的缝隙腐蚀,模型结果与文献实验值吻合。刘泉兵等[14]研究了热带海洋大气环境下X70管线钢的缝隙腐蚀行为,结果显示,距离海岸越近、风速越大、大气Cl-沉降速率越大,缝隙腐蚀越严重。
大多数文献没有涉及到接触件镀层破损这类盲孔结构在缝隙中的腐蚀。由于此类缝隙尺寸较小,环境较为敏感,实际测量较为困难,而腐蚀仿真作为新兴的数值模拟手段,近年来得到不断重视,因此应用软件仿真缝隙腐蚀对于实际试验及研究有一定指导意义。文中基于COMSOL软件,仿真研究了镀层破损下的缝隙腐蚀行为,研究镀层破损区距缝隙口距离和缝隙口宽度对缝隙腐蚀速率的影响,为揭示此类腐蚀现象提供指导意义。
1 缝隙腐蚀机理
缝隙腐蚀的发生要具备三个条件[15]:有缝隙的存在;组成缝隙的结构存在金属或合金;腐蚀介质滞留于缝隙内。缝隙腐蚀几乎发生于所有腐蚀介质中,既可表现为全面腐蚀的初期阶段,又可表现为局部点蚀的后期阶段。
缝隙腐蚀可分为初期阶段、发展阶段、后期阶段[2]。初期阶段主要表现为氧浓差电池腐蚀。腐蚀初始,整个缝隙内发生均匀腐蚀,但随着反应的进行,缝隙内部的氧消耗速率远远大于氧供给速率,氧气得不到补充,使得内部阴极反应受限。缝隙口附近由于氧气供应充足,阴极反应持续进行,这样就形成了缝隙内阳极溶解反应,缝隙外阴极还原反应。随着大阴极-小阳极反应的进行,缝隙内阳离子浓度逐渐增大,难以向外迁出。为了保持电中性,缝隙外的阴离子向内迁移,如Cl-等,从而发生金属氯化物等的水解,使溶液pH下降,加剧阳极溶解。阳极溶解又使得更多阴离子迁入,如此反复进行,就形成了闭塞电池的自催化效应,加剧腐蚀。氧浓差电池腐蚀与自催化效应理论解释了物质迁移受阻对缝隙腐蚀的影响,但无法解释腐蚀最严重区域发生于缝隙中部这一现象,进而由Pickering等[16]提出IR降理论。该理论认为,由于溶液电阻的存在,使得缝隙内外产生电压降,导致腐蚀发生。电压降是导致腐蚀发生的根本原因,只要有足够的电压降,不需改变溶液条件就可使内部区域达到活化状态,发生缝隙腐蚀。
影响缝隙腐蚀的因素主要有缝隙几何尺寸、溶液环境条件、金属材料性能等。缝隙几何尺寸包括缝隙宽度、深度及内外面积比,缝隙宽度越小,越易形成滞留的腐蚀介质。缝隙几何尺寸主要通过影响氧传输及阴阳极面积比来影响腐蚀反应速率。溶液环境如温度、pH值、电解质离子均对缝隙腐蚀产生影响,其中对于中性溶液由于阴离子导致的水解酸化加剧腐蚀现象更为普遍。通过加入Cr、Ni、Mo等金属增强材料的自钝化性能,可以有效提高金属抗腐蚀性能。
2 仿真数学理论
COMSOL软件可以通过其内置接口的耦合,有效仿真多物理场环境下的声、光、电、热、力等过程。对于腐蚀仿真,COMSOL是基于一定的电化学原理,通过用户设定各类边界条件而实现的[17]。
腐蚀电化学体系有三个要素:电子导体、离子导体、电极-电解质界面区。其中涉及到电场、传质、极化等物化现象。由于金属导电性好,电子导体只需用欧姆定律即可实现。离子导体涉及到传质引起的浓度、电场变化。电极-电解质界面区涉及到极化、溶解等现象,因此后两者是仿真实现的主要对象。
对于电解液,非稳态条件下其遵循物质传递方程为:

式中:ci为物质浓度,mol/m3;Ni为物质通量,mol/(m2·s);Ri,tot为电解液中的反应源项。对于稳态体系,式(1)中浓度对时间的变化项可忽略不计。
对于稀溶液,物质通量Ni可由Nernst-Planck公式给出:
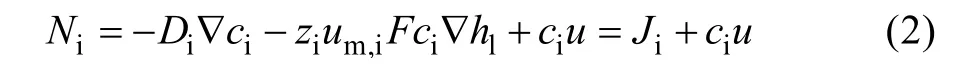
式中:Di为扩散系数,m2/s;zi为离子电荷数;um,i为电子迁移率,S·mol/kg;F为法拉第常数,F=96 485 C/mol;hl为电解质电导率,V;u为流体流速,m/s。
电解液中净电流i1可由Ni表示:

此外,电解质还遵循电流守恒和局部电中性方程:

由式(1)、(3)、(4)、(5)可求解电解液电势、电流及物质浓度。
对于电极-电解质界面区,可由浓度依赖的Buter-Volmer公式定义反应速率:
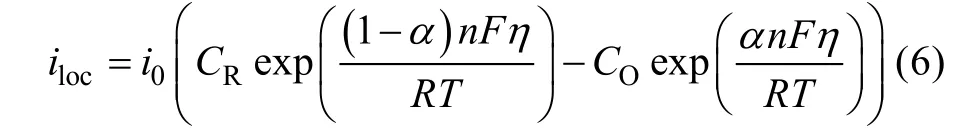
式中:i0为交换电流密度,A/m2;CR、CO为正逆反应物浓度系数;α为传递系数;R为气体常数;T为绝对温标。
在实际使用中,COMSOL软件提供了多种定义方式:若忽略浓度影响,可简化为线性Buter-Volmer 公式;若反应处于强极化区,可简化为Tafel方程;若反应可以快速进行以至于不极化,可用热力学平衡去定义;若处于理想极化状态即法拉第电流为0,可设定i0=0去定义。
对于边界处的无通量和绝缘均定义为法向浓度梯度为0、电势梯度为0:

3 镀层破损下的腐蚀仿真
3.1 几何模型
为简化计算,模型设定为二维几何模型,如图1所示。L1是接触件充满电解液的缝隙深度,下边界为接触件部位,上边界为无通量边。L2是镀层破损区域,设定其为a=0.25 mm,b=0.005 mm的椭圆型破损结构。W为镀层破损区距缝隙口距离,H为缝隙宽度,左端为与外界空气接触的缝隙口,右端为缝隙底部。以常用铜基底镀金材料接触件为研究对象,镀层破损区域为H62铜合金,其余为金,合金成分见表1。采用自由三角形网格剖分方式,对电极反应表面进行网格细化处理。

图1 几何模型

表1 H62铜合金成分 %
3.2 模型定义
镀层破损条件下的腐蚀,实质是缝隙环境下的电偶腐蚀。相比于单一材料腐蚀,其腐蚀速率更快,更加迅速地消耗氧气,达到腐蚀稳定阶段。因此文中主要考虑前期由于腐蚀导致氧浓度差异阶段,选择二次电流分布和稀物质传递物理场接口,进行双向耦合计算。
缝隙腐蚀受多种因素的影响,考虑缝隙宽度、镀层破损距缝隙口距离、外部电极电位三个因素对腐蚀的影响。由于缝隙深度可以由镀层破损位置代替表示,因此不做过度考虑。氧气环境因素对缝隙腐蚀有很大影响,考虑其实际使用环境,给定边界及溶液固定的大气氧环境。
3.3 边界条件
电解液为质量分数3.5%的NaCl溶液,测得其电导率为5.6 S/m。缝隙口与大气环境接触,设定其氧气浓度为0.258 mol/m3。溶液中氧扩散系数为1.98× 10-9m2/s。电极动力学采用Tafel方程表达,相应参数见表2。

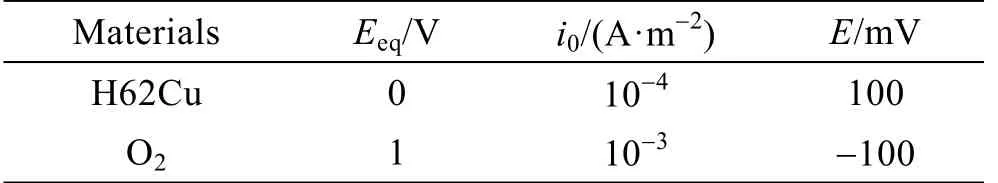
表2 电化学参数
阴极反应交换电流密度受氧浓度影响,满足关系:

式中:2O0c 、2Oc 分别为初始与反应后的氧浓度。
阴极反应导致氧消耗满足耦合关系:

缝隙其余边界符合绝缘及无通量条件。
3.4 仿真结果
采用瞬态研究,对缝隙宽度、镀层破损区距缝隙口距离及外部电极电位这三个参数进行扫描处理。仿真结果显示,外部电极电位对腐蚀影响十分微小,因此不加以分析,仅讨论前两参数对缝隙腐蚀速率的影响。镀层破损区距缝隙口距离和缝隙宽度参数设定见表3。

表3 扫描参数设定
电解质电位、电极电位及缝隙中氧气浓度的分布情况如图2所示,各种几何尺寸下的分布大致均符合此规律。由图2a可看出,由于腐蚀的发生,使得电解质电位在t=0 s与t=600 s时的情况完全不同。初始时,以镀层破损区电解质电位最大,向两端呈递减;腐蚀稳定时,其电位分布由缝隙口向缝隙底部递增。图2b为电极电位分布情况,电位在镀层破损区最小。0 s时,缝隙口附近的电极电位要明显低于缝隙内部区域;在600 s时,两者情况完全相反。表明金属腐蚀在0 s和600 s时的情况有所不同。图2c为氧浓度分布图,可以看出,在缝隙口处,氧浓度迅速降低。由于阴极反应的发生,使得缝隙口附近顶部氧浓度要大于底部,呈向右下角逐渐降低的趋势。缝隙宽度越大,镀层破损区距缝隙口距离越小,越有利于氧气的扩散。在实际情况下,由于H不易发生较大改变,而W可在任何位置出现,因此W更易对氧扩散产生影响。W=0.4 mm时,可对氧浓度产生影响,使得缝隙口附近氧浓度变化范围更大;而W大于0.7 mm时,缝隙口内部阴极反应可迅速消耗氧气,因此对氧浓度分布几乎不产生影响。
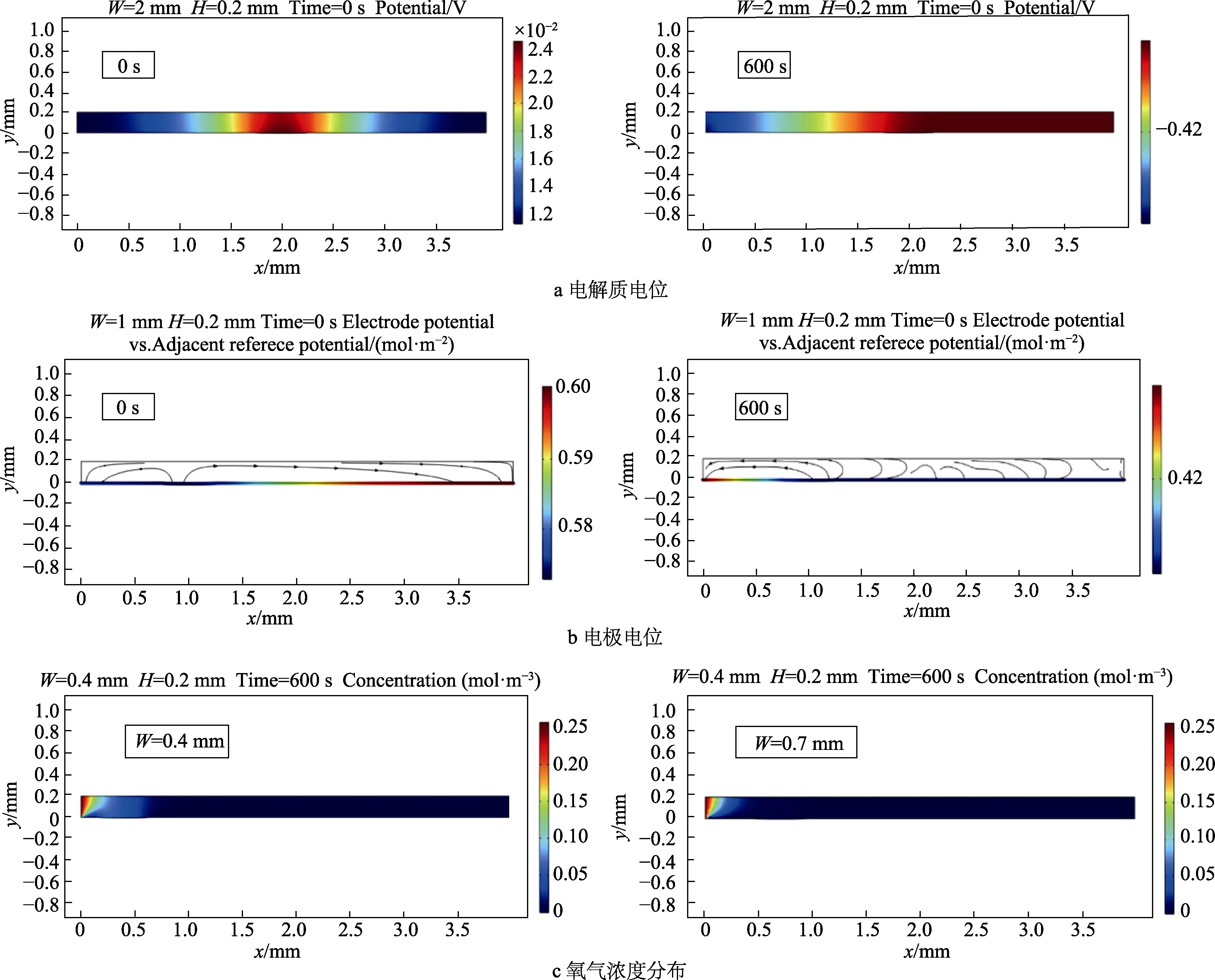
图2 电解质电位、电极电位、浓度分布
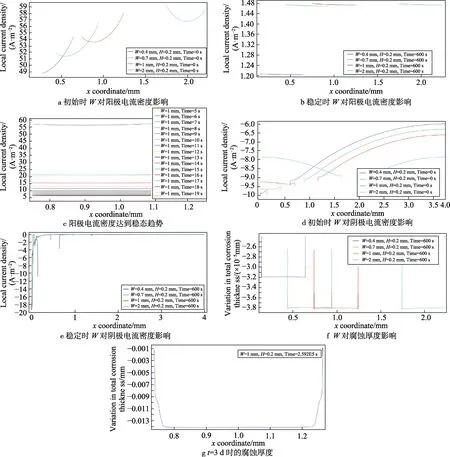
在H=0.2 mm的情况下,W的变化对腐蚀速率的影响如图3所示。图3a、b为初始及稳定时的阳极电 流密度变化,可以看出,初始时,破损区域电流密度近似呈U型分布,电流值达50 A/m2以上,最小值先出现在中心以左。随着W的增大,最小值逐渐靠近中心,电流呈对称分布。这是由于几何尺寸导致电极极化不对称,进而两侧的电流分布不对称。稳定时的电流密度与初始值相差甚大,仅仅为1.5 A/m2左右。虽然电流密度随W的增大而增大,但当W大于0.7 mm时,电流密度增大不明显,基本处于稳定值。图3c为电流密度在初始阶段每秒的变化量,可以看出,在20 s以内,电流密度就可迅速达到稳定值,表明缝隙内的氧气在反应初期即被迅速消耗而达到稳定阶段。图3d、e为初始及稳定时的阴极电流密度变化,反应初始时,阴极电流密度大小与阴极区域大小呈正比;稳定时阴极反应主要集中在缝隙口,电流密度可达20 A/m2,沿缝隙向内迅速降低接近于0。表明在反应阶段,少量扩散进入缝隙内部的氧气即被迅速消耗,腐蚀反应受阴极氧浓度控制。图3f为不同W下的腐蚀厚度,根据阳极电流变化,腐蚀可认为是随时间的均匀腐蚀。图3g是3 d后的腐蚀厚度,最大腐蚀厚度可达0.014 mm。
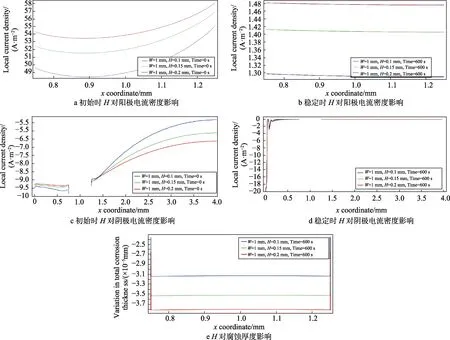
在W=1 mm的情况下,H对腐蚀速率的影响如图4所示。由图4a、c可以看出,初始时,H的变化对电流密度不产生影响。随着H的增大。电流密度也随之增大,增大趋势有所减缓。这是由于H的增大会使得缝隙口氧气扩散范围更大,但其影响作用会变得越来越缓慢。由图4b、d可以看出,初始及稳定时, 电流密度存在巨大差距,但H变化对稳定时腐蚀速率的影响很小。图4e为H对腐蚀厚度的影响,在镀层破损区域,发生更为均匀的腐蚀,且腐蚀厚度随H的增大而增大。
4 结论
1)腐蚀反应受到阴极反应控制,快速达到稳定状态。腐蚀初始反应速率远远大于稳定阶段,氧浓度迅速降低,使得稳定状态下的阴极反应主要集中于缝隙口。阴极反应的变化也导致电解液、电极电位在初始及稳定时的分布截然不同。
2)镀层破损下的缝隙腐蚀为随时间发生的稳定均匀腐蚀。W、H的增大均可使腐蚀加剧,但W大于0.7 mm时,基本对于缝隙口的氧环境不再产生影响,进而腐蚀速率处于稳定状态,而H在一定范围内对于腐蚀可产生持续影响。
3)根据W、H的影响作用,在接触件设计中可将镀层随着缝隙向内逐渐增厚。在实际使用中,要避免产生较大缝隙,如减少不必要插拔次数、对于振动环境可增加固定措施等。
