蛋白磷酸酶2A在线粒体质量控制中的作用研究进展
2019-01-30林忠宁林育纯
车 琳,林忠宁,林育纯*
(分子疫苗学和分子诊断学国家重点实验室,厦门大学公共卫生学院,福建 厦门 361102)
蛋白磷酸酶2A(protein phosphatase 2A,PP2A)是真核细胞内广泛表达的丝氨酸/苏氨酸蛋白磷酸酶家族成员,参与外源物诱导细胞毒性损伤和致癌过程中关键调控蛋白的可逆性磷酸化调节[1]。PP2A全酶是由结构亚基A(65 kD)、催化亚基C(36 kD)和不同的调节亚基B(50~130 kD)家族成员构成的异源三聚体蛋白复合物[2];其中,部分PP2A亚基,如PR70、Cα和B55亚基等,在外源因素诱导下可选择性转位分布于线粒体,见图1因此,PP2A在参与线粒体介导的细胞周期[3]、凋亡[4]、坏死[5]和线粒体自噬[6]等生理或病理过程中具有重要作用。线粒体质量控制(mitochondrial quality control,MQC)是通过对处于内、外源因素刺激条件下线粒体形态、数量与质量的多维调控,维持细胞内稳态的新机制[7]。研究表明,PP2A通过直接或间接对线粒体蛋白、线粒体转位分布蛋白、以及调控线粒体功能相关蛋白的去磷酸化作用,参与介导线粒体生物发生、线粒体动态线粒体氧化还原平衡和线粒体自噬等重要生物学过程,进而影响MQC稳态。本综述着重阐述PP2A参与外源物诱导细胞线粒体调控网络对维持细胞内环境稳态的分子机制,旨在分析PP2A不同亚基对MQC相关信号分子的去磷酸化调控作用,为研究环境因素暴露诱导线粒体关联性毒性损伤和致癌作用提供线索。
1 PP2A参与线粒体生物发生的调节
线粒体生物发生(mitochondrial biogenesis,MB)是指通过线粒体前体的生长和分化形成新线粒体的过程,以维持线粒体功能障碍后代谢稳态的适应性反应[8]。生理状态下,MB主要取决于线粒体基因组和核基因组的稳定性,包括核编码的线粒体蛋白合成和输入,以及线粒体DNA(mtDNA)的复制和线粒体编码蛋白的合成。病理条件下,线粒体作为外源物诱导毒作用的靶细胞器之一,其生物发生可参与调控机体肝细胞毒效应的产生[9],以及介导结肠癌、阿尔茨海默病等的发生发展[10-11]。
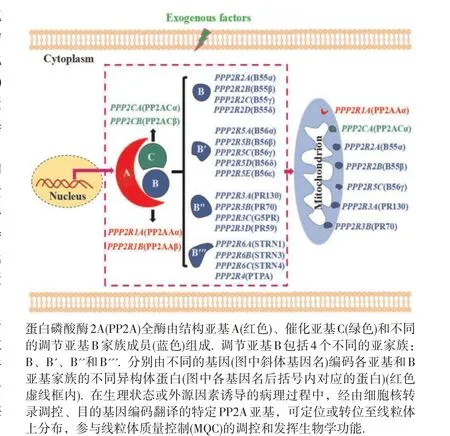
图1 PP2A全酶亚基及其线粒体分布
丙型肝炎病毒(HCV)作为慢性丙型肝炎的诱因,不仅与肝致癌作用相关,而且其与胰岛素抵抗介导的代谢性疾病如2型糖尿病的关联性也逐步被证实。体外试验中,采用可诱导表达HCV功能性基因型1a完整cDNA的UHCV-57.3细胞,阐明HCV通过诱导PP2A-C亚基表达增加促进丝/苏氨酸激酶Akt中Ser473去磷酸化修饰,阻碍胰岛素信号传导,减少经由线粒体途径的糖异生和糖原合成;采用覆盖HCV中开放读码框(3~3 010 aa)的cDNA片段(9 kb)构建的HCV转基因小鼠,体内试验发现肝脏中PP2A-C高表达、并且与胰岛素信号传导功能降低呈正相关;而且,胰岛素信号传导功能降低进一步在慢性丙型肝炎患者的肝活检组织样本中被证实[12]。过氧化物酶体增殖物激活受体γ共激活因子-1α(peroxisome proliferator-activated receptor gamma coactivator 1 alpha,PGC-1α)通过激活参与能量代谢的转录因子,如核呼吸因子1(NRF1)和2(NRF2),控制核编码的线粒体氧化磷酸化(OXPHOS)相关基因的表达以及参与线粒体蛋白转录、蛋白质输入和组装的核编码因子的表达,调节MB[13-14]。Bernsmeier等[15]发现,HCV诱导肝癌Huh7细胞和HCV感染培养的Huh7.5.1细胞中PP2A-C上调,增加叉头盒转录因子O1中Ser256位点去磷酸化,通过促进MB调节因子PGC-1α表达和控制肝癌细胞中葡萄糖代谢稳态,抑制机体血糖水平,有利于控制2型糖尿病的发展。此外,研究表明,血管紧张素 II(AngII)抑制原代人主动脉内皮细胞(HAECs)中 PGC-1α表达,经由MB介导eNOS生成下降,造成血管损伤;当HAECs细胞瞬时转染Ad-PGC-1α质粒高表达PGC-1α后,PP2A-Aα/β与eNOS相互作用减弱,eNOS中Ser1177去磷酸化水平受到抑制,最终经由MB抑制AngII诱导的NO生成减少;提示抑制PP2A-Aα/β活性为PGC-1α介导的MB调节eNOS生成和参与血管内皮细胞功能修复提供了新机制[16]。Liu等[17]研究发现,一氧化氮前体药JS-K处理人肝癌HepG2和SMMC-7721细胞24 h后,NO释放增加,被高度活化的PP2A-C促使p-Bcl-2中Ser70位点去磷酸化增加,诱导肝癌细胞线粒体依赖性凋亡。
线粒体分裂和融合的协调机制对于MB也发挥重要作用[18]。线粒体分裂蛋白(如Drp1)是维持MQC的关键组成部分,在神经细胞研究中,分别给予SD大鼠原代海马神经元细胞瞬时转染PP2A-Bβ2和Drp1表达质粒,均发现线粒体分裂增加,阐明PP2A-Bβ2通过介导Drp1中Ser656去磷酸化,影响MB、抑制树突生长发育、增强突触形成,进而调节海马神经元的正常生长发育[19]。Ljubicic等[20]发现,酿酒酵母中PP2A(即同源物Sit4p、Pph21p和Pph22p)的缺失,可降低对蛋白激酶SNF1的去磷酸化作用,影响mtDNA损伤相关的线粒体疾病等,为菌株增殖创造条件,提供了PP2A在维持真核生物MB中重要地位的证据。
2 PP2A参与线粒体动态平衡的调节
线粒体处于持续分裂和融合的动态平衡[21]。其中,线粒体动态(mitochondrial dynamics,MD)作为参与维持线粒体数目、形态和功能的主要因素,对于维护线粒体关联性内质网膜(mitochondria-associated endoplasmic reticulum membrane,MAM)[22]和线粒体-核通讯(mitochondria-nucleus communication,MNC)[23]等多细胞器功能平衡至关重要。而且,外源因素诱导线粒体分裂或融合的紊乱,导致MD和线粒体功能障碍,促使细胞走向线粒体依赖性凋亡[24]、焦亡[25]和铁死亡[26]等调节性细胞死亡结局,在外源物诱导致癌作用和损伤相关疾病中发挥重要的调控作用[27-28]。
线粒体分裂和融合在哺乳动物细胞由高度保守的鸟苷三磷酸酶家族介导[29],包括促进线粒体分裂的Drp1蛋白、促进线粒体融合的融合蛋白 1(mitofusin 1,Mfn1)、融合蛋白 2(mitofusin 2,Mfn2)以及视神经萎缩蛋白 1(optic atrophy 1,OPA1)[30]。这些蛋白均受到翻译后修饰的调控,主要包括磷酸化[31]、泛素化[32]和SUMO化[33]等,调节其在线粒体上的丰度和功能活性。其中,磷酸化作为调控线粒体蛋白最广泛的翻译后修饰形式[34-35],其对应的去磷酸化修饰报道尚少。研究发现,PP2ABβ2通过其N端(1~24 aa)的线粒体靶向序列,将异源三聚体PP2A募集定位到线粒体外膜,诱导线粒体分裂,从而增加对神经元PC12细胞的损伤;进一步研究表明,PP2A-Bβ2向线粒体的转位是通过其N端的3个Ser残基磷酸化调节,Ser20~22磷酸化的PP2A-Bβ2对Drp1中Ser656去磷酸化受到抑制,进而阻碍线粒体分裂,打破MD平衡,诱导神经元PC12细胞凋亡,为探索脊髓小脑性共济失调12亚型等神经退行性疾病的发病机制提供了PP2A介导去磷酸化调控的依据[36]。
细胞焦亡是一种炎性调节性细胞死亡形式,由穿孔素GSDMD、Caspase-1和炎性小体NLRP3等分子介导[37]。其中,NLRP3是一种多蛋白复合物,作为胞质模式识别受体,可感知作用于机体细胞的内、外源性危险信号;当损伤相关分子模式,如高迁移率族蛋白1和ROS等,激活NLRP3与衔接子ASC形成炎性小体时,Caspase-1激活导致线粒体膜损伤,膜通透性改变,伴随促炎细胞因子IL-1β和IL-18等的释放,导致细胞焦亡[38]。其中,相关蛋白的转录和翻译后修饰调控模式介导NLRP3激活、以防止其异常活化参与MD相关的膜损伤分子机制受到关注。Stutz等[39]发现NLRP3存在3个保守的磷酸化位点,分别位于其Pyrin结构域(PYD)(人Ser5或小鼠Ser3)、PYD和NOD结构域之间(人Ser161或小鼠Ser157),以及LRR结构域(人Ser728或小鼠Ser725),其激活受PYD结构域的磷酸化控制。小鼠永生化巨噬细胞(iMOs)中敲低Ppp2ca时,发现NLRP3活化程度显著降低,表明PP2A通过去磷酸化NLRP3的PYD位点抑制炎性小体组装,提示作用于PYD的激酶和磷酸酶之间的平衡对于NLRP3激活具有关键作用,为靶向NLRP3相关损伤和致癌作用的干预提供了新策略。因此,基于PP2A调控NLRP3活化介导的线粒体动态平衡影响细胞焦亡这一新型死亡方式,为致癌过程中的免疫调控机制和干预研究提供了线索。
目前,PP2A在线粒体分裂和融合事件中的作用存在争议,PP2A与MD之间的“双向性”关系与外源物暴露和细胞种类有关。Merrill及其同事发现PP2A-Bβ2抑制是线粒体融合的触发因素,SD大鼠原代海马神经元细胞瞬时转染靶向线粒体的PP2A-Bβ2-GFP质粒后,PP2A-Bβ2线粒体定位增加,通过去磷酸化Drp1中Ser656位点、激活Drp1活性促使线粒体分裂,导致细胞凋亡[40]。Ruvolo等[41]发现神经酰胺促进人早幼粒急性白血病HL60细胞中PP2A-B56α向线粒体外膜的转位、与定位在线粒体膜上的Bcl-2相互作用,促进Bcl-2去磷酸化,由此破坏线粒体融合,增强神经酰胺诱导HL60细胞凋亡作用。然而,Cho等[42]研究表明,冈田酸对PP2A的抑制作用增强了SD大鼠皮质神经元Drp1中Ser616位点磷酸化,促进线粒体分裂,导致线粒体自噬性死亡。最近一项研究证明在大鼠脑内皮RBE4细胞中,冈田酸抑制PP2A活性,导致内质网应激和氧化应激的发生,促使内质网和线粒体Ca2+稳态失调导致MAM功能障碍,并进一步影响线粒体Drp1和Fis1水平升高,最终导致线粒体分裂和线粒体依赖性细胞凋亡的发生[43]。因此,外源因素诱导不同细胞中PP2A全酶在线粒体的分布和MQC相关蛋白底物选择性去磷酸化的具体机制尚待研究。
3 PP2A参与线粒体氧化还原平衡的调节
线粒体是维持细胞内环境稳态的氧传感器,通过电子传递链产生线粒体ROS(mitoROS),参与对线粒体离子通道(如线粒体外膜VDAC)、mtDNA和酶类功能活性的调节、及其介导线粒体氧化还原(mito-Redox)信号的传导,维持线粒体氧化还原平衡[44]。外源性因素(生物、物理和化学等)作为诱导细胞毒性损伤和致癌作用过程的主要诱因,可促进mitoROS产生,其参与mito-Redox平衡调节的研究已被广泛报道[45-46]。同时,环境因素介导PP2A的转录调控及其对底物蛋白的选择性去磷酸化调控参与致癌作用,也已成为关注的热点[47]。因此,在外源物诱导细胞毒性损伤和致癌作用过程中,PP2A和mito-Redox成为共同关注的焦点。
Xu等[48]采用PC12和SH-SY5Y细胞,阐明雷帕霉素可通过阻止CdCl2诱导mitoROS产生介导的PP2A/JNK/Erk1/2通路,改善镉引起的神经元凋亡,揭示通过增加PP2A活性具有预防镉诱导神经系统毒性损伤的潜力。Xie等[49]研究报道,外源H2S及其供体等诱导SH-SY5Y细胞p66Shc中Cys59位点硫化介导了H2S的抗氧化作用,PP2A作为调节p66Shc磷酸化的关键蛋白,H2S破坏二者结合,减少mitoROS的产生以保护神经细胞免受应激诱导的衰老,揭示PP2A是参与mito-Redox所致细胞衰老的调节枢纽。Shimura等[50]研究发现,长期低剂量暴露X射线辐射的正常人成纤维细胞MRC-5和TIG-3,其胞内抗氧化的谷胱甘肽水平降低,胞内还原状态受抑制。过量的mitoROS则促进PP2A-C的氧化失活,造成细胞周期蛋白D1的异常核积累,导致细胞生长迟缓、细胞衰老和基因组不稳定性。在外源物致癌作用过程中,Wilson等[51]研究报道通过应用线粒体-电子传递链缺陷型人肺癌和乳腺癌细胞系(ρ0细胞),或选择性肽抑制剂抑制NADPH氧化酶活性,抑制mitoROS产生,可显著降低PP2AC中Tyr位点的硝化,结果发现随着PP2A活性降低,乳腺癌基因1(BRCA1)表达恢复,DNA同源重组修复水平显著提高,显示肺癌和乳腺癌细胞的氧化还原微环境与PP2A的关联性可以调节其基因组稳定性。最近,Kim等[52]发现氯硝柳胺诱导非小细胞肺癌细胞系H1299和A549细胞中mitoROS产生,引起线粒体功能障碍(膜电位下降),研究表明经由抑制PP2A癌性抑制因子(cancerous inhibitor of protein phosphatase 2A,CIP2A)、促进PP2A-C激活导致PP2A活性增加,抑制癌细胞增殖,提示开发靶向CIP2A/PP2A-C调节机制的新型PP2A活化因子,对于致癌作用的靶向干预具有潜在应用价值。
4 PP2A参与线粒体自噬的调节
自噬是细胞吞噬自身物质(蛋白质、细胞器等)并降解以维持细胞稳态的过程,因其对不同类型底物的选择性不同,分为线粒体自噬(mitophagy)[53]、内质网自噬(ER-phagy)[54]和脂自噬(lipophagy)[55]等。近年来,随着外源因素诱导细胞自噬所介导细胞毒性损伤和致癌作用过程研究的开展,激酶和磷酸酶介导的靶蛋白磷酸化和去磷酸化相关功能性研究也相继被揭示[56]。Zhou等[57]首次提出PP2A-A亚基作为调节桦木酸(BetA)介导多发性骨髓瘤细胞系线粒体依赖性凋亡和自噬性细胞死亡的开关,发现BetA通过诱导多发性骨髓瘤IM-9细胞中Caspase-3依赖或非依赖途径影响PP2A活性。稳定高表达Bcl-2的IM-9细胞中,通过抑制Caspase-3活性减轻其对PP2A-A亚基的剪切,导致PP2A-A亚基和Akt的分离,促使PP2A-A亚基以Caspase-3非依赖的方式与死亡相关蛋白激酶结合,从而启动自噬性细胞死亡,提示PP2A参与的线粒体依赖性凋亡和细胞自噬性死亡的转换调控,对于抗凋亡耐药相关的肿瘤治疗具有启示性作用。
线粒体自噬作为自噬的组成类型之一,是自噬溶酶体特异性靶向线粒体降解的一种选择性自噬[58];可分别经由PINK1/Parkin[59]、线粒体自噬相关受体(包括Nix/BNIP3[60]和FUNDC1[61]等)和Smad泛素化调节因子1[62]等途径介导。另外,PP2A在线粒体自噬相关通路上的去磷酸化机制也逐渐被证实。目前国内外研究表明PP2A可以抑制或促进线粒体自噬,与不同细胞类型和外源因素作用有关[63]。Rice等[64]在SH-SY5Y细胞中,发现PP2A-Bβ2亚基线粒体转位分布促进线粒体自噬的发生以诱导神经细胞凋亡,是神经系统损伤相关疾病的主要机制之一。然而,Qi等[65]研究证明在敲低PINK1的小鼠多巴胺能MN9D细胞中,PP2A-C亚基中Y307磷酸化增强(无活性形式),促使Bcl-2中Ser87磷酸化,导致Beclin1/Bcl-2复合物的解离,抑制所诱导的线粒体自噬。最新一项有关酵母的研究也显示,酵母中PP2A样蛋白磷酸酶Ppg1通过与Far8形成蛋白复合物,抑制酪蛋白激酶2介导的Atg32磷酸化,促进Atg32蛋白去磷酸化,抑制酵母线粒体自噬的发生[66]。因此,理清诱导细胞线粒体自噬发生的外源物种类、细胞类型以及PP2A酶复合物组成和底物分子等,对于深入探明PP2A介导MQC在线粒体自噬及其参与致癌作用和肿瘤防制过程中发挥去磷酸化作用机制的研究具有重要意义。
5 总结与展望
线粒体是高度动态的细胞器,作为真核细胞中主要的能量制造者,参与mitoROS的产生、能量代谢和细胞死亡等众多生物学过程。因此,MQC对于维持机体正常生命活动至关重要。近年来,随着线粒体基因组学、蛋白质组学和代谢组学等技术的相继开展,MQC在外源物诱导细胞毒性损伤和致癌过程中的作用及其调控机制不断被提升[67],特别是在肿瘤预防、诊断和治疗领域,以线粒体为核心靶点的诊断和治疗手段不断完善。迄今,MQC受到多种磷酸酶的调节,如磷酸甘油酸变位酶5(phosphoglycerate mutase 5,PGAM5)、线粒体蛋白酪氨酸磷酸酶 1(protein tyrosine phosphatase localized to the mitochondrion 1, PTPMT1)和 蛋 白 酪 氨 酸 磷 酸 酶 2(protein tyrosine phosphatase 2,SHP2)等。其中,PP2A不同亚基与MQC之间的关联性已现端倪,见图2。更重要地,PP2A与线粒体之间尚有许多科学问题有待明确,尤其是肿瘤等重大疾病防制方面,例如进一步鉴定外源物致癌作用和肿瘤细胞中PP2A不同亚基的亚细胞定位及其与线粒体膜结构和功能相关的底物分子,如p53、RB蛋白和环氧合酶2(cyclooxygenase 2,COX-2)等的相互作用和对特异性位点去磷酸化在外源物介导MQC中的作用,以期更加深入解析PP2A调控MQC在线粒体相关多细胞器关联性(如MAM)中的作用,及其与外源物诱导细胞毒性损伤和致癌作用过程(如mtDNA突变、线粒体代谢重编程和炎癌转化等)的作用机制,为环境因素暴露和致癌过程生物标志物的筛查与靶向干预,以及肿瘤相关疾病的预防和控制提供新科学依据。
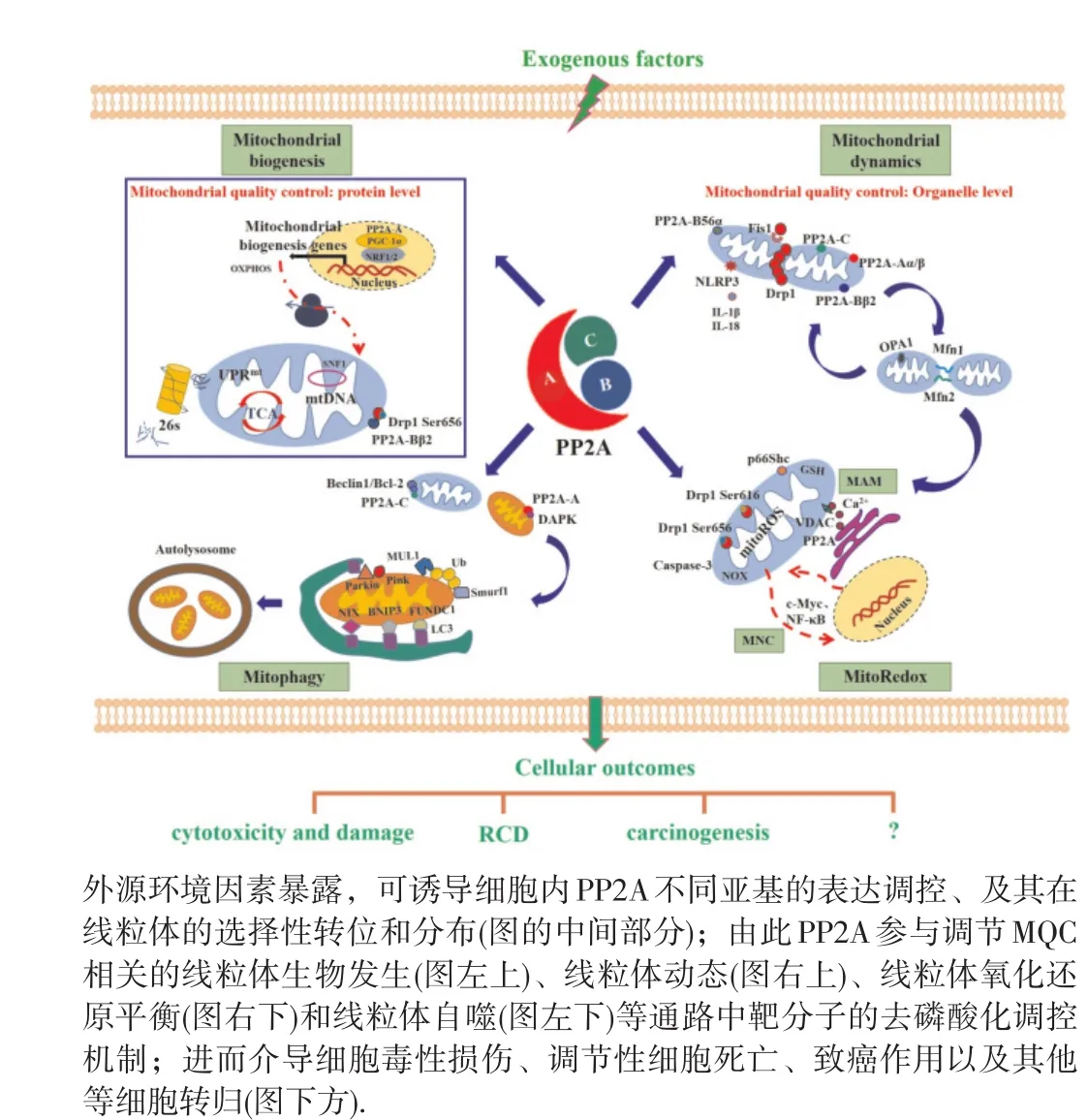
图2 PP2A参与线粒体质量控制的调节作用
