BBS8蛋白参与衣藻鞭毛膜蛋白的运输
2019-01-30孙琳潘俊敏
孙琳,潘俊敏
清华大学 生命科学学院,北京 100084
真核细胞鞭毛也被称作纤毛,主要由长微管形成的轴丝和包裹在轴丝外的纤毛膜组成,是一种突出于细胞表面的保守细胞器[1-2]。真核细胞纤毛参与细胞运动、信号传导等生理过程,并能够调控细胞周期,影响细胞分化和发育。纤毛多种多样的功能决定了其在人类生长发育过程中具有重要意义,纤毛结构和功能缺陷会引发一系列发育异常和遗传疾病。如今已经鉴定到多种人类疾病是由纤毛相关基因缺陷导致,这类疾病在症状上有相似重叠且都是可遗传的,因此统称为“纤毛相关性疾病”[3-4]。
巴德-毕德氏综合征 (Bardet-Biedl syndrome,简称BBS) 是一种能够引发多种疾病症状的人类遗传病,也是一种纤毛相关性疾病。患者主要表现有视网膜萎缩、肥胖、多指 (趾) 畸形、肾脏畸形、性腺发育不良及学习困难等[5]。目前已经发现约19个基因可能导致该疾病,其中认为BBS1、BBS2、BBS4、BBS5、BBS7、BBS8、BBS9与BBIP1所编码的BBS蛋白共同构成巴德-毕德氏综合征蛋白复合体BBSome[6-7]。BBSome基因在含有纤毛的真核细胞中高度保守,并多数定位于基体、中心体和纤毛,但由于缺陷体纤毛往往在形态上能够保持完整,人们认为BBSome蛋白并非纤毛必要结构蛋白[8-10],但参与纤毛内运输、纤毛蛋白和纤毛膜蛋白质的运输过程[6,11-13]。BBS8也称TTC8,是具有三角形四肽重复序列(Tetratricopeptide repeat,TPR) 的BBSome蛋白,在沙特阿拉伯和巴基斯坦的家族中首次报道了在BBS8中出现突变的巴德-毕德尔综合症患者[14]。线虫中,BBS7和BBS8通过维持IFT-A和IFT-B复合物的结合控制纤毛内运输[15]。尽管已经有这些进展,但是BBSome特别是BBS8在纤毛内的作用机制仍不清楚,一种可以分离缺陷纤毛并进行生化分析的模型,将能为研究提供更多便利。
莱茵衣藻Chlamydomonas reinhardtii是一种真核单细胞藻类,有两根等长鞭毛,具有单倍体、全基因测序、鞭毛易观察及分离等优势,广泛应用于纤毛研究领域,纤毛内运输 (Intraflagellar transport,IFT) 就是在衣藻中首先被分离和鉴定的[16]。
本文利用衣藻作为模式生物,通过对BBS8基因缺陷突变体及其回补藻株的研究,确定BBS8蛋白在胞体与纤毛的精细定位,发现BBS8蛋白缺乏会导致纤毛膜蛋白异常积累,并影响纤毛功能和长度调控,为进一步研究巴德-毕德氏综合征提供理论基础。
1 材料与方法
1.1 材料
1.1.1 藻株、菌株及质粒
野生型莱茵衣藻藻株21gr (mt+,cc1690),购自美国衣藻中心;大肠杆菌菌株Match1,用于质粒分子克隆,本实验室保存;质粒pJMG含有巴龙霉素抗性的APHVIII片段,用于衣藻突变体筛选,本实验室保存;质粒pJP-HA具有潮霉素抗性,用于在衣藻内表达带有HA标签的蛋白,本实验室保存。
1.1.2 主要试剂
DNA限制性内切酶购自NEB公司;Phanta高保真PCR聚合酶购自诺唯赞生物科技有限公司;免疫印迹ECL发光液购自康为世纪生物科技有限公司;蛋白浓度测定试剂购自Bio-Rad公司。
一抗:HA(Rat,1∶1000或1∶100)购自Roche公司;α-tubulin (Mouse,1∶3 000或1∶500)购自Sigma公司;IFT38 (Rabbit,1∶100),本实验室保存。二抗 (HRP标记):Goat anti-Rat IgG、Goat anti-Mouse IgG,稀释比例均为1∶5 000,均购自柏奥易杰 (北京) 科技有限公司。荧光二抗:Alexa Fluor 488 goat anti-rat、Texas Red 594 goat anti-mouse、Texas Red 594 goat anti-rabbit,稀释比例均为1∶200,均购自Life Technologies公司。
1.2 方法
1.2.1 突变体的筛选及鉴定
在连续光照条件下,利用TAP培养基培养衣藻浓度至4×106个细胞/mL,将250 μL浓缩细胞和约100 ng的APHVIII片段同时加入电击杯中,冰上预冷后使用电击仪电击,使得DNA片段随机插入衣藻基因组中。将电击后的细胞避光过夜恢复,涂布在具有筛选抗性的平板上,光周期照射1周后挑取转化子。
提取转化成功的藻株的基因组,使用限制酶位点定向扩增 PCR技术 (Restriction enzyme site-directed amplification PCR,RESDA-PCR) 克隆得到外缘片段插入位点位置,在衣藻基因组库中对比测序结果,确定插入片段破坏的基因。
1.2.2 衣藻细胞显微拍摄及鞭毛长度测量
衣藻细胞使用终浓度5%戊二醛固定,利用微分干涉相差显微镜 (Differential interference microscope,DIC) 和Slide软件进行拍照,细胞形态观察使用100×物镜,鞭毛长度测量使用40×物镜。将拍摄照片导出,利用ImageJ软件线段测量功能量取并计算鞭毛长度,每个样品至少测量50个细胞。
1.2.3 衣藻鞭毛的解聚与再生
诱导鞭毛解聚:将5×焦磷酸钠 (NaPPi) 母液加入衣藻生长状态良好的培养基中,使其终浓度为20 mmol/L。酸刺激 (pH shock) 去鞭毛和再生:使用盐酸迅速调节pH至4.0-4.5,30 s后加入KOH溶液调节pH值至7.0左右,离心重悬衣藻细胞,等待鞭毛再生。两项诱导实验均在处理前和处理后的不同时间点取样,戊二醛固定后拍照记录鞭毛长度。
1.2.4 衣藻免疫荧光及荧光拍摄
衣藻细胞使用终浓度4%多聚甲醛固定,并使用0.5% NP-40溶液穿膜,细胞悬液在预先使用聚乙烯亚胺 (PEE) 处理的载玻片上静置,可使细胞贴在载玻片上。将玻片浸入–20 ℃保存的甲醇中,取出后晾干,依次进行封闭、一抗及二抗 (避光)处理。最后,在载玻片上滴加防荧光淬灭封片剂(Fluromount G),盖上盖玻片并用透明指甲油封片,彻底固化后在4 ℃冰箱存放。
1.2.5 衣藻鞭毛的分离提取
使用上述酸刺激法处理大量衣藻细胞,将处理后的细胞低速离心,取出含有鞭毛的上清液与蔗糖溶液混合,并在离心管底部加入高浓度蔗糖溶液后离心,将上层溶液再次高速离心得到纯净鞭毛蛋白沉淀,加入含蛋白酶抑制剂的溶液溶解,–80 ℃冻存待用,提取过程在–4 ℃条件下进行。
1.2.6 衣藻鞭毛组分的分离
将冻存的鞭毛样品冰上解冻,测量样品蛋白浓度后取出部分鞭毛进行组分分离实验。将解冻后的样品再利用液氮迅速冷冻、冰上充分解冻,反复4次,使鞭毛轴丝和膜之间的基质充分溶出,离心后上清标记为基质组分,沉淀漂洗后加入含有0.5% NP-40的溶液,溶解鞭毛膜蛋白,离心后上清标记为膜组分,沉淀漂洗后再溶解标记为轴丝组分。将3部分样品制备为蛋白免疫印迹样品。
1.2.7 蛋白样品银染及质谱鉴定
聚丙烯酰胺凝胶电泳 (SDS-PAGE) 完成后将凝胶剥离,用双蒸水冲洗,乙醇-冰醋酸溶液固定,乙酸钠致敏液致敏后水洗3次,将凝胶置于预冷的0.25%硝酸银溶液中染色20 min,染色完毕水洗2次,使用预冷的2.5%碳酸钠-0.04%福尔马林溶液显色,条带清晰后终止显色,凝胶保存于1%冰醋酸中。
银染后拍照记录凝胶的条带带形,将所需检测样品条带的对应位置凝胶切下,对照组和实验组同时分别进行蛋白质质谱鉴定,并利用phytozome网站(https://phytozome.jgi.doe.gov/pz/portal.html)提供的莱茵衣藻5.5版本蛋白数据库进行蛋白比对,蛋白鉴定工作委托清华大学生物医学测试中心代为进行。
2 结果与分析
2.1 筛选获得BBS8基因衣藻突变体
通过电击转化法将外源DNA片段插入野生型衣藻21gr细胞基因组,抗性筛选后得到转化藻株,测序确定APHVIII片段在基因组中的插入位点,在phytozome网站衣藻基因库中对比插入位点对应的基因。经过大量转化筛选,得到1株BBS8基因破坏的突变体,APHVIII片段正向插入在BBS8基因的第5个内含子上,距离第6个外显子6 bp,将此突变体命名为bbs8突变体,如图1所示。
2.2 突变体鞭毛存在功能缺陷
观察bbs8突变体与野生型21gr的形态差异,发现在液体培养基中bbs8突变体能够活跃游动,对比野生型没有异常。在微分相差干涉显微镜下,突变体的胞体形态和鞭毛长度与野生型细胞也无明显差异 (图2A)。

图1 突变体插入位点及相关基因信息Fig.1 Insertion position in the genome of bbs8 mutant and the information of BBS8 gene.(A) Model pattern of BBS8 gene shows gene size, arrangement of exon and intron, and insert location of exogenous gene.(B) View of BBS8 protein size and domain.
衣藻具有避强光、趋弱光的生理特点,鞭毛蛋白异常时可能导致细胞的光敏功能丧失[17-18],利用强光照射bbs8突变体,发现其在培养基中仍有活跃的自由运动,但感光极性运动特性消失,不再向背光侧极性迁移 (图2B)。
使用NaPPi处理衣藻细胞,会诱导鞭毛逐渐解聚直至消失。酸处理刺激衣藻细胞能使鞭毛从根部脱落,去除刺激后鞭毛会重新长出,用此两种方法检测bbs8突变体的鞭毛的解聚和组装功能是否存在缺陷。bbs8突变体在解聚实验中表现出显著的鞭毛解聚延迟,延迟体现于两个方面:在野生型鞭毛完全解聚时突变体有4-6 μm的鞭毛;并且突变体鞭毛在5 h仍具有明显鞭毛,不能完全解聚 (图2C)。鞭毛再生实验中,bbs8突变体鞭毛组装速率和最终长度和野生型并无明显差异(数据未列出),鞭毛再生过程不受影响。鞭毛的组装和解聚实验说明,bbs8突变体鞭毛解聚受到明显的阻碍,存在鞭毛功能异常。

图2 bbs8突变体和回补藻株的鞭毛性状Fig.2 The phenotype of bbs8 mutant and BBS-HA rescue.(A) DIC images of wild type cell (21gr) and bbs8 mutant, bar=5 μm.(B) Arrow indicates the direction of strong light stimulation, the grayscale is the distribution of the cells.(C) Curve graph of flagellar length during the period of disassembly.
2.3 BBS8基因回补能够恢复突变体性状
衣藻源BBS8基因共编码561个氨基酸,翻译后蛋白大小为61 kDa,与人源BBS8蛋白同源性高,并具有非常保守的8个TRP结构域。从野生型衣藻细胞基因组中PCR克隆全长的BBS8基因(包含5ʹ-UTR序列及其含有内源启动子的前1 684 bp序列),终止密码子替换为含有终止子的3×HA(Haemagglutinin)蛋白标签。将重组基因构建于含有潮霉素的表达载体中,通过电转法导入衣藻细胞基因组,筛选得到回补藻株,命名为bbs8::BBS8-HA。
利用免疫荧光印迹方法检测回补藻株的蛋白表达情况。使用HA抗体检测,发现回补藻株中有带标签蛋白表达,蛋白大小略小于70 kDa,与BBS8-HA蛋白预测大小一致 (图3)。
为进一步验证bbs8突变体的性状是由BBS8基因缺陷导致,对回补藻株进行光刺激、鞭毛组装与解聚实验,结果如图2所示。回补藻株的强光避光性得到恢复,鞭毛解聚延迟性状相比bbs8突变体也有明显恢复,没有完全恢复到野生型性状可能是由于重组蛋白表达量较低,或标签位置对蛋白功能起到微弱影响。由此证明,BBS8基因突变是导致突变体性状的直接原因,BBS8蛋白缺失会造成鞭毛功能缺陷。
2.4 BBS8蛋白是一个衣藻鞭毛蛋白
为了更直观地判断BBS8蛋白在衣藻鞭毛及胞体中的分布,通过免疫荧光(Immunofluorescence,IF),在激光共聚焦显微镜(Laser scanning confocal microscopy)下,直接观察蛋白在细胞中的定位。以野生型细胞为对照组,表达BBS8-HA蛋白的回补藻株为实验组,并分别使用α-tubulin和IFT38两种蛋白示意轴丝结构和IFT-B复合物。可以看到BBS8-HA蛋白在鞭毛基体处有明显的定位亮点,同时在整个鞭毛上呈现点状分布,这种分布方式是典型的鞭毛蛋白的定位 (图4A)。
观察BBS8-HA蛋白与IFT38蛋白在基体位置的定位情况,发现两种蛋白位置上具有高度重合,如图4B所示,这种基体部位的共定位也符合进入鞭毛的IFT的货物蛋白的特征。
2.5 bbs8突变体鞭毛存在蛋白异常积累
对突变体鞭毛进行进一步生化检测,利用冻融和去垢剂穿透方法将鞭毛蛋白分为3个组分,分别对比其与野生型衣藻鞭毛的差异。为使3个不同组分在一次实验中均有较为明显的特征,以1 μg鞭毛所分离出的组分为标准一份 (1×),按比例调整不同组分的上样量进行凝胶电泳,并采用银染方法染色 (图5)。首先,对比无其他处理下的野生型鞭毛和bbs8突变体鞭毛发现,在轴丝和膜组分中,bbs8突变体与野生型相比有多条蛋白质积累条带,从中选取其中3个条带进行质谱鉴定。

图3 回补藻株蛋白表达情况检测Fig.3 Protein expression detection of rescued strain.
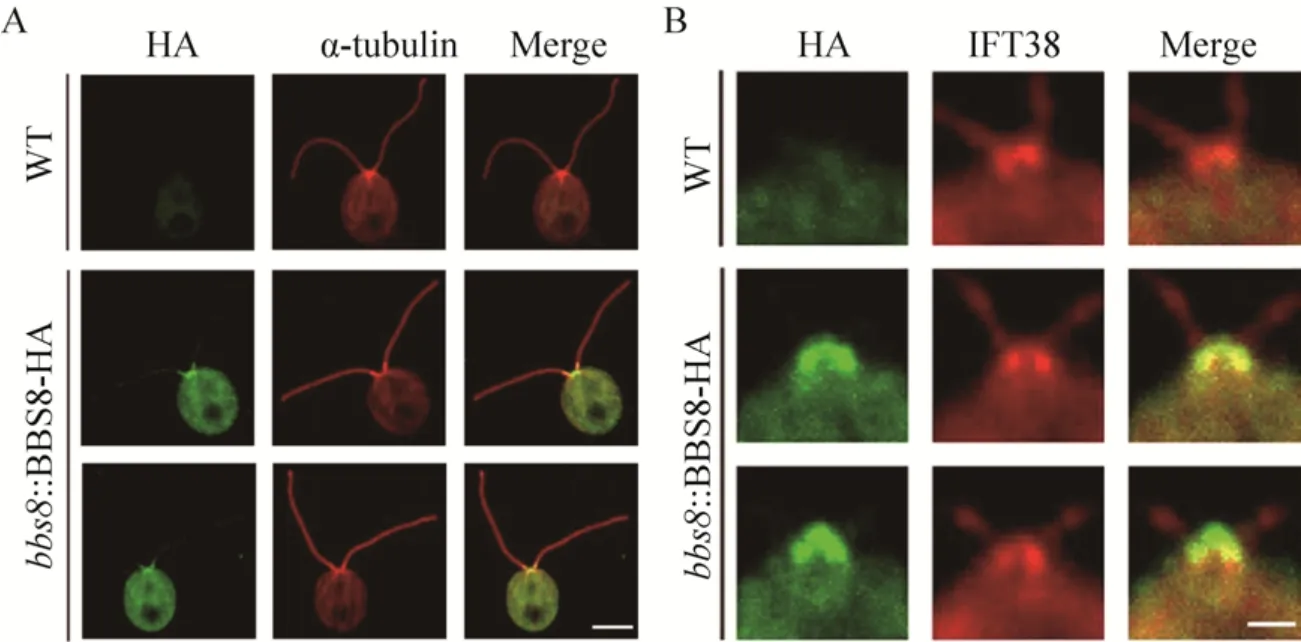
图4 BBS蛋白在衣藻鞭毛和胞体的定位Fig.4 Location of BBS8 protein in the flagellum and cell body of chlamy.(A) bbs8::BBS8-HA cells labeled by anti-α-tubulin and anti-HA.BBS8-HA is located near the basal bodies and in dots along both f lagella.Bar=5 μm.(B)Double immunolabeling of bbs8::BBS8-HA cell with anti-HA and anti-IFT38.BBS8-HA and IFT38 look like to be co-located near the basal bodies.Bar=1 μm.
质谱结果分析时,界定bbs8突变体特异肽段数(Unique piptides)大于等于5,且突变体与野生型的肽谱匹配(Peptide-spectrum match,PSM)比值大于等于2的蛋白是可信的条带蛋白,并从中剔除明显蛋白质大小不符合凝胶所在位置预期的蛋白,分析结果分别见表1、表2和表3。利用NCBI和SMART蛋白分析网站分析这些蛋白的可能结构及功能,发现表1对应条带1中的FAP102、FAP233、PDE27蛋白,表2对应条带2中的FAP102、Cre15.g640000蛋白及表3对应条带3中的FAP102、ACA1、Cre14.g613950、FAP233和Cre16.g681750蛋白,均为膜蛋白或含有明显跨膜结构域。其中ACA1为膜上钙离子运输ATPase,Cre16.g681750有钙离子运输ATPase功能域,两种蛋白在人中都具有同源蛋白,其他积累蛋白中部分蛋白也具有人源蛋白同源结构域,推测BBS8蛋白在人类细胞纤毛中可能执行相似功能,有待进行后续研究。由于在组分分离过程中,冻融和所采用的NP-40去垢剂处理均属于较为温和的蛋白洗脱方式,且由于不同蛋白的结构特性和溶解特性存在差异,实际膜蛋白在轴丝组分中被检验出是正常的。因此,银染和质谱实验结果说明bbs8突变体会导致膜蛋白在鞭毛中的异常积累。

图5 突变体鞭毛有蛋白积累缺陷Fig.5 Protein accumulation defects in the flagella of bbs8 mutant. Silver-stained 4%–15% precast polyacrylamide gel of axonemes (AXO), matrix, and membrane from standard f lagella (std.) and depolymerizing flagella (dep.) of wild type and bbs8.Depolymerizing flagella gotten from cells after NaPPi 1 h.

表1 鞭毛轴丝组分条带1质谱鉴定结果Table 1 Identification results of line 1 from AXO of flagella by mass spectrum

表2 鞭毛轴丝组分条带2质谱鉴定结果Table 2 Identification results of line 2 from AXO of flagella by mass spectrum

表3 鞭毛膜组分条带3质谱鉴定结果Table 3 Identification results of line 3 from membrane of flagella by mass spectrum
2.6 BBS8蛋白参与鞭毛膜蛋白的运输
在鞭毛长度稳定的情况下,鞭毛中存在着蛋白的动态稳定调节,蛋白在鞭毛上的运入和运出是一个动态调节的过程[19]。bbs8突变体的鞭毛膜蛋白在鞭毛内积累,说明这些积累蛋白的运输机制受到了阻碍。NaPPi处理衣藻细胞后,鞭毛的结构蛋白运输回胞体,鞭毛逐渐解聚。在图5中,对比NaPPi解聚1 h处理后提取的鞭毛,bbs8突变体在NaPPi处理后的对应3个条带位置也均有积累,且银染染色强度大于解聚处理前鞭毛。解聚时加重的蛋白积累表明,这些蛋白的异常积累确实是运输缺陷导致的。解聚时蛋白积累的缺陷导致了解聚的速率降低和进程延长,BBS8-HA蛋白的表达能够回补bbs8突变体的解聚性状,如图2C所示。这些实验证据说明,BBS8蛋白缺失是bbs8突变体鞭毛膜蛋白异常积累和功能缺陷的原因,并说明BBS8蛋白参与了鞭毛膜蛋白的运输过程。
3 讨论
通过DNA片段随机插入基因组方式,筛选得到BBS8基因破坏的衣藻bbs8突变体,该突变体缺乏感光极性运动,在药物诱导鞭毛解聚时表现出鞭毛解聚速率慢等性状。实验分析bbs8突变体的鞭毛生化特征,发现其鞭毛内有多种膜蛋白异常积累,且在解聚时异常积累的膜蛋白量增加,说明膜蛋白积累是膜蛋白运输缺陷导致,BBS8蛋白参与膜蛋白运输。
纤毛膜相关蛋白由囊泡运输的方式完成从高尔基体到纤毛口袋处或细胞膜处的运输,并通过膜融合的方式将膜蛋白锚定在前体纤毛膜上,在此与纤毛内运输IFT复合物结合,由马达蛋白介导,在纤毛内进行正向和反向运输[20-21]。BBSome是纤毛内运输膜蛋白的重要复合物,是IFT复合物和纤毛膜蛋白链接的桥梁,但其链接方式和作用机制并不清楚。衣藻bbs8突变体的鞭毛膜蛋白在鞭毛内有异常积累,却没有形成明显的鞭毛基部膨大,可见这些膜蛋白并不堆积在鞭毛基部,说明在鞭毛内仍能进行正向运输,也可以排除鞭毛内正常进行反向运输后,无法回收回胞内的情况。一种可能解释思路是,这些膜蛋白以不需要由BBS8蛋白介导的运输方式完成正向运输,但在反向运输时,需要BBS8蛋白介导,因此在bbs8突变体中,这些膜蛋白不能够进行正常反向运输,无法运回胞内,从而在鞭毛内异常积累。这种猜测可能说明膜蛋白的正向和反向运输的机制不同,或不全由BBSome介导,或BBsome构象变化而使膜蛋白与其结合的方式不同。
本研究对BBS8基因突变的衣藻进行了初步分析,证明BBS8基因破坏会导致鞭毛内膜蛋白运输缺陷,从而影响鞭毛功能,为之后进一步探究BBSome复合物如何运输纤毛膜蛋白提供了有效材料,并为巴德-毕德氏综合征的病理分析提供理论依据。
