复方人参皂苷纳米乳对OVA接种小鼠免疫功能的影响
2019-01-29曹发昊张百胜王艳萍欧阳五庆
曹发昊,张百胜,王艳萍,欧阳五庆
(1. 运城学院 生命科学系,山西运城 044000;2.郑州工程技术学院 化工食品学院,郑州 450044;3. 西北农林科技大学 动物医学院,陕西杨凌 712100)
人参(PanaxginsengC. A. Mey)是一种药食两用的药用植物,具有抗肿瘤、抗疲劳、增强免疫力及抗衰老等功效[1-2],人参皂苷(Ginsenoside,GS)是其发挥功效的重要成分之一,皂苷是一种很好的免疫调节剂,可用于防治人类或动物疾病[3-4]。纳米乳(Nanoemulsion,NE)是油和水在表面活性剂和(或)助表面活性剂作用下形成的一种稳定透明的胶体分散系,具有药物载体的多种优势[5]。人参皂苷具有表面活性剂的性质,能和某些成分作用形成粒径10~100 nm的纳米乳,笔者前期用人参皂苷和盐酸左旋咪唑(Levamisole Hydrochloride,LH)成功制备粒径23.08 nm的复方人参皂苷纳米乳,并对其急性毒性进行研究[6]。为了研究口服复方人参皂苷纳米乳对抗原免疫效果的影响,本研究给小鼠皮下注射卵清白蛋白(OVA)抗原 2 次,在首次和第 2 次注射前连续灌胃给予相应药物,通过检测血清抗体水平、脾细胞因子水平和脾淋巴细胞增殖能力,确定复方人参皂苷纳米乳对OVA免疫效果的影响,为复方人参皂苷纳米乳免疫增强剂的开发提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 试剂 人参皂苷(陕西浩洋生物科技有限公司),盐酸左旋咪唑(山东弘扬兽药原料有限公司),卵清白蛋白OVA(北京智杰方远科技有限公司),MTS试剂盒(艾美捷科技有限公司),TMB显色液(上海碧云天生物技术有限公司),HRP标记羊抗小鼠IgG(上海远慕生物科技有限公司),HRP标记羊抗小鼠IgG1(上海羽朵生物科技有限公司),HRP标记羊抗小鼠IgG2a抗体(上海北诺生物科技有限公司),IL-4 ELISA试剂盒(武汉菲恩生物科技有限公司),IFN-γ ELISA试剂盒(上海哈灵生物科技有限公司)。
空白纳米乳组成:表面活性剂Solutol○RHS-15占25.33%,聚乙二醇400占2.53%,甘油占10.14%,肉豆蔻酸异丙酯占2.53%,蒸馏水占56%。
复方人参皂苷纳米乳组成:空白纳米乳中加入人参皂苷和盐酸左旋咪唑,使其质量浓度分别为30.15和30.04 mg·mL-1。
盐酸左旋咪唑纳米乳:空白纳米乳中加入盐酸左旋咪唑,使其终质量浓度为30.04 mg·mL-1。
人参皂苷纳米乳:空白纳米乳中加入人参皂苷,使其终质量浓度为30.15 mg·mL-1。
人参皂苷-盐酸左旋咪唑水溶液:蒸馏水中加入人参皂苷和盐酸左旋咪唑,使其终质量浓度分别为30.15和30.04 mg·mL-1。
1.1.2 仪器 雷磁 PHS-25 数显酸度计(上海仪电科学仪器股份有限公司),HORIBA SZ-100纳米粒度/Zeta电位分析仪(上海巨纳科技有限公司),DNM-9606酶标分析仪(北京普朗新技术有限公司),倒置显微镜(上海光学仪器一厂),ZWC-08磁力搅拌器(金坛市鸿科仪器厂)。
1.1.3 试验动物 成年Balb/c小鼠,体质量为22~25 g,购于第四军医大学实验动物中心。
1.2 方 法
1.2.1 复方人参皂苷纳米乳的制备 按照文献[6]确定的复方人参皂苷纳米乳配方,先将人参皂苷、表面活性剂和助表面活性剂于磁力搅拌器中(450 r·min-1,25 ℃)混合均匀,然后加入油相继续搅拌混匀,最后缓慢滴加溶解盐酸左旋咪唑的蒸馏水,搅拌直至形成黄色澄清的复方人参皂苷纳米乳。
1.2.2 小鼠分组与给药 小鼠90只,分为9组,每组10只,雌雄各半。具体分组如下:正常对照组(给予生理盐水)、OVA对照组(给予生理盐水)、空白纳米乳组(给予空白纳米乳)、盐酸左旋咪唑纳米乳组(给予25 mg·kg-1盐酸左旋咪唑纳米乳)、人参皂苷纳米乳组(给予25 mg·kg-1人参皂苷纳米乳)、人参皂苷-盐酸左旋咪唑水溶液组(给予50 mg·kg-1人参皂苷-盐酸左旋咪唑水溶液)、复方人参皂苷纳米乳高、中、低剂量组(分别给予100、50、25 mg·kg-1复方人参皂苷纳米乳)。其中人参皂苷-盐酸左旋咪唑水溶液和复方人参皂苷纳米乳中人参皂苷和盐酸左旋咪唑质量比为1∶1。
小鼠(除正常对照组外)皮下注射OVA抗原100 μg,注射 2 次,间隔2 周,每只小鼠分别于首次和第 2 次注射前3 d连续灌胃给予相应药物,每天1次,灌胃量均为0.4 mL。第 2 次注射后14 d,采集全血和脾脏组织,用于后续试验。
1.2.3 血清抗体水平测定 参照试剂盒说明,采用间接ELISA法测定IgG、IgG1和IgG2a血清抗体水平[7]。
1.2.4 脾细胞因子IFN-γ和IL-4测定 无菌条件下,脾脏处理后用培养液制备5×106mL-1脾细胞悬液。96孔板中每孔加入100 μL脾细胞悬液,再加入OVA抗原(终质量浓度为100 μg·mL-1),培养48 h后,取上清,按试剂盒说明检测IL-4和IFN-γ水平。
1.2.5 脾淋巴细胞增殖能力测定 96孔板中加入5×106mL-1脾细胞悬液(每孔100 μL),再加入100 μL培养液,加入OVA使其终质量浓度为10 μg·mL-1。设空白对照组(只加培养液)、阴性对照组(加细胞和培养液,不加OVA),培养44 h 后加入MTS,继续培养4 h后酶标仪测定OD490值,计算增殖刺激指数SI。
SI=加抗原培养物OD490/不加抗原培养物OD490
2 结果与分析
2.1 复方人参皂苷纳米乳对小鼠血清IgG抗体水平的影响
由表1可知,空白纳米乳组IgG抗体水平与OVA对照组差异不显著(P>0.05)。复方人参皂苷纳米乳中剂量组极显著高于盐酸左旋咪唑纳米乳组(P<0.01),显著高于复方人参皂苷纳米乳低剂量组(P<0.05),与人参皂苷纳米乳组、复方人参皂苷纳米乳高剂量组和人参皂苷-盐酸左旋咪唑水溶液组差异不显著(P>0.05)。
2.2 复方人参皂苷纳米乳对小鼠IgG1和IgG2a血清抗体水平的影响
由表1可知,空白纳米乳组IgG1和IgG2a抗体水平与OVA对照组差异不显著(P>0.05)。复方人参皂苷纳米乳中剂量组IgG1抗体水平极显著高于盐酸左旋咪唑纳米乳组(P<0.01),显著高于复方人参皂苷纳米乳低剂量组(P<0.05),与人参皂苷-盐酸左旋咪唑水溶液组、人参皂苷纳米乳组和复方人参皂苷纳米乳高剂量组差异不显著(P>0.05)。复方人参皂苷纳米乳中剂量组IgG2a抗体水平显著高于复方人参皂苷纳米乳高剂量组、人参皂苷-盐酸左旋咪唑水溶液组和复方人参皂苷纳米乳低剂量组(P<0.05),极显著高于盐酸左旋咪唑纳米乳组和人参皂苷纳米乳组(P<0.01)。
2.3 复方人参皂苷纳米乳对OVA诱导小鼠脾淋巴细胞增殖的影响
由表2可知,空白纳米乳组SI值与OVA对照组差异不显著(P>0.05)。复方人参皂苷纳米乳中剂量组SI值显著大于人参皂苷-盐酸左旋咪唑水溶液组和复方人参皂苷纳米乳高剂量组(P<0.05),极显著大于人参皂苷纳米乳组、复方人参皂苷纳米乳低剂量组和盐酸左旋咪唑纳米乳组(P<0.01)。

表1 OVA接种小鼠血清IgG、IgG1、IgG2a抗体水平Table 1 Level of serum antibodies IgG, IgG1, IgG2a in OVA-inoculated mice
注:与OVA对照组比较, a和A分别表示差异显著(P<0.05)和极显著(P<0.01)。与复方人参皂苷纳米乳中剂量组比较, b和B分别表示差异显著(P<0.05)和极显著(P<0.01)。数据用“平均数±标准差”表示。下同。
Note: Compared with OVA control group, the shoulder characters a and A mean significant difference (P<0.05) and extremely significant difference (P<0.01), respectively. Compared with GS-LH-NE medium dosage group, the shoulder characters b and B mean significant difference (P<0.05) and extremely significant difference (P<0.01), respectively.Date are “average±standard deviation”.The same below.
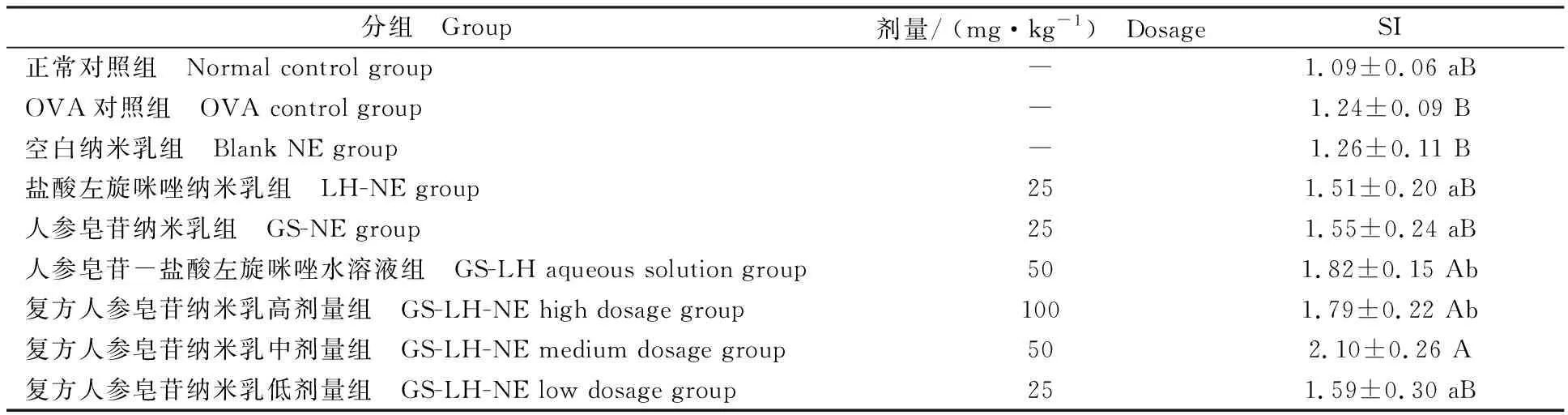
表2 OVA接种小鼠脾淋巴细胞增殖刺激指数Table 2 Proliferation stimulating index of splenic lymphocytes in OVA-inoculated mice
2.4 复方人参皂苷纳米乳对小鼠脾细胞因子IL-4和IFN-γ水平的影响
由表3可知,空白纳米乳组IL-4和IFN-γ水平与OVA对照组差异不显著(P>0.05)。复方人参皂苷纳米乳中剂量组IL-4水平显著高于复方人参皂苷纳米乳低剂量组(P<0.05),极显著高于盐酸左旋咪唑纳米乳组(P<0.01),与复方人参皂苷纳米乳高剂量组、人参皂苷纳米乳组及人参皂苷-盐酸左旋咪唑水溶液组差异不显著(P>0.05)。复方人参皂苷纳米乳中剂量组IFN-γ水平显著高于人参皂苷-盐酸左旋咪唑水溶液组、复方人参皂苷纳米乳高剂量组和复方人参皂苷纳米乳低剂量组(P<0.05),极显著高于人参皂苷纳米乳组和盐酸左旋咪唑纳米乳组(P<0.01)。
3 讨 论
疫苗在机体抵御疾病方面发挥重要作用,有些疫苗单独使用就能达到目的,但有些疫苗的免疫原性弱,需要佐剂或免疫增强剂来改善疫苗的免疫原性,佐剂或免疫增强剂可以通过注射、口服或黏膜等多途径给药。Zhai等[8]研究发现,在鸡接种ND活疫苗前,口服剂量为5 g·kg-1人参茎叶皂苷溶液能显著提高ND活疫苗免疫鸡的血清HI抗体滴度、淋巴细胞增殖反应和IgA+ B细胞数量。Yu等[9]发现在接种ND疫苗和禽流感疫苗前,口服人参茎叶皂苷能恢复环磷酰胺免疫抑制鸡ConA和LPS诱导的脾细胞增殖能力,增加肠上皮内淋巴细胞和IgA+ B细胞的数量,促进特异性抗体产生。在一些免疫试验中,常用小鼠、豚鼠、家兔作为动物模型,OVA作为模式抗原,来研究机体的免疫功能[10]。本研究用小鼠作为试验动物,皮下注射OVA抗原,灌胃复方人参皂苷纳米乳,研究口服复方人参皂苷纳米乳对OVA免疫效果的影响。IFN-γ、IgG2a和 IL-4、IgG1分别反映Th1和Th2的免疫功能,Th1免疫主要由Th1细胞介导的细胞免疫,Th2免疫主要由Th2细胞介导的体液免疫,故通过测定IFN-γ、IgG2a、IL-4和IgG1这 4 个指标可以反映机体的细胞免疫和体液免疫功能[11-13]。结果发现,口服复方人参皂苷纳米乳中剂量组IL-4、IgG和IgG1水平显著或极显著高于复方人参皂苷纳米乳低剂量组和盐酸左旋咪唑纳米乳组,IFN-γ、IgG2a和OVA诱导脾细胞增殖刺激指数显著或极显著高于人参皂苷纳米乳组、人参皂苷-盐酸左旋咪唑水溶液组、盐酸左旋咪唑纳米乳组及复方人参皂苷纳米乳高剂量组和低剂量组。口服复方人参皂苷纳米乳能增强OVA诱导小鼠的细胞免疫和体液免疫功能,产生Th1/Th2混合型免疫反应,其中中剂量(50 mg·kg-1)作用较强。复方人参皂苷纳米乳口服增强免疫效果优于人参皂苷-盐酸左旋咪唑水溶液,这可能是由于:盐酸左旋咪唑存在于水相中,而人参皂苷具有表面活性剂的性质,能起到类似表面活性剂Solutol○RHS-15作用,参与形成纳米乳液滴界面膜,实现其纳米化和药物储存库的功效[14];复方人参皂苷纳米乳平均粒径为23.08 nm,粒径小、表面积大,且其zeta电位(-31.6 mV)小于0,有利于液滴和细胞相互作用,改善药物的吸收和分布[15]。口服复方人参皂苷纳米乳对小鼠非特异性免疫功能的影响有待后续研究。
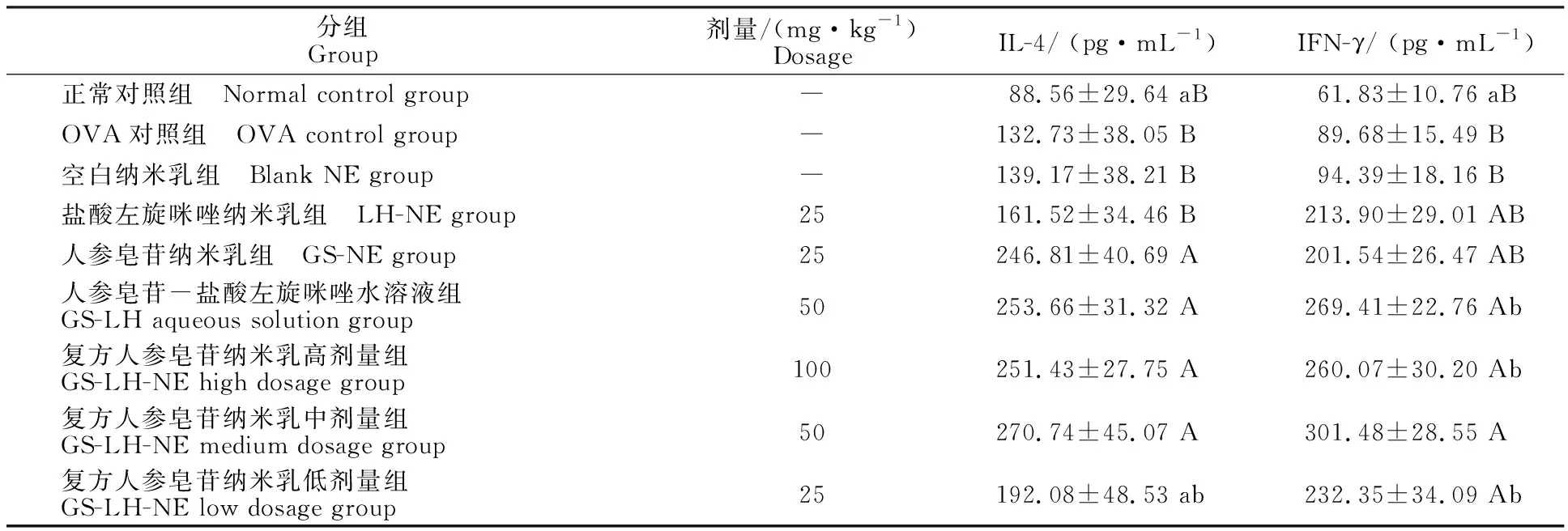
表3 OVA接种小鼠脾细胞因子IL-4和IFN-γ质量浓度Table 3 Level of splenocyte cytokines IL-4 and IFN-γ in OVA-inoculated mice
4 结 论
口服复方人参皂苷纳米乳能诱导OVA免疫小鼠产生Th1/Th2混合型免疫反应,表明人参皂苷和盐酸左旋咪唑能协同增强小鼠的细胞免疫和体液免疫功能,该结果为开发复方人参皂苷纳米乳免疫增强剂提供依据。
