Adβgal-1和Adβgal-2克隆及其在猕猴桃果实软化中的作用
2019-01-29冯新赖瑞联高敏霞陈文光吴如健陈义挺
冯新,赖瑞联,高敏霞,陈文光,吴如健,陈义挺
和gal-2克隆及其在猕猴桃果实软化中的作用
冯新,赖瑞联,高敏霞,陈文光,吴如健,陈义挺
(福建省农业科学院果树研究所/福建省落叶果树工程技术研究中心,福州 350013)
【目的】-半乳糖苷酶是一类参与细胞壁降解的糖苷酶,在植物的生长发育和果实成熟软化过程中发挥重要作用。通过对猕猴桃2个-半乳糖苷酶基因的鉴定及其表达模式研究,明确它们在猕猴桃果实软化中的作用,丰富猕猴桃的后熟软化机理研究。【方法】以‘米良1号’猕猴桃为试材,采用RT-PCR法扩增果实的-半乳糖苷酶基因,利用在线数据库分析其编码蛋白的特性、功能结构域、系统进化关系、基因结构和调控miRNA,应用qPCR研究其在不同组织部位、果实的不同软化时期、不同贮藏温度和ABA处理后的表达特征,并结合酶活性变化,阐释这2个-半乳糖苷酶基因在猕猴桃果实软化中的作用。【结果】克隆得到2个猕猴桃-半乳糖苷酶基因(和),登录号分别为MH319788和MH319789。的开放阅读框为2 280 bp,编码759个氨基酸;的开放阅读框为2 025 bp,编码674个氨基酸。结构域分析显示,Adgal-1和Adgal-2均含有植物糖苷水解酶家族35的功能结构域(Glyco_hydro_35)。基因结构分析表明,由18个外显子和17个内含子组成,而由17个外显子和16个内含子组成。进化树分析显示它们位于两个不同的进化分支中,且序列差异较大,可能源自不同的基因祖先。qPCR分析结果表明,和在猕猴桃的各组织部位(根、茎、叶、花、幼果、成熟果)均有表达,但表达水平不同;它们均在果实软化初期上调表达,随着果实硬度的下降,表达量持续增加;在25℃贮藏过程中,它们均在3 d时上调表达,随着时间的推移,表达量增加;而在4℃贮藏过程中,的表达受到抑制,的表达呈波浪式;ABA处理诱导和的表达。酶活性测定结果显示,-半乳糖苷酶活性在果实软化初期略有降低,随着果实硬度的下降逐渐升高。【结论】和均参与猕猴桃果实的软化进程。不同贮藏温度和ABA处理对猕猴桃果实软化的影响可能是通过改变-半乳糖苷酶基因的表达而实现的。
猕猴桃;-半乳糖苷酶基因;果实软化;酶活性;基因表达
0 引言
【研究意义】果实采后的软化速率直接影响贮藏寿命和货架期。猕猴桃属于呼吸跃变型果实,具有明显的生理后熟过程,且果实采后容易变软腐烂,难于贮藏[1-2]。民间有猕猴桃“七天软,十天烂,半月坏一半”的说法[3]。因此,探讨猕猴桃的后熟软化机理对指导采后贮藏具有重要意义。【前人研究进展】细胞壁结构和组分的改变被认为是果实软化的主要原因[4]。-半乳糖苷酶(beta-galactosidase)是一类参与细胞壁降解的糖苷酶,通过水解-D-半乳聚糖非还原末端的-半乳糖残基,使果胶和半纤维素等细胞壁组分降解,促使细胞壁膨胀,进而引起果实软化[5]。已有研究表明-半乳糖苷酶在多种果实的成熟软化中发挥重要作用。青梅果实的-半乳糖苷酶活性在采后5 d达到最高值,此时果肉的硬度急剧下降[6]。-半乳糖苷酶在桃果实发生软化的起始2 d通过降解果胶物质,加速果实软化[7]。Lidster等[8]采用-半乳糖苷酶活性抑制剂处理苹果后,发现果实软化速率减缓,货架期延长。植物-半乳糖苷酶由多基因家族编码,目前已从香蕉[9]、草莓[10]、枣[11]、苦瓜[12]、桃[13]、陆地棉[14]和番木瓜[15]等多种植物中分离得到。-半乳糖苷酶基因家族的不同成员在果实生长发育和成熟软化过程中的功能不同。Ban等[16]从柿子果实中分离到4个-半乳糖苷酶基因(—),其中在果实生长期的表达量低,但在果实成熟期的表达量显著增加;而的表达模式相反,在果实发育早期高表达,随着果实成熟,转录水平下降;和主要在叶和茎中表达,在果实生长期和采后的表达水平都很低。日本梨果实中存在8个-半乳糖苷酶基因(—),其中和仅在成熟果中表达;和在果实膨大期和成熟期均有表达,在成熟果中的表达量最高;、和在果实膨大期的表达量最高,随着果实成熟,表达量急剧下降[17]。抑制成熟果实中相关-半乳糖苷酶基因的表达,可以提高细胞壁中半乳糖含量,增加果实硬度[18]。【本研究切入点】前人研究发现成熟的猕猴桃果实中存在多种-半乳糖苷酶的同工酶[19],说明存在多个-半乳糖苷酶基因参与猕猴桃的成熟软化过程。然而,目前仅报道了1条猕猴桃果实的-半乳糖苷酶基因,该基因在果实采收时的转录水平最高,随后下降[20];在猕猴桃果实软化期间高表达的-半乳糖苷酶基因未见报道。本课题组早期对‘米良1号’猕猴桃果实在25℃贮藏和脱落酸(abscisic acid,ABA)处理的转录组变化研究中,发现-半乳糖苷酶2条新片段在果实的后熟软化中差异表达,因此,有待进一步研究。【拟解决的关键问题】本研究以‘米良1号’猕猴桃为材料,以‘红阳’基因组中的同源序列为参考,设计引物,对转录组中差异表达的2条-半乳糖苷酶基因序列进行克隆验证,并对其结构及调控miRNA等进行分析,研究其在不同组织部位、果实的不同软化时期、不同贮藏温度和ABA处理后的表达特征,结合酶活性变化,进一步明确这2个-半乳糖苷酶新基因在猕猴桃果实软化中的作用,丰富猕猴桃的后熟软化机理研究,以期为猕猴桃的采后贮藏提供新思路。
1 材料与方法
试验于2017年在福建省农业科学院果树研究所进行。
1.1 试材与处理
以‘米良1号’猕猴桃(var.‘Miliang-1’)为供试材料,分别取1年生组培苗的根和4年生嫁接苗的茎、叶、花、幼果(花后16 d)和成熟果(花后160 d)各12 g,用液氮速冻,保存于-80℃冰箱待用,每样品取3次。
以成熟果(花后160 d)为材料,选择果实大小、可溶性固形物含量和硬度等指标相近的果实,待散去田间热后,置于25℃条件下贮藏,在贮藏果实软化的7个时期(硬熟期、软化初期、软化I期、软化II期、软化III期、软化末期和软烂期),分别称取12 g果肉,经液氮速冻后于-80℃冰箱保存待用,每时期15个果,3次重复。
采用不同温度对成熟果(花后160 d)进行贮藏处理,分别在25℃贮藏1、3、5、7、9和11 d时各称取12 g果肉,在4℃贮藏1、3、5、7、9、11、14、21和28 d时各称取12 g果肉,以未经贮藏的成熟果(0 d)作为对照。采用50 mg·L-1ABA浸泡成熟果(花后160 d)2 min后置于25℃贮藏,并在1、3、5、7和9 d时各称取12 g果肉,以未经ABA处理的成熟果(0 d)作为对照。处理结束后用液氮速冻,并保存于-80℃冰箱待用,每处理15个果,3次重复。
1.2 猕猴桃果实软化过程中的生理生化指标测定
采用GY-1型硬度计测定去皮后的猕猴桃果实硬度,每个果重复测6次,每处理10个果。使用手持式折射仪测定猕猴桃果实的可溶性固形物含量,每个果重复测定4次,每处理10个果。参照苏州科铭生物有限公司的-半乳糖苷酶试剂盒说明书,根据-半乳糖苷酶可分解对-硝基苯--D-吡喃半乳糖苷生成对-硝基苯酚,对-硝基苯酚在400 nm处有最大吸收峰的原理,通过测定吸光值升高速率计算猕猴桃果实的-半乳糖苷酶活性。
1.3 总RNA提取与cDNA合成
根据TIANGEN的RNAprep Pure Plant Kit(Beijing)试剂盒说明书提取猕猴桃的总RNA,经紫外分光光度计法和1.0%琼脂糖凝胶电泳法检测,质量合格的总RNA采用RevertAidTMFirst Strand cDNA Synthesis Kit(Thermo Scientific,USA)试剂盒逆转录为cDNA,作为-半乳糖苷酶基因扩增的模板。
1.4 引物合成与PCR扩增
从‘米良1号’猕猴桃果实软化的转录组数据库中筛选到2条差异表达的-半乳糖苷酶片段,它们分别比对到‘红阳’猕猴桃(var.‘Hongyang’)基因组数据库[21]中编号为Ach04g123061和Ach09g294421的-半乳糖苷酶序列。根据Ach04g123061和Ach09g294421的核苷酸序列信息,设计两对引物,分别为-F(5′-TGATATTGCTTCACACCCAGG-3′)和-R(5′-GTATTCTCGCTGTAACATTGTTG-3′),-F(5′-ATGTGGGTTCTGTGCAGATGTG-3′)和-R(5′-CTTGACTTACTCGCACTTGATTGG-3′)进行全长扩增验证。
PCR反应体系为:DreamGreen PCR Master Mix(2×)25 µL、上下游引物各2 µL、模板2 µL、补足无菌双蒸水至50 µL。PCR扩增条件为:94℃ 3 min;94℃ 30 s,53℃ 30 s(Gal1)/56℃ 30 s(Gal2),72℃ 140 s,循环35次;72℃ 10 min。PCR扩增产物经1.0%琼脂糖凝胶电泳分析,对符合预期大小的片段,采用®Quick Gel Extraction Kit(TransGen,Beijing)试剂盒进行回收纯化,并连接到pEASY-T1(TransGen,Beijing)载体上进行TA克隆,经菌液PCR检测后,随机挑选3个阳性克隆子送测序。
1.5 猕猴桃β-半乳糖苷酶基因的生物信息学分析
采用NCBI数据库的BLASTN和BLASTP功能分析猕猴桃和其他植物-半乳糖苷酶基因的同源性及功能结构域。利用在线软件ExPASy(http://web. expasy.org/protparam/)、ProtComp v9.0(http://linux1. softberry.com/berry.phtml?topic=protcomppl&group=programs&subgroup=proloc)、TMPred(https://embnet. vital-it.ch/software/TMPRED_form.html)、NetPhos 2.0(http://www. cbs.dtu.dk/services/NetPhos/)、SOMPA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?pag e=npsa_sopma.html)和Phyre2(http://www.sbg. bio.ic.ac.uk/phyre2/html/page.cgi?id=index)分别对猕猴桃-半乳糖苷酶基因编码蛋白的基本理化性质、亚细胞定位情况、跨膜结构、磷酸化位点、二级结构和三级结构进行预测分析。采用ClustalX软件对猕猴桃和其他植物的-半乳糖苷酶序列进行多重比对。应用psRNA Target(http://plantgrn.noble.org/ psRNATarget/)在线软件分析调控-半乳糖苷酶基因的miRNA,Expectation阈值为4.0,其他参数为默认值。应用Mega软件的邻位相连法(Neighbor Joining)构建猕猴桃与其他植物-半乳糖苷酶的分子系统进化树。采用Gene Structure Display Server(http://gsds.cbi.pku.edu.cn/)在线工具分析猕猴桃-半乳糖苷酶基因的外显子与内含子组成。
1.6 猕猴桃β-半乳糖苷酶基因的实时荧光定量PCR分析
各处理样品分别取500 ng总RNA作为模板,参照®All-in-One First-Strand cDNA Synthesis SuperMix for qPCR (One-Step gDNA Removal; TransGen, Beijing)说明书合成第一链cDNA。根据获得的2条-半乳糖苷酶基因序列设计荧光定量引物,分别为-QF(5′-CACAGAAGACGGATCGAGTAAAG-3′)和-QR(5′-GGGTGCGTCAAATGTAGTCTTA-3′)、-QF(5′-CGGTCTCTTGGAGCAACTAAA-3′)和-QR(5′-CGGCCTCCACTAAGAAATGAT-3′)。以猕猴桃Actin isoform B()基因作为内参基因,引物为-QF(5′-GTGCTCAGTGGTGGTTCAA -3′)和-QR(5′-GACGCTGTATTTCCTCTCAG -3′)[22]。
参照®Top Green qPCR SuperMix(TransGen, Beijing)说明书配置总体积为20 µL的实时荧光定量PCR反应液,包含10 µL的20×®Top Green qPCR SuperMix、0.6 µL的上下游引物、0.4 µL的Passive Reference DyeI(50×)、2 µL的模板,补足无菌双蒸水至20 µL。在Eppendorf荧光定量PCR仪上进行扩增,扩增程序为:94℃预变性30 s;94℃变性5 s,58℃退火15 s()/60℃退火15 s(),72℃延伸10 s,40个循环。PCR循环结束立即进行熔解,程序为94℃ 15 s,60℃ 15 s,再升温至94℃保持15 s。在Eppendorf的Mastercycler®ep realplex软件中自动生成标准曲线、熔解曲线和样品Ct值。每个样品重复3次。采用2-∆∆Ct法计算2个-半乳糖苷酶基因在各样品中的相对表达量,并应用Graphpad prism软件进行统计和One-way ANOVA分析。
2 结果
2.1 猕猴桃果实软化过程中的生理生化指标变化
为了分析猕猴桃果实软化过程中-半乳糖苷酶活性及其相关基因的变化,将猕猴桃果实软化过程划分为7个时期,分别为硬熟期、软化初期、软化I期、软化II期、软化III期、软化末期和软烂期(图1)。根据果实硬度和可溶性固形物含量的结果可知,猕猴桃果实硬度在软化过程中不断下降,而可溶性固形物含量逐渐升高(图2)。-半乳糖苷酶活性分析结果表明,在果实软化初期,-半乳糖苷酶活性略有降低,随着果实硬度的下降,-半乳糖苷酶活性逐渐升高,在软化III期时酶活性最高,进入软化末期时,-半乳糖苷酶活性降低,在软烂期时再次升高(图2)。

S1—S7:硬熟期(对照)、软化初期、软化I期、软化II期、软化III期、软化末期、软烂期,标尺:1 cm。下同

**表示差异极显著(<0.01)。下同
** indicate statistically significant differences at<0.01. The same as below
图2 猕猴桃果实软化过程的生理生化指标
Fig. 2 The physiological and biochemical indexes of kiwifruit during fruit softening
2.2 猕猴桃β-半乳糖苷酶基因的克隆与生物信息学分析
2.2.1 猕猴桃-半乳糖苷酶基因序列的获得与分析 以‘米良1号’猕猴桃果实的cDNA为模板,分别以-F/R和-F/R为引物,经RT-PCR扩增,得到2条分别为2 645 bp和2 182 bp的片段,测序结果经BLASTN分析显示,它们与NCBI数据库中已知的葡萄(,XM019216619.1和NM001281233.1)、芝麻(,XM011071084.2和XM011094524.2)、亚洲棉(,XM017789264.1和XM017756440.1)和可可(,XM018125599.1和XM007042021.2)等植物的-半乳糖苷酶基因具有很高的相似性(>70%),说明所获得的2条基因为猕猴桃-半乳糖苷酶基因,分别命名为和。进一步的序列分析显示,的开放阅读框(open reading frame,ORF)为2 280 bp,编码759个氨基酸(GenBank登录号为MH319788);的ORF为2 025 bp,编码674个氨基酸(GenBank登录号为MH319789)。
将和与‘红阳’猕猴桃基因组数据库中的同源-半乳糖苷酶序列(Ach04g123061和Ach09g294421)进行比对分析,结果显示,比Ach04g123061的ORF在中间多了2段插入序列(165 bp和60 bp),进而导致的转录终止密码子前移,而其余序列基本相同(图3);比Ach09g294421的ORF在中间也多了2段插入序列(180 bp和84 bp),其余序列基本一致(图4)。和的ORF相似性很低,仅43.49%,可见,猕猴桃-半乳糖苷酶基因家族不同成员间的序列差异较大,但不同猕猴桃品种间的同源-半乳糖苷酶基因具有较高的相似性,说明-半乳糖苷酶基因在猕猴桃不同品种间具有较高的保守性。

图3 Adβgal-1和Ach04g123061的ORF区序列比对
2.2.2编码蛋白的基本性质分析 蛋白的基本理化性质分析显示,Adgal-1的分子量为85.48 kD,等电点为7.88,不稳定系数为39.66,总亲水值为-0.376,说明Adgal-1具有亲水性,是稳定的碱性蛋白;Adgal-2的分子量为75.35 kD,等电点为5.83,不稳定系数为38.40,总亲水值为-0.280,说明Adgal-2也较稳定、具有亲水性,但属酸性蛋白。采用Softberry的ProtComp 9.0工具分析亚细胞定位情况,结果显示Adgal-1和Adgal-2均定位在胞外的可能性最大,分值分别为8.4和8.3。跨膜结构分析结果表明,Adgal-1含2个跨膜螺旋,优先跨膜模型为N末端朝外,而Adgal-2仅含有1个跨膜螺旋,优先跨膜模型为N末端向内,Adgal-1和Adgal-2均具有跨膜结构域,可进行跨膜运输。综上,推测Adgal-1和Adgal-2可通过跨膜的方式运输到胞外行使功能。
磷酸化修饰是基因在翻译后水平表达的重要调控方式,对猕猴桃-半乳糖苷酶蛋白的磷酸化位点分析结果显示,Adgal-1的磷酸化位点均匀地分布在整条肽链上,共包含45个丝氨酸磷酸化位点、26个苏氨酸磷酸化位点和16个酪氨酸磷酸化位点;而Adgal-2的磷酸化位点主要分布在第300—674个氨基酸的肽链上,共包含有34个丝氨酸磷酸化位点、19个苏氨酸磷酸化位点和9个酪氨酸磷酸化位点;说明Adgal-1和Adgal-2在翻译后水平的表达调控不同。蛋白二级结构分析表明,Adgal-1含有24.90% α-螺旋、21.74%延伸链、8.70%-折叠和44.66%自由卷曲;而Adgal-2含有20.03% α-螺旋、22.55%延伸链、6.53%-折叠和50.89%自由卷曲,且Adgal-1和Adgal-2蛋白的三维空间构型存在明显差异,暗示它们行使的具体功能不同。
在NCBI数据库进行BLASTP分析显示,Adgal-1和Adgal-2均含有植物糖苷水解酶家族35的功能结构域(Glyco_hydro_35)。多重序列比对分析结果如图5所示,与其他植物的-半乳糖苷酶一样,猕猴桃Adgal-1含有保守基序GGPIILSQIENEY;而Adgal-2中,该保守基序的第7个氨基酸由丝氨酸(S)变为脯氨酸(P),香蕉Mugal中则由丝氨酸(S)变为苏氨酸(T),该基序与-半乳糖苷酶的活性催化相关。
2.2.3 调控的miRNA预测与分析 miRNAs作为一类非编码RNA,通过调控靶基因的表达水平,进而参与植物的生长发育、衰老和逆境胁迫等过程。采用在线工具psRNA Target[23]和猕猴桃果实miRNA数据库(未发表)对调控和的miRNA进行预测分析,结果表明的表达受miR408d、miR408b、miR393a-3p的调控,miR408d、miR408b和miR393a-3p均通过裂解靶基因mRNA的方式调控的表达;的表达则受miR396g-5p的调控,miR396g-5p通过抑制靶基因翻译的方式调控的表达。
2.2.4 猕猴桃的系统进化分析 为了分析猕猴桃的系统进化,以放线菌-半乳糖苷酶序列作为外群,采用Mega软件的邻位相连计算法对猕猴桃和其他25种植物的-半乳糖苷酶序列进行聚类分析,结果如图6所示,植物-半乳糖苷酶共聚为两大分支(A和B),A和B分支均包含2个小分支,即单子叶植物分支和双子叶植物分支。猕猴桃Adgal-1聚在A分支的双子叶植物分支,与芝麻的亲缘关系近;Adgal-2则聚在B分支的双子叶植物分支,与核桃的亲缘关系近。说明猕猴桃Adgal-1和Adgal-2属于植物-半乳糖苷酶家族的不同成员,可能由两个不同的-半乳糖苷酶基因祖先进化而来,而且它们具有明显的种属特征,在进化上较为保守。

图4 Adβgal-2和Ach09g294421的ORF区序列比对

一致性为100%的氨基酸序列用黑色阴影表示,一致性较低的用灰色阴影表示,糖苷水解酶家族35的保守基序用方框标出
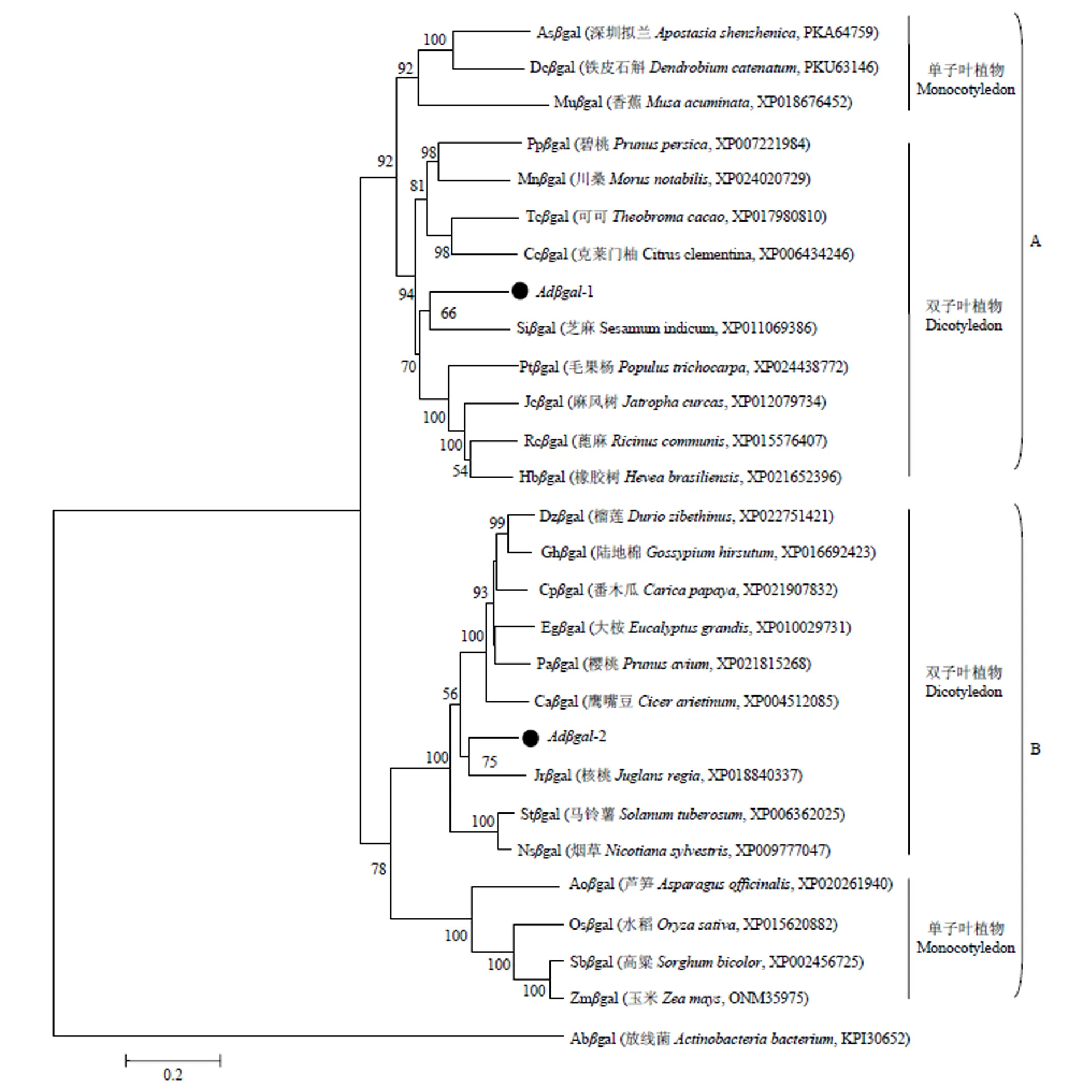
分支节点的数字表示Bootstrap验证中基于1000次重复时该节点的可信度的百分比。标尺表示分支长度
2.2.5 猕猴桃的基因结构分析 如图7所示,由18个外显子和17个内含子组成,外显子的大小在67—297 bp,内含子大小在74—4 611 bp;由17个外显子和16个内含子组成,外显子的大小在67—203 bp,内含子大小在76—960 bp。内含子剪切位点分析结果表明,和的所有内含子均在“GT-AG”处剪切,这与真核生物内含子的剪接规律一致。
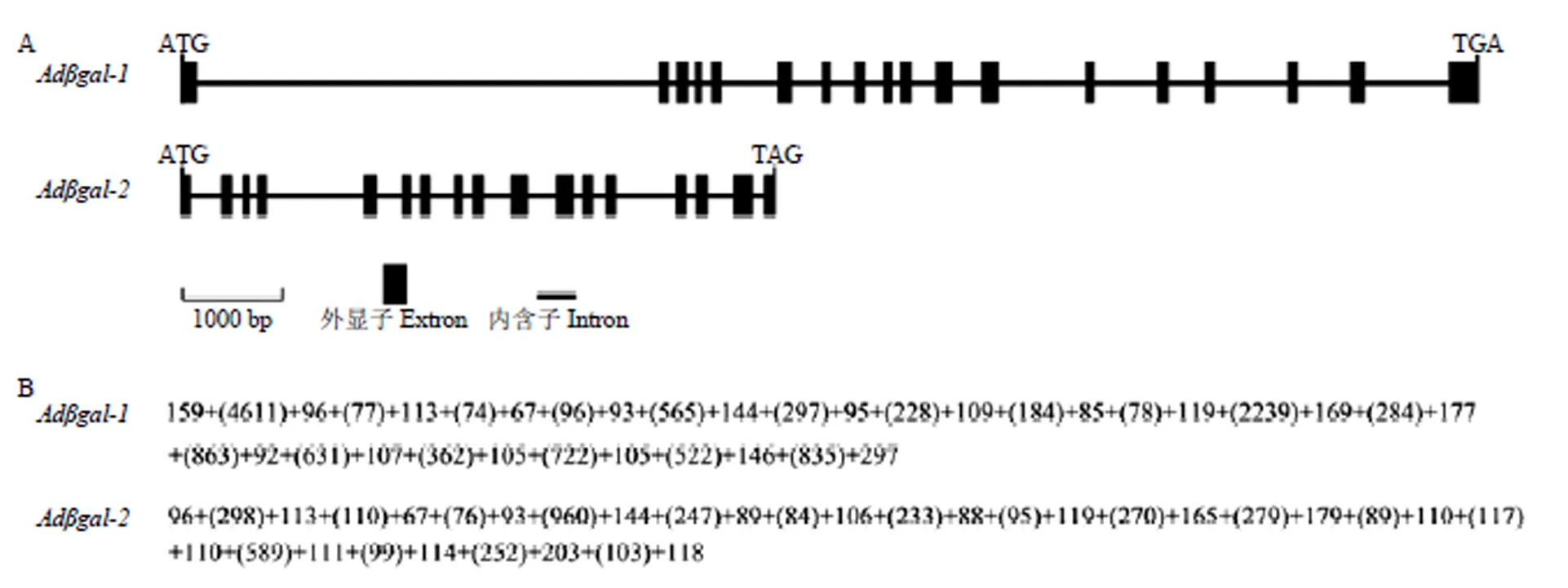
A:猕猴桃Adβgal的外显子与内含子组成。B:Adβgal的外显子与内含子大小,内含子长度用括号标注,长度单位(bp)
2.3 Adβgal的表达特征
2.3.1在猕猴桃不同组织部位的表达模式 实时荧光定量PCR分析结果如图8所示,和在猕猴桃的各组织部位(根、茎、叶、花、幼果和成熟果)均有表达,但表达水平存在明显差异。在叶中的表达量最高,其次是根、幼果、花、茎和成熟果;而在幼果中的表达水平最高,其次是茎、根、花、叶和成熟果。

图8 猕猴桃Adβgal基因在不同组织部位的相对表达量
2.3.2在猕猴桃果实软化中的表达模式和均在果实软化初期上调表达,其中的表达量上调了38倍,的表达量上调了8倍。随着果实的进一步软化(果实硬度的下降),和的转录水平持续增加;的表达量在软化末期达到最大值,是硬熟期表达量的679倍;而的表达量在软化III期时达到最大值,是硬熟期表达量的42倍;说明和均从软化初期开始参与猕猴桃果实的软化(图9)。
2.3.3 不同贮藏温度对猕猴桃果实表达的影响 温度影响猕猴桃果实的软化进程,为了明确不同温度对猕猴桃β-半乳糖苷酶基因表达的影响,采用qPCR法进行分析,结果如图10所示。猕猴桃果实在25℃贮藏过程中,和呈现相似的表达模式。和均在25℃贮藏3 d时上调表达,随着时间的推移,表达水平持续增加,在9 d时达最大值,表达量分别是硬熟期(对照)表达量的940倍和149倍,在11 d时,表达量明显下降至硬熟期的4.4倍和1.4倍。
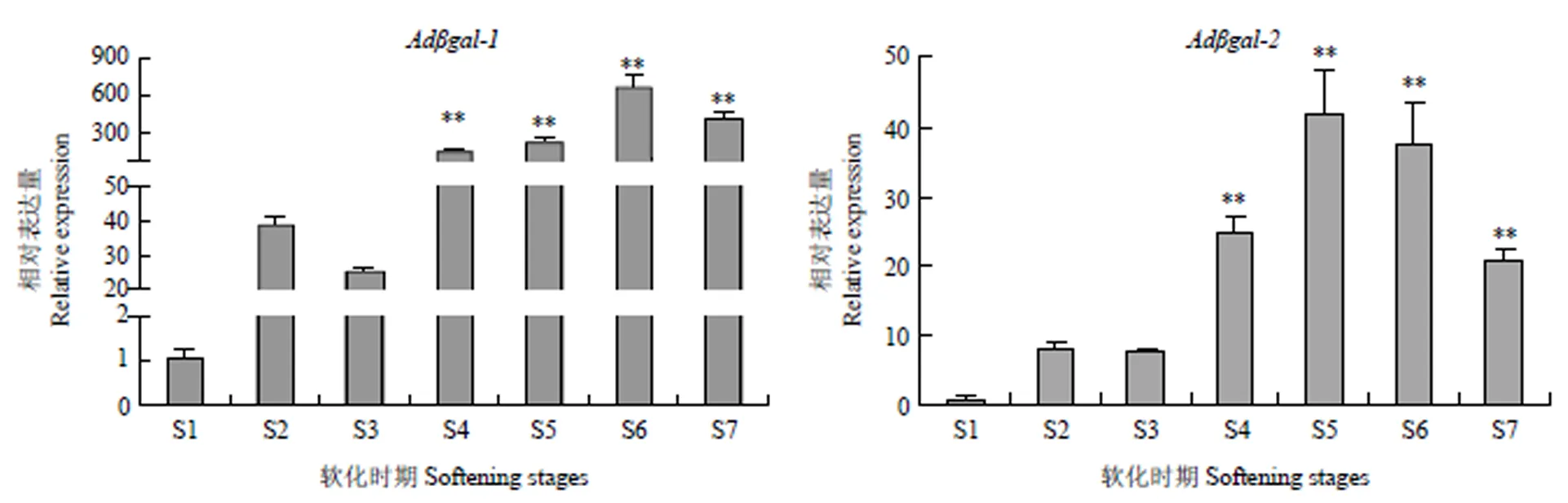
图9 猕猴桃Adβgal在果实软化过程的相对表达量

*表示差异显著(P<0.05)indicates statistically significant differences at P<0.05
猕猴桃果实在4℃贮藏过程中,和的表达模式不同。在4℃贮藏的整个过程均下调表达。的表达量随4℃贮藏时间的推移呈波浪式,在4℃贮藏7 d时显著增加,表达量是硬熟期(对照)表达量的7.4倍,之后下降至对照水平,在14 d时再次显著升高至对照的3.8倍,之后一直维持在较高的表达水平。
2.3.4 ABA处理对猕猴桃果实表达的影响 外源ABA处理促进猕猴桃果实的软化。实时荧光定量PCR分析结果如图11所示,和在ABA处理过的果实中上调表达。在ABA处理后1 d,表达量是对照的4.5倍,并维持该表达水平,至7 d时进一步上升,在9 d时达到最大值(为对照表达量的43.7倍)。在ABA处理后3 d显著上调(为对照表达量的22.3倍),5 d时降至对照表达量的5.1倍,7 d时再次升高并达到最大值(为对照表达量的29.9倍),9 d时的表达量是对照的27.6倍。可见,和在猕猴桃果实中的表达受ABA的诱导。

图11 猕猴桃Adβgal基因在ABA处理果实中的相对表达量
3 讨论
3.1 猕猴桃2个Adβgal的序列特征
植物-半乳糖苷酶基因家族含有多个成员,根据氨基酸序列长度和结构域差异分为2个类群,类群I编码712—731个氨基酸,C端不含半乳糖结合的凝集素结构域(Gal_lectin),类群II编码832—888个氨基酸,C端含凝集素结构域(Gal_lectin)[5]。本研究获得的2个分别编码759个和674个氨基酸,均含有植物糖苷水解酶家族35的功能结构域(Glyco_hydro_35)和保守基序,但不含凝集素结构域(Gal_lectin),因而它们应归类于植物-半乳糖苷酶家族的类群I。然而,和的序列具有较大差异(相似性仅43.49 %),在系统进化树中处于两个不同分支,推测它们由不同的-半乳糖苷酶基因祖先进化而来。油菜-半乳糖苷酶家族基因由11—19个外显子和10—18个内含子组成[24]。猕猴桃和分别含有18个和17个外显子,这与油菜-半乳糖苷酶家族的基因结构类似。虽然和编码的蛋白都是稳定的亲水性蛋白,但它们的磷酸化修饰位点、蛋白的二级结构和三级结构均存在明显差异,说明和行使的具体功能存在差异。
3.2 猕猴桃2个Adβgal在各组织中差异表达
植物β-半乳糖苷酶家族基因的不同成员在各组织器官中的表达模式不同。鳄梨的转录本仅在果实中检测到,且随着果实成熟不断积累;在叶、芽、根和果实中均有表达,且参与果实成熟过程;仅在根中表达,但短时气调贮藏诱导果实中表达;转录物在所有组织中都能检测到(除了果实)[25]。植物-半乳糖苷酶基因在不同组织器官的差异表达与其行使的特定功能有关。陆地棉在棉纤维的伸长阶段高表达,可能参与原代细胞壁的代谢[14]。拟南芥在生长发育末期的基部节间和叶片末端高表达,且受表油菜素内脂和H3BO3诱导,说明其参与细胞壁变化,导致伸长停止和刚性增强[26]。矮牵牛花瓣中的-半乳糖苷酶基因被抑制表达,可防止果胶半乳糖降解,导致开花时的花瓣完整性降低[27]。因而,-半乳糖苷酶广泛存在于植物的各组织中,参与植物的生长、花发育和果实成熟等一系列生理生化过程。本研究获得的和在猕猴桃的各组织部位(根、茎、叶、花、幼果和成熟果)均有表达,但表达水平存在明显差异,这与它们的氨基酸序列、基因结构及编码蛋白的磷酸化位点和高级结构不同相符,说明它们行使的具体功能不同。综上所述,本研究获得的和并非在果实中特异表达,它们可能还参与根、茎、叶和花的多种生理生化进程。
3.3 Adβgal-1和Adβgal-2参与猕猴桃果实的软化进程
本研究中,-半乳糖苷酶活性在‘米良1号’(美味猕猴桃)果实软化过程呈“降-升-降-升”的特征,且在果实软化中期酶活性最高。这与陈昆松等[20]对中华猕猴桃果实后熟过程的-半乳糖苷酶活性分析结果类似,中华猕猴桃果实在采收时,-半乳糖苷酶活性较高,随后略下降,乙烯跃变期间酶活性最高,之后下降。转录水平分析结果表明和均在‘米良1号’果实软化初期上调表达,随着果实硬度的下降,基因表达量持续增加,直至软烂期,表达量仍维持在较高水平。在果实软化过程中,和虽然在转录水平的变化与酶活性变化并非一一对应,但总体都表现为升高,说明和从软化初期开始参与果实软化过程中细胞壁的降解。
冷藏是延长果实贮藏期的高效手段,低温贮藏是目前应用最普遍的猕猴桃保鲜措施[28]。和在25℃贮藏的猕猴桃果实中呈现相似的表达模式,均在25℃贮藏3 d时上调表达,随着时间的推移,表达水平持续增加。而在4℃贮藏的猕猴桃果实中,其的表达水平始终低于硬熟期的表达水平,的表达量随4℃贮藏时间的推移呈“升-降-升-降-升”模式,但较25℃贮藏相同时间点的表达量低很多。本课题组早期对不同贮藏条件下‘米良1号’果实硬度的分析表明,与贮藏0 d相比,低温贮藏7、14和28 d时果实硬度下降缓慢,室温贮藏7 d时果实硬度下降了90.63%[29]。猕猴桃果实硬度在不同贮藏温度下的下降速度与相同条件下的表达量变化相似。徐秋红[30]对中国李的采后贮藏研究也表明,低温可以推迟转录高峰的出现。除β-半乳糖苷酶基因外,低温处理还可下调猕猴桃木葡聚糖内糖基转移酶(XET)的mRNA,抑制细胞壁解聚,延缓果实软化[31]。因而,低温对猕猴桃果实软化进程的延缓作用可能是通过抑制β-半乳糖苷酶等细胞壁降解酶基因的表达而实现的。
猕猴桃属于呼吸跃变型果实,但乙烯跃变峰出现在果实完熟之后[32]。猕猴桃果实在采后初期,ABA含量增加明显,其峰值出现的时间比乙烯跃变峰早很多,因而认为ABA在猕猴桃采后软化中的作用更重要[33]。外源ABA处理猕猴桃果实可以提高内源ABA含量,加速果实软化[32]。实时荧光定量PCR结果表明,和在25℃贮藏3 d才上调表达,而在ABA处理后贮藏1 d就上调表达。说明和的表达受ABA的诱导。因此,ABA对猕猴桃果实软化进程的促进作用是通过诱导-半乳糖苷酶等细胞壁降解酶基因的上调表达而实现的。此外,的表达受miR408d、miR408b、miR393a-3p的调控,而的表达则受miR396g-5p的调控。和在转录和翻译水平的表达受不同miRNA的调控,可能与其在特定条件(低温、ABA处理)下的表达模式差异有关,但仍需进一步的试验验证,今后将采用基因编辑等方法进一步明确这些miRNA在果实软化中的作用,及其对和的调控模式。
4 结论
克隆得到2个新的猕猴桃-半乳糖苷酶基因(和),它们均含有植物糖苷水解酶家族35的功能结构域和保守基序,但它们的基因结构不同,在进化树中聚在不同的分支。酶活性和荧光定量PCR分析结果表明,和均从果实软化初期开始通过上调基因表达量,提高-半乳糖苷酶活性的方式参与猕猴桃果实的软化进程。
[1] MCATEE P A, RICHARDSON A C, NIEUWENHUIZEN N J, GUNASEELAN K, HOONG L, CHEN X, ATKINSON R G, BURDON J N, DAVID K M, SCHAFFER R J. The hybrid non-ethylene and ethylene ripening response in kiwifruit () is associated with differential regulation of MADS-box transcription factors., 2015, 15(1): 304.
[2] 黄文俊, 钟彩虹. 猕猴桃果实采后生理研究进展. 植物科学学报, 2017, 35(4): 622-630.
HUANG W J, ZHONG C H. Research advances in the postharvest physiology of kiwifruit., 2017, 35(4): 622-630. (in Chinese)
[3] 李东, 谭书明, 邓毅, 张程榕, 蒋想. 猕猴桃采前处理保鲜技术研究进展. 食品工业, 2015, 36(8): 251-255.
LI D, TAN S M, DENG Y, ZHANG C R, JIANG X. Advances in preharvest preservation methods for kiwifruit., 2015, 36(8): 251-255. (in Chinese)
[4] 朱明月, 沈文涛, 周鹏. 果实成熟软化机理研究进展. 分子植物育种, 2005, 3(3): 421-426.
ZHU M Y, SHEN W T, ZHOU P. Research advances on mechanism of fruit ripening and softening., 2005, 3(3): 421-426. (in Chinese)
[5] 田爱梅, 刘金龙, 曹家树. 植物β-半乳糖苷酶. 中国细胞生物学学报, 2014, 36(5): 703-707.
TIAN A M, LIU J L, CAO J S. Beta galactosidase in plants., 2014, 36(5): 703-707. (in Chinese)
[6] 陆胜民, 席玙芳, 张耀洲. 梅果采后软化与细胞壁组分及其降解酶活性的变化. 中国农业科学, 2003, 36(5): 595-598.
LU S M, XI Y F, ZHANG Y Z. Softening of green mume flesh and changes of cell wall components and activities of their degrading enzymes during the postharvest period., 2003, 36(5): 595-598. (in Chinese)
[7] DAWSON D M, MELTON L D, WATKINS C B. Cell wall changes in nectarines (): Solubilization and depolymerization of pectic and neutral polymers during ripening and in mealy fruit., 1992, 100: 1203-1210.
[8] LIDSTER P D, MCRAE K B, DICK A J. Effects of a vacuum infusion of a partially purified beta-galactosidase inhibitor on apple quality., 1985, 20: 80-82.
[9] 庄军平, 苏菁, 陈维信. 香蕉果实β-半乳糖苷酶基因cDNA克隆及序列分析. 西北植物学报, 2006, 26(1): 18-22.
ZHUANG J P, SUN J, CHEN W X. cDNA cloning and sequencing of β-galactosidase genes in banana (spp.) fruit., 2006, 26(1): 18-22. (in Chinese)
[10] 周厚成, 李刚, 赵霞, 郭蔼光. 草莓β-半乳糖苷酶基因的克隆与表达分析. 西北植物学报, 2015, 35(12): 2385-2390.
ZHOU H C, LI G, ZHAO X, GUO A G. Cloning and expression analysis ofof β-galactosidase family fromfruit., 2015, 35(12): 2385-2390. (in Chinese)
[11] 吕燕荣, 任小林, 周会玲. 枣果实β-半乳糖苷酶基因的克隆及表达分析. 西北植物学报, 2011, 31(7): 1318-1325.
LÜ Y R, REN X L, ZHOU H L. Cloning and expressing analysis of β-galactosidase gene in jujube fruit., 2011, 31(7): 1318-1325. (in Chinese)
[12] 高山, 陈桂信, 许端祥, 林碧英, 林义章, 潘东明. 苦瓜果实β-半乳糖苷酶基因的克隆、表达及亚细胞定位. 植物遗传资源学报, 2013, 14(6): 1124-1129.
GAO S, CHEN G X, XU D X, LIN B Y, LIN Y Z, PAN D M. Cloing, expression and subcellular localization of β-galactosidase gene fromL. fruit., 2013, 14(6): 1124-1129. (in Chinese)
[13] 卞伟华, 江昌俊, 王朝霞. 桃叶片β-半乳糖苷酶基因全长cDNA克隆及原核表达. 园艺学报, 2006, 33(4): 721-725.
BIAN W H, JIANG C J, WANG Z C. Cloning and expression of β-galactosidase gene cDNA in peach., 2006, 33(4): 721-725. (in Chinese)
[14] ZHANG H M, LIU J Y. Molecular cloning and characterization of a β-galactosidase gene expressed preferentially in cotton fibers., 2005, 47(2): 223-232.
[15] 何玮毅, 陈晓静, 申艳红, 卢秉国. 番木瓜基因的克隆分析与植物表达载体构建. 热带作物学报, 2010, 31(2): 217-223.
HE W Y, CHEN X J, SHEN Y H, LU B G. Isolation of a papayagene and construction of plant expresson vector., 2010, 31(2): 217-223. (in Chinese)
[16] BAN Q, HAN Y, MENG K, HOU Y, HE Y, RAO J. Characterization of β-galactosidase genes involved in persimmon growth and fruit ripening and in response to propylene and 1-methylcyclopropene., 2016, 35(4): 1025-1035.
[17] TATEISHI A, NAGASHIMA K. Differential expression of members of the beta-galactosidase gene family during Japanese pearL.) fruit growth and on-tree ripening., 2005, 130(6): 819-829.
[18] PANIAGUA C, BLANCO-PORTALES R, BARCELO-MUNOZ M, CARCIA-GAGO J A, WALDRON K W, QUESADA M A, MUNOZ-BLANCO J, MERCADO J A. Antisense down-regulation of the strawberry β-galactosidase geneincreases cell wall galactose levels and reduces fruit softening., 2016, 67(3): 619-631.
[19] ROSS G S, REDGWELL R J, MACRAE E A. Kiwifruit β-galactosidase: Isolation and activity against specific fruit cell-wall polysaccharides., 1993, 189(4): 499-506.
[20] 陈昆松, 张上隆, Ross Gavin S. β-半乳糖苷酶基因在猕猴桃果实成熟过程的表达. 植物生理学报, 2000, 26(2): 117-122.
CHEN K S, ZHANG S L, Ross G S. Expression pattern of β-galactosidase gene in ripeningfruit., 2000, 26(2): 117-122. (in Chinese)
[21] HUANG S X, DING J, DENG D, TANG W, SUN H, LIU D, ZHANG L, NIU X, ZHANG X, MENG M, YU J, LIU J, HAN Y, SHI W, ZHANG D, CAO S, WEI Z, CUI Y, XIA Y, ZENG H, BAO K, LIN L, MIN Y, ZHANG H, MIAO M, TANG X, ZHU Y, SUI Y, LI G, SUN H, YUE J, SUN J, LIU F, ZHOU L, LEI L, ZHENG X, LIU M, HUANG L, SONG J, XU C, LI J, YE K, ZHONG S, LU B, HE G, XIAO F, WANG H, ZHENG H, FEI Z, LIU Y. Draft genome of the kiwifruit., 2013, 4. doi: 10.1038/ ncomms3640.
[22] 张慧琴, 鸣谢, 肖金平, 周利秋, 宋根华. 猕猴桃实时荧光定量PCR分析中内参基因的筛选. 浙江农业学报, 2015, 27(4): 567-573.
ZHANG H Q, XIE M, XIAO J P, ZHOU L Q, SONG G H. Screening of reference genes for real-time quantitative PCR in kiwifruit., 2015, 27(4): 567-573. (in Chinese)
[23] DAI X, ZHAO P X. psRNATarget: A plant small RNA target analysis server., 2011, 39(suppl 2): W155-W159.
[24] LIU J H, GAO M H, LV M L, CAO J S. Structure, evolution, and expression of the β-galactosidase gene family inssp.., 2013, 31(6): 1249-1260.
[25] TATEISHI A, SHIBA H, OGIHARA J, ISOBE K, NOMURA K, WATANABE K, INOUE H. Differential expression and ethylene regulation of β-galactosidase genes and isozymes isolated from avocado (Mill.) fruit., 2007, 45(1): 56-65.
[26] MONEO-SANCHEZ M, IZQUIERDO L, MARTIN I, LABRADOR E, DOPICO B. Subcellular location ofsubfamily a1 β-galactosidases and developmental regulation of transcript levels of their coding genes., 2016, 109: 137-145.
[27] O'Donoghue E M., SOMERFIELD S D, DEROLES S C, SUTHERLAND P W, HALLETT I C, ERRIDGE Z A, BRUMMELL D A, HUNTER D A. Simultaneous knock-down of six β-galactosidase genes in petunia petals prevents loss of pectic galactan but decreases petal strength., 2017, 13: 208-221.
[28] 张美芳, 何玲, 张美丽, 郭宇欢. 猕猴桃鲜果贮藏保鲜研究进展. 食品科学, 2014, 35(11): 343-347.
ZHANG M F, HE L, ZHANG M L, GUO Y H. Advances in preservation method for kiwifruit., 2014, 35(11): 343-347. (in Chinese)
[29] 陈义挺, 赖瑞联, 程春振, 冯新, 屈蒙蒙, 刘萍元, 陈文光, 吴如健. 猕猴桃果实软化过程中基因的克隆与表达. 农业生物技术学报, 2017, 25(2): 205-213.
CHEN Y T, LAI R L, CHENG C Z, FENG X, QU M M, LIU P Y, CHEN W G, WU R J. Cloning and expression of polygalacturonase gene () during fruit softening of kiwifruit ()., 2017, 25(2): 205-213. (in Chinese)
[30] 徐秋红. 中国李果实软化相关基因的克隆及表达分析[D]. 南京: 南京农业大学, 2009.
XU Q H. Isolation and expression of genes related to Chinese plum fruit softening [D]. Nanjing: Nanjing Agruicultural University, 2009.
[31] 陈昆松, 李方, 张上隆. 猕猴桃果实成熟进程中木葡聚糖内糖基转移酶mRNA水平的变化. 植物学报, 1999, 41(11): 1231-1234.
CHEN K S, LI F, ZHANG S L. The expression pattern of xyloglucan endotransglycosylase gene in fruit ripeing of., 1999, 41(11): 1231-1234. (in Chinese)
[32] 陈昆松, 李方, 张上隆, Ross Gavin S. ABA和IAA对猕猴桃果实成熟进程的调控. 园艺学报, 1999, 26(2): 81-86.
CHEN K S, LI F, ZHANG S L, ROSS G S. Role of abscisic acid and indole-3-acetic acid in kiwifruit ripening., 1999, 26(2): 81-86. (in Chinese)
[33] 陈昆松, 张上隆, 吕均良, 陈青俊. 脱落酸、吲哚乙酸和乙烯在猕猴桃果实后熟软化进程中的变化. 中国农业科学, 1997, 30(2): 54-57.
CHEN K S, ZHANG S L, LÜ J L, CHEN Q J. Variation of abscisic acid, indole-3-acetic acid and ethylene in kiwifruit during fruit ripening., 1997, 30(2): 54-57. (in Chinese)
Cloning ofandGenes and Their Roles during Fruit Softening of Kiwifruit
FENG Xin, LAI RuiLian,GAO MinXia,CHEN WenGuang, WU RuJian, CHEN YiTing
(Fruit Research Institute, Fujian Academy of Agricultural Sciences/Research Centre for Engineering Technology of Fujian Deciduous Fruits, Fuzhou 350013)
【Objective】Beta-galactosidase is one type of glycosidases involving in cell wall degradation, which plays an important role in plant growth and fruit ripening and softening. In this paper, the identification and expression analysis of two-galactosidase genes in kiwifruit, as well as their functions during fruit softening, were carried out to provide new insights for the mechanism of kiwifruit softening.【Method】var.‘Miliang-1’ was used as material to amplify the-galactosidase genes by RT-PCR, then their characteristics, functional domains, phylogenetic relationships, gene structures and miRNAs were analyzed by using online databases. qRCR was applied to analyze their expression patterns in different tissues, different stages of softening, different storage temperatures, and ABA treatment. Enzymes activities were also analyzed to clarify the function of these two-galactosidase genes during fruit softening.【Results】Two-galactosidase genes (and) were obtained from kiwifruit. Their accession numbers were MH319788 and MH319789, respectively.had an open reading frame (ORF) of 2 280 bp and encoded 759 amino acids, while the ORF ofwas 2 025 bp encoding 674 amino acids. Protein domain analysis showed that both Adgal-1 and Adgal-2 harbored a functional domain (Glyco_hydro_35) of plant glycoside hydrolase family 35. Gene organization analysis revealed thathad 18 exons and 17 introns, whileharbored 17 exons and 16 introns. Moreover, Adgal-1 and Adgal-2 were clustered in different evolutionary branching in the phylogenetic tree, which was due to the great difference in their sequences. This implied thatandmight originate from different ancestral genes. qPCR analysis showed thatandwere expressed in all tested tissues (root, stem, leaf, flower, young fruit and ripe fruit) although their expression levels were different. The expression levels of bothandwere increased at the start stage of fruit softening, and the amount of gene expression continued to increase as the firmness of fruit decreased. When stored at 25℃, both theandwere upregulated at 3 d, and the amount of gene expression continued to increase as time over. When stored at 4℃, the expression ofwas inhabited, while that ofwas like wavy. ABA induced the expression ofand.【Conclusion】Bothandparticipated in the process of fruit softening of kiwifruit. The effect of storage temperatures and ABA on fruit softening might be achieved by changing the expression of-galactosidase genes.
; beta-galactosidase genes; fruit softening; enzyme activity; gene expression
10.3864/j.issn.0578-1752.2019.02.010
2018-07-01;
2018-11-12
福建省自然科学基金(2018J05051、2017J01044)、福建省属公益类科研院所基本科研专项(2018R1013-2、2015R1014-3)、福建省农业科学院青年英才计划(YC2017-2)、福建省农业科学院科技创新团队建设项目(STIT2017-3-6)、福建省农业科学院博士科研启动基金(DC2017-2)
冯新,E-mail:fengxin1506@163.com。通信作者陈义挺,E-mail:fujiankiwifruit@163.com
(责任编辑 赵伶俐)
