挤压协同酶法制备高粱蛋白ACE抑制肽及其稳定性
2019-01-28周剑敏尹方平于晨汤晓智
周剑敏,尹方平,于晨,汤晓智
挤压协同酶法制备高粱蛋白ACE抑制肽及其稳定性
周剑敏,尹方平,于晨,汤晓智
(南京财经大学食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心/江苏高校粮油质量安全控制及深加工重点实验室,南京 210023)
【目的】利用挤压协同酶法制备高粱蛋白ACE抑制肽,为提高高粱蛋白资源的利用效率提供参考。【方法】以高粱粉为原料,先经挤压处理,再经淀粉酶酶解,最后通过碱性蛋白酶酶解,获得高粱蛋白ACE抑制肽。研究物料水分、挤压温度和淀粉酶活力对高粱蛋白酶解液的水解度和ACE抑制活性的影响,并探讨高粱蛋白ACE抑制肽的稳定性。【结果】随着物料水分含量和挤压温度的增加,挤压过程中单位机械能耗()逐渐降低。在挤压环境下,高粱中淀粉和蛋白质的相互结合变得松散,淀粉-蛋白质包埋体系被破坏;同时高粱中球形蛋白质体被打破,提高所获得高粱蛋白的酶敏感性,在碱性蛋白酶的作用下生成更多具有抑制活性的短肽。挤压过程中物料水分含量和挤压温度以及α-淀粉酶活力对高粱蛋白酶解液的水解度和ACE抑制率有显著影响。随着物料水分的增加,蛋白质分子的聚合程度下降,使得高粱蛋白酶解液的水解度和ACE抑制率随之增加,当物料水分增加至19%后,挤压过程对蛋白质周围的淀粉分子的破坏作用降低,水解度和ACE抑制率的上升趋势趋于平缓;当挤压温度从120℃增加至180℃时,高粱内部的蛋白质-淀粉包埋体系破坏加剧,同时蛋白质的空间结构在高温作用下的变性程度加大,高粱蛋白酶解液的水解度由7.42%增加至11.06%,同时高粱蛋白ACE抑制肽的抑制率也由46.57%增加至53.41%;挤压后高粱粉经α-淀粉酶处理,进一步去除包裹在蛋白质周围的淀粉,发现随着α-淀粉酶活力的增加,高粱内部的蛋白质-淀粉包埋体系破坏程度加剧,为制备高粱蛋白ACE抑制肽提供更多原料,导致高粱蛋白酶解液的水解度和ACE抑制率随之增加,当α-淀粉酶活力增加至2.0 U·g-1时,淀粉酶与淀粉结合达到饱和状态,水解度和ACE抑制率趋于稳定。高粱蛋白ACE抑制肽经温度和酸碱处理后,ACE抑制活性在68.1%—71.31%,保持了良好的抑制活性;高粱蛋白ACE抑制肽在体外经胃肠道酶系消化酶解后,ACE抑制活性均高于73%,依然保持了较强的ACE抑制活性,说明挤压协同酶法制备的高粱蛋白ACE抑制肽具有长期保存有效性,同时能够在胃肠道消化后保持生物活性。【结论】采用挤压协同酶法可以显著提高高粱蛋白酶解液的水解度和ACE抑制肽的活性,同时制备的高粱蛋白ACE抑制肽具有良好的稳定性,为拓宽高粱的利用和制备功能性食品配料提供了一条新途径。
挤压;淀粉酶;高粱蛋白ACE抑制肽;稳定性
0 引言
【研究意义】高粱是人类栽种的重要谷类作物之一。高粱种植面积和总产量位居世界第五。高粱的淀粉和蛋白质含量比例高于玉米、小麦和水稻等其他谷物[1]。其中淀粉含量约为65%—70%,蛋白质含量约为8%—11%[2]。此外,高粱还含有多种生理活性组分,如多酚、类黄酮等,这些组分有很强的抗氧化能力[3-4],有助于降低某些慢性非传染疾病的发病风险,如肥胖症、糖尿病、心血管疾病、高血压、癌症等。所以对于消费者而言,高粱可以作为能量、蛋白质、维生素和矿物质等营养物质的主要来源。然而,与其他禾谷类作物相比,高粱中存在单宁等抗营养因子,使高粱的营养价值降低,感官质量变差[5]。同时,蛋白质之间的二硫键和蛋白质与淀粉基质之间的相互作用使高粱的蛋白质消化率降低[6],特别是经过蒸煮后变得更加不易消化[7-8],这也降低了高粱的营养价值。高营养含量、低营养价值这一特点限制了高粱的食用及在食品工业和动物饲料工业中的应用。目前,在我国高粱生产主要应用于酿酒,在食品工业其他领域中的应用几乎处于空白。这就可能造成高粱种质资源尤其是蛋白质资源的极大浪费。【前人研究进展】长期以来,食源性活性肽的研究与开发一直受到科学家们的高度关注[9-12],特别是食源性血管紧张素转换酶(ACE)抑制肽[13-15]。与合成的ACE抑制肽相比,食源性ACE抑制肽具备食用安全性高、低毒副作用、降压效果温和专一以及对血压正常者无任何不良影响等优势,受到研究者的广泛关注,成为控制和治疗高血压研究的热点[16]。食源性ACE抑制肽主要分为乳蛋白源[17-19]、水产品蛋白源[20-22]和植物蛋白源[13,23,24]三种。最近有部分研究者从鸡肌肉[25]和蚕蛹[26]中分离纯化出ACE抑制肽。用于制备ACE抑制肽的植物蛋白源主要有花生[27]、菜籽[28]、棉籽[29]、米糠[30]和玉米[31]等,其中玉米被认为是制备ACE抑制肽的良好来源。高粱蛋白和玉米蛋白在结构和组成上具有高度相似性[32],因此,以高粱蛋白作为原材料制备活性多肽具有一定可行度,也已经有了一定的研究基础。Kamath等[33]用胰凝乳蛋白酶水解高粱醇溶蛋白后,从水解液中分离得到4种具有ACE抑制活性的组分;杜金娟[34]以甜高粱为原料提取蛋白质分离纯化得到ACE 抑制肽,发现甜高粱ACE抑制肽中含量和活性最高的肽链氨基酸序列为Thr-Ile-Ser或Thr-Leu-Ser;Wu等[35]以甜高粱蛋白为原料酶解制备ACE抑制肽并认为ACE抑制活性主要来源于肽链段末端的丝氨酸(Ser);Camargo等[36]从高粱蛋白中分离纯化出一种分子量为2 kD的抗病毒肽。我国丰富的高粱蛋白资源为高粱活性肽的研究提供了条件,但由于高粱蛋白提取困难,使关于高粱蛋白活性多肽的报道也相对较少。挤压加工是在热能和机械能的作用下,连续的压挤、剪切、混合、蒸煮、物料塑性化的加工方式,是一项占地空间少,生产周期短,能源利用率高,废弃物和副产品少,易于实现连续化作业的节能环保绿色技术[37]。Batterman等[38]研究了挤压加工与玉米蛋白质体的关系,发现当直接机械能达到165 kJ·kg-1时,球形的蛋白质体能够被打破。由于玉米蛋白与高粱蛋白结构有一定的相似性,这项研究对于高粱蛋白的挤压加工特性及其提取制备具有指导意义。已有研究表明在一定条件下,经过挤压加工后的高粱蛋白的酶敏感性得到极大的提高[39-41]。此外,ZHAN等[42]用挤压技术预处理高粱粉用于酒精发酵,发现挤压预处理可以使淀粉更容易液化,从另一个侧面证明通过挤压处理可以使高粱中淀粉和蛋白质的结合变得松散。【本研究切入点】挤压过程中由于高温、高压和高剪切力的作用可能使高粱中淀粉和蛋白质的相互结合变得松散;同时在挤压机械能的作用下,高粱中球形的蛋白质体有可能被打破,从而提高所获得高粱蛋白的酶敏感性,更利于生成生物活性短肽。本研究通过挤压协同酶法制备高粱蛋白ACE活性肽,通过适度挤压加工破坏淀粉-蛋白质包埋体系,为蛋白酶的水解提供更多原料,同时挤压过程破坏蛋白质结构有利于蛋白酶的进一步水解,提升了高粱蛋白ACE抑制肽的制备效率。【拟解决的关键问题】研究挤压过程中物料水分含量、挤压温度及高温α-淀粉酶活力对蛋白酶解液的水解度和ACE抑制活性的影响,同时研究所获得ACE抑制肽的稳定性,提供一种更为高效、无污染的高粱蛋白活性肽的制备方法,为高效合理利用高粱蛋白提供参考。
1 材料与方法
1.1 试验时间、地点
试验于2017年在南京财经大学食品科学与工程楼进行。
1.2 试验材料与仪器
脱壳高粱米:淀粉含量71.61%,蛋白质含量10.17%,脂肪含量2.34%,灰分含量2.1%;高温α-淀粉酶(40 000 U·g-1,最适pH 5.5—7.0):购于北京索莱宝科技有限公司;Alcase 碱性蛋白酶(液态):购于诺维信公司;胃蛋白酶(250 000 U·g-1,最适pH 2.0)、胰蛋白酶(250 000 U·g-1,最适pH 7.0)、血管紧张素转换酶(2 000 U·g-1,最适pH 7.0;ACE)、N-[3-(2-呋喃基)丙烯酰]-L-苯丙氨酰-甘氨酰-甘氨酸(FAPGG):购于Sigma-Aldrich公司;其他试剂均购于国药集团化学试剂有限公司。
DSE-20型双螺杆挤压机:德国Brabender公司;酶标仪:美国 Molecular公司;高速冷冻离心机:湖南湘仪公司;pHS-3C精密数显pH计:上海精密科学仪器厂;水浴恒温磁力搅拌器:予华仪器公司;凯氏定氮仪:瑞士Buchi公司;D-3紫外检测仪:上海沪西仪器厂。
1.3 试验方法
1.3.1 挤压协同淀粉酶法制备高粱蛋白
(1)挤压试验
将过60目筛后的微细高粱粉分装后,分别调水分含量至15%、17%、19%、21%、23%,混合均匀,放入自封袋中平衡过夜。
采用DSE-20双螺杆挤压机,长径比30﹕1,螺杆直径20 mm,模孔直径4 mm。挤压机套筒温度分别设定为I区40℃、II区60℃、III区100℃、IV区120℃,V区温度分别设定为120℃、135℃、150℃、165℃和180℃,喂料器转速恒定为14 r/min,螺杆转速恒定为150 r/min。挤压机启动30 min稳定后,按设定的条件对上述混合样品进行试验。挤出样品放置于40℃烘箱干燥24 h,分别磨粉过60目筛用于后续试验。
(2)直接机械能
挤压试验过程中,整个设备由计算机程序控制和记录,可直接读取挤压加工过程中的扭矩等参数,数据采集频率为每分钟6次。根据式(1)计算出直接机械能():
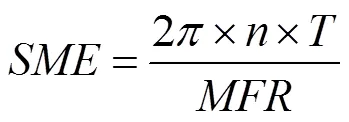
其中为直接机械能(kJ·kg-1),n为螺杆转速(r/min),T为扭矩(Nm),MFR为挤压机稳定时的产量(g·min-1)。
(3)淀粉酶法制备高粱蛋白
将未经挤压的高粱粉和挤压后的高粱粉按照料液比1﹕6(高粱粉:超纯水)于90℃恒温水浴锅中搅拌,添加适量的耐高温α-淀粉酶(0.4、0.8、1.2、1.6、2.0、2.4和2.8 U·g-1),反应2 h后,5 000 r/min,4℃下离心15 min,倾倒上清液后取沉淀,反复水洗沉淀并离心3次,直至上清液澄清,将沉淀冷冻干燥即得高粱蛋白粉。
1.3.2 ACE抑制肽的制备及活性测定
(1)酶解工艺流程
根据预试验结果确定反应条件:取5 mg的上述高粱蛋白粉分散于1 mL的pH 7.9缓冲液中。置于恒温加热磁力搅拌器上,反应温度为55℃,加入2 360 U酶活力的碱性蛋白酶后低速搅拌反应2 h,沸水浴灭酶15 min。待溶液冷却后于5 000 r/min,4℃条件下离心20 min,取上清液即酶解液。
(2)水解度的测定
取完全水解液0.1—1.0 mL于25 mL比色管中,蒸馏水稀释至4.0 mL,加pH 8缓冲溶液1.0 mL,茚三酮溶液1.0 mL,混匀,沸水浴加热15 min,冷却,蒸馏水稀释至25 mL。570 nm测吸光度(以水作参比)。另取100 mg蛋白,加水100 mL,振荡均匀后过滤,取相应体积的滤液,按上述方法测光密度值。相同体积样品的光密度之差与蛋白质量做工作曲线,取线性部分做标准曲线。
取1.0 mL酶解液,稀释至100 mL,取稀释后水解液4.0 mL,加pH 8缓冲溶液1.0 mL,茚三酮溶液1.0 mL,沸水浴加热15 min,冷却,蒸馏水稀释至25 mL,于570 nm下测吸光度。另取相同浓度未水解蛋白溶液3 mL,按上述方法测吸光度,以二者光密度之差从标准曲线上查蛋白质含量。按下式计算水解度[43]:

式中:-由标准曲线得蛋白毫克数,-高粱蛋白粉质量(g),1-水解液总体积(mL),2-显色时所用稀释液体积(mL)。
(3)ACE抑制活性测定 将1.0 mmol·L-1FAPGG 溶解于pH为7.5、包含0.3 mol·L-1NaCl的的Tris-HCl(50 mmol·L-1)中配置底物溶液,置于37℃水浴锅中保温。取10 μL酶解液加入96孔板中,然后加入150 μL的底物溶液,迅速将孔板放入酶标仪中,于340 nm下测定吸光值,每30 s记录一次,共30 min。空白组以10 μL的缓冲液代替酶解液,对照组以10 μL的0.25 U·mL-1的ACE溶液代替酶解液。以吸光值变化() 对时间作出曲线,计算斜率。计算公式如下[44]:

1.3.3 高粱蛋白ACE抑制肽的稳定性测定 依据上述挤压条件择优制备高粱蛋白并通过碱性蛋白酶水解制备高粱蛋白ACE抑制肽粗肽粉,配制5 mg·mL-1的高粱蛋白ACE抑制肽溶液,置于不同的环境中,以蛋白质水解液的ACE抑制率为考察指标,分别考察温度、pH和体外模拟胃肠道酶系对ACE抑制稳定性的影响。具体条件如下:
(1)将高粱蛋白溶液分别置于 20℃、40℃、60℃、80℃和100℃水浴中保温2 h,冰水浴冷却,测定ACE抑制率。
(2)将高粱蛋白溶液的pH分别调至2.0、4.0、6.0、8.0和10.0,在4℃条件下冷藏保存24 h后,调节 pH 为 7.0,测定ACE抑制率。
(3)将高粱ACE抑制肽溶解于0.1 mol·L-1的HCl缓冲液(pH 2.0)中,配制成5%(w/v)溶液并加入适量的胃蛋白酶。在37℃水浴条件下水解3 h,然后沸水浴灭酶10 min,冷却后用2 mol·L-1NaOH调pH至7.0。5 000 r/min离心15 min,测定上清液的ACE抑制率。
(4)取(3)中pH为7.0的溶液,加入适量胰蛋白酶,37℃水浴条件下继续水解3 h,然后沸水浴灭酶10 min,冷却后,5 000 r/min离心15 min,测定上清液的ACE抑制率。
1.3.4 统计分析 采用Origin 8.0数据处理软件对数据进行分析,并用Tukey法进行显著性分析(<0.05)。
2 结果
2.1 物料水分含量和挤压温度对单位机械能耗(SME)的影响
由图1可以看出随着物料水分含量、挤压温度的升高而降低。是扭矩、转速和产量的综合反映[45]。物料水分含量对的影响见图1-a。随着物料水分含量(15%—23%)的增大,单位机械能耗呈下降的趋势。这与物料在机桶内流动性相关[46],物料水分含量低时,在机筒内受强制性流动的阻力增大,挤压螺杆需要较大的机械能输入来保持转速稳定。水分在挤压膨化过程中起到塑化剂的作用[47],随着物料水分含量的增大,物料的流动性增强,使得随之降低。挤压模口V区温度对的影响见图1-b。随着挤压温度(120℃—180℃)的升高,单位机械能耗呈下降的趋势。物料在挤压机内受剪切力和高温影响在挤压机模口处呈熔融状态。当温度升高时,熔融体的黏度降低,扭矩下降,物料的滞留时间减少,导致降低[38]。

图1 物料水分含量和挤压温度对单位机械能耗的影响
2.2 物料水分含量对蛋白酶酶解液水解度和ACE抑制率的影响
由图2可以看出当挤压温度为150℃,淀粉酶活为2.0 U·g-1淀粉时,挤压预处理过程中物料水分含量对蛋白酶酶解液的水解度和ACE抑制率有显著影响。随着物料水分含量的增加(15%—19%),蛋白质酶解液的水解度和ACE抑制率大幅提高,水分含量达到19%后,水解度和ACE抑制率的上升趋势变得平缓。表明使用挤压预处理提取高粱蛋白有利于最终蛋白酶水解,高粱蛋白的酶敏感性得到极大的提高,从而提升了水解度和ACE抑制率。
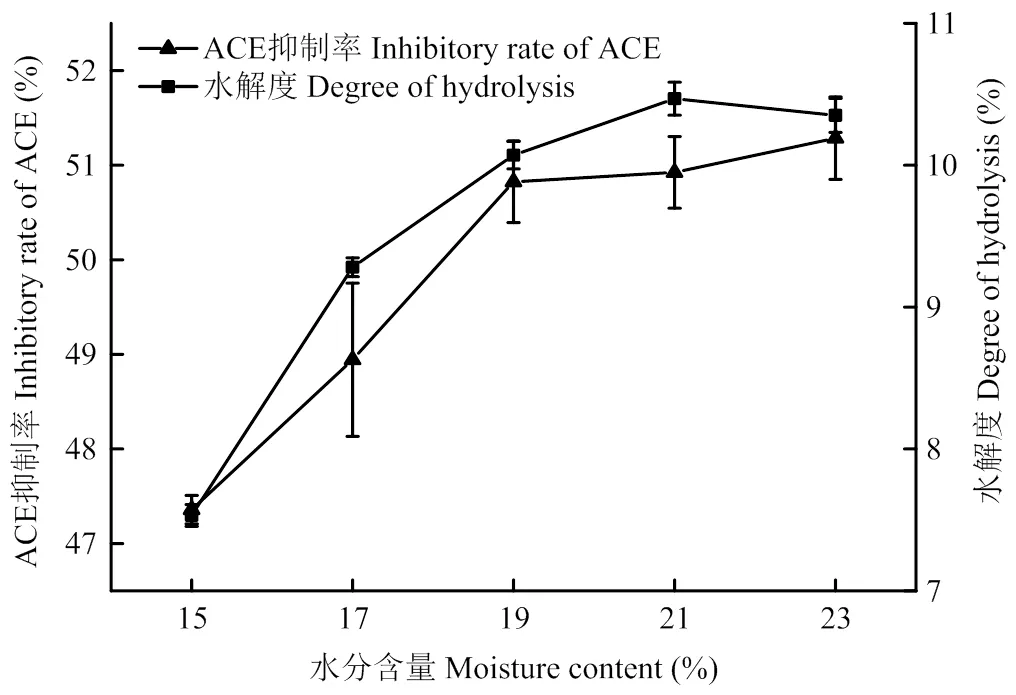
图2 物料水分含量对蛋白酶酶解液的水解度和ACE抑制率的影响
2.3 挤压温度对蛋白酶解液水解度和ACE抑制率的影响
挤压温度作为挤压工艺的一个重要参数,其对蛋白酶酶解液的水解度和ACE抑制率同样具有显著影响,如图3所示,物料水分为17%,淀粉酶活为2.0 U·g-1淀粉时,随挤压温度的升高,蛋白质酶解液的水解度和ACE 抑制率随之持续上升。在180℃时水解度和ACE抑制率分别达到11.07%和53.41%。

图3 挤压温度对蛋白酶酶解液的水解度和ACE抑制率的影响
2.4 α-淀粉酶活力对蛋白酶解液水解度和ACE抑制率的影响
α-淀粉酶的添加可以破坏淀粉分子结构以及淀粉与蛋白质的包埋结构,所以酶活力的改变对蛋白质提取率、蛋白质纯度、蛋白酶酶解液的水解度和ACE抑制率具有重要意义,如图4所示,物料水分为17%,挤压温度为150℃时。随α-淀粉酶活力的上升,蛋白质酶解液的抑制率和水解度持续增加,当酶活力达到2.0 U·g-1淀粉后,水解度、ACE 抑制率趋于稳定,变化幅度不大。
2.5 ACE抑制肽稳定性
2.5.1 温度 储存温度对ACE抑制活性的影响见图5-a。储存温度在20℃—100℃变化时,ACE抑制肽的ACE抑制率在66.94%—68.16%内小范围波动,80℃和 100℃时略有下降,下降幅度很小,说明ACE抑制肽的抑制活性受温度影响不大,ACE抑制肽在一定范围内具有良好的温度稳定性。
2.5.2 pH pH对ACE抑制活性的影响见图5-b。在pH 2—10内,ACE抑制肽的ACE抑制率在66.84%—67.59%波动,变化不显著(<0.05)。总体来看,ACE抑制肽在酸性和碱性条件下都能够保持良好的稳定性。
2.5.3 体外模拟胃肠消化道酶系 胃肠消化道酶系对ACE抑制活性的影响见图5-c。ACE抑制肽经过胃蛋白酶消化后,ACE抑制率较未消化处理的多肽有所提高,再经胰蛋白酶消化后,ACE 抑制率继续增大。这可能是由于在胃肠消化道酶系的水解作用下,ACE抑制肽进一步降解产生更多活性多肽,抑制率上升,说明ACE抑制肽具有良好的体外消化稳定性。

图4 α-淀粉酶活力对蛋白酶酶解液的水解度和ACE抑制率的影响

图5 ACE抑制肽的温度稳定性、酸碱稳定性和体外消化稳定性
Fig. 5 Effects of temperature, pH and gastrointestinal digestive enzyme system on ACE inhibition rate
3 讨论
3.1 高粱蛋白的组成与特性
高粱贮藏蛋白(包括谷蛋白和醇溶谷蛋白)占高粱总蛋白质的90%,其中醇溶谷蛋白约占高粱蛋白的80%。高粱醇溶谷蛋白主要分为α-醇溶蛋白,β-醇溶蛋白和γ-醇溶蛋白3个部分。其中α-醇溶蛋白占比最高,占总量的66%—84%,β-醇溶蛋白占7%—8%,γ-醇溶蛋白占9%—12%。对于α-醇溶蛋白分子而言,二硫键主要存在于分子内部;但β-及γ-醇溶蛋白除了分子内存在二硫键外,还有许多亚基通过分子间二硫键联结并高度交联。同时有大量研究指出高粱醇溶蛋白位于球形的蛋白质体内,该蛋白质体包埋在谷蛋白基质内,同时周围环绕着淀粉颗粒[48-50]。这种结构十分坚固,在食品加工中阻碍了蛋白质连续性网络结构的形成。WONG等[6]发现蛋白质之间的二硫键和蛋白质与淀粉基质之间的相互作用使高粱的蛋白质消化率降低。由于ACE活性位点不能容纳大分子肽,因此,ACE抑制肽的氨基酸残基数量通常为2—12个[51],这说明在制备高粱蛋白ACE抑制肽的过程中,蛋白质之间的二硫键和蛋白质与淀粉基质之间的相互作用同时也限制ACE的获得率、生物活性和生物稳定性。
3.2 挤压处理对高粱内部淀粉结构的影响
在挤压过程中,物料中各个组分受到高压、高温和剪切力的作用,结构和存在形式发生了不同程度的改变,主要体现在淀粉糊化和蛋白质变性等方面。MAHASUKHONTHACHAT等[52]采用不同的挤压参数对高粱粉进行挤压处理,发现挤压后高粱中的淀粉糊化度在88%—99%。这说明挤压过程中的高温高压使得氢键断裂,使得蛋白质-淀粉包埋结构遭到破坏,同时淀粉由原来的致密结构变得松散无序,α化度提高[53]。其糊化程度与挤压机的螺杆转速、挤压温度和物料水分含量等工艺参数密切相关。BHATTACHARYA等[54]研究了挤压工艺参数对糊化程度的影响,结果表明物料水分含量和挤压温度的升高可提高产品的糊化度。同时也有研究指出在高温高压剪切条件下,淀粉分子链部分被打断,还会发生降解现象,生成小分子寡糖,淀粉链裸露,更利于淀粉酶的分解作用[55]。随着物料水分和挤压温度的增加,淀粉糊化程度增加,淀粉-蛋白质包埋体被破坏[56],经过α-淀粉酶酶解后分离出更多的高粱蛋白作为制备ACE抑制肽的原料,相应的得到了更多具有抑制活性的短肽。
3.3 挤压处理对高粱内部蛋白质结构的影响
在挤压过程中,原料中蛋白质的变化也十分明显。高温和剪切作用破坏了维持蛋白质结构的作用力,使蛋白质分子结构伸展,分子间部分氢键、二硫键发生断裂[57],蛋白质变性。据报道,蛋白质变性程度随挤压温度上升而增加,同时改善了蛋白质的组织化程度[58]。一般经过挤压会改善蛋白质的消化率,相对于未挤压原料消化率明显提高,一方面是因为挤压作用会使产品中的游离氨基酸含量增加;另外挤压作用可以使蛋白质分子适度的变性伸展,酶作用位点的暴露增加了蛋白质对酶的敏感性,加快了酶水解速度,蛋白质的消化率提高[59-60]。陈锋亮等[61]在挤压大豆蛋白的过程中发现增加物料水分含量,有助于蛋白质的伸展变性,显著降低了蛋白质分子的聚合程度。房岩强等[62]在研究挤压温度对于蛋白结构的影响时指出温度与蛋白质中二硫键的含量成反比,同时温度的升高,蛋白质中的有序结构减少。同样,JAFARIA等[63]研究指出高粱蛋白在挤压后其结构向无规则卷曲转化。随着物料水分和挤压温度的增加,蛋白质的内部结构打开,暴露出更多的酶作用位点,在蛋白酶的作用下生成更多具有抑制活性的短肽,提升了蛋白酶解液的水解度。
据报道,ACE抑制肽的抑制能力与是否存在疏水性氨基酸存在强关联性[64-65],高粱蛋白中含有较高含量的疏水性氨基酸基团[66],挤压过程中高粱蛋白中疏水性氨基酸基团随着结构的转变而暴露出来,因此,高粱蛋白水解后呈现出较好的ACE抑制活性。
3.4 淀粉酶量对高粱蛋白ACE抑制肽活性的影响
经过挤压后的物料在淀粉酶的作用下进一步破坏淀粉-蛋白质包埋结构,为制备ACE抑制肽的提供更多的原料,提升制备高粱蛋白ACE抑制肽的效率。当淀粉酶量较少时,蛋白质产物纯度低,淀粉水解不彻底,且淀粉与蛋白质之间的包埋结构破坏不完全,酶作用的位点暴露少,不利于蛋白酶的水解作用。此时,酶解液的水解度较低,不能有效生成具有抑制活性的短肽,ACE抑制率低。随着淀粉酶量增加,水解度和ACE抑制率都得到改善。当酶量增加到一定值时,淀粉酶与底物结合达到饱和状态,酶解液的水解度、ACE抑制率变化趋势平缓。
4 结论
本研究采用挤压协同酶法制备高粱蛋白ACE抑制肽。挤压过程中淀粉发生糊化、降解等行为,破坏了淀粉-蛋白质包埋体,为后续通过α淀粉酶水解淀粉提供便利,同时蛋白质在高温高剪切力作用下,高粱蛋白质变性,分子结构被破坏,暴露出更多的酶作用位点因和疏水性氨基酸基团,在蛋白酶作用下生成更多具有抑制活性的短肽,提升蛋白酶解液的水解度,从而获得具备良好ACE抑制活性的高粱蛋白肽。通过此法制备的高粱蛋白ACE抑制肽具有良好的热稳定性、酸碱稳定性和体外消化稳定性。这为开发高粱资源和制备功能性食品配料提供了一条新途径。
[1] WHITE J W, ALAGARSWAMY G, OTTMAN M J, PORTER C H, SINGH U, HOOGENBOOM G. An overview of CERES-sorghum as implemented in the cropping system model version 4.5., 2015, 107(6): 1987-2002.
[2] LINGLE S E, TEW T L, RUKAVINA H, Boykin D L. Post-harvest changes in sweet sorghum II: pH, acidity, protein, starch, and mannitol., 2013, 6(1): 178-187.
[3] VERGARA-BARBERÁN M, MOMPÓ-ROSELLÓ O, LERMA- GARCÍA M J, HERRERO-MARTÍNEZ J M, SIMO-ALFONSO E F. Enzyme-assisted extraction of proteins from citrus, fruits and prediction of their cultivar using protein profiles obtained by capillary gel electrophoresis., 2017, 72: 14-19.
[4] 陈子涵, 蒋继宏, 鞠秀云, 刘金娟. 各食用米中活性成分及其抗氧化活性. 食品工业科技, 2018(3): 71-75.
CHEN Z H, JIANG J H, JU X Y, LIU J J. The bioactive compounds and their antioxidant activity of kinds of edible rice.2018(3): 71-75. (in Chinese)
[5] MKANDAWIRE N L, KAUFMAN R C, BEAN S R, WELLER C L, JACKSON D S, ROSE D J. Effects of sorghum ((L.) moench) tannins on α-amylase activity and in vitro digestibility of starch in raw and processed flours., 2013, 61(18): 4448-4454.
[6] WONG J H, LAU T, CAI N, SINGH J, PEDERSEN J F, VENSEL W H, HURKMAN W J, WILSON J D, LEMAUX P G, BUCHANAN B B. Digestibility of protein and starch from sorghum () is linked to biochemical and structural features of grain endosperm., 2009, 49(1): 73-82.
[7] EZEOGU L I, DUODU K G, JRN T. Effects of endosperm texture and cooking conditions on the in vitro starch digestibility of sorghum and maize flours., 2005, 42(1): 33-44.
[8] TAYLOR J, TAYLOR J R N. Alleviation of the adverse effect of cooking on sorghum protein digestibility through fermentation in traditional African porridges., 2010, 37(2): 129-137.
[9] 阮晓慧, 韩军岐, 张润光, 张有林. 食源性生物活性肽制备工艺、功能特性及应用研究进展. 食品与发酵工业, 2016, 42(6): 248-253.
RUAN X H,HAN J Q,ZHANG R G,ZHANG Y L. Progress in the preparation, functional properties and applications of food-derived bioactive peptides., 2016, 42(6): 248-253. (in Chinese)
[10] BAH C S, CARNE A, MCCONNELL M A, MROS S, BEKHIT A E A. Production of bioactive peptide hydrolysates from deer, sheep, pig and cattle red blood cell fractions using plant and fungal protease preparations.2016, 202: 458-466.
[11] PIOVESANA S, CAPRIOTTI A L, CAVALIERE C, BARBERA G L, MONTONE C M, CHIOZZI R Z, LAGANÀ A. Recent trends and analytical challenges in plant bioactive peptide separation, identification and validation.2018, 410(15): 1-20.
[12] RUTHERFURD-MARKWICK K J, MOUGHAN P J. Bioactive peptides derived from food., 2005, 88(3): 955-966.
[13] DASKAYADIKMEN C, YUCETEPE A, KARBANCIOGLUGULER F, DASKAYA H, OZCELIK B. Angiotensin-I-converting enzyme (ACE)-Inhibitory peptides from plants2017, 9(4): 316-335.
[14] RUDOLPH S, LUNOW D, KAISER S, HENLE T. Identification and quantification of ACE-inhibiting peptides in enzymatic hydrolysates of plant proteins.2017, 224: 19-25.
[15] 梁婷婷, 佟立涛, 蒲华寅,王丽丽, 周闲容, 鞠志远, 周素梅, 黄峻榕. 动植物源蛋白体外消化产物结构性质及ACE抑制活性. 食品科学, 2018, 39(4): 6-12.
LIANG T T, TONG L T, PU H Y, WANG L L, ZHOU X R, JU Z Y, ZHOU S M, HUANG J R. Structures and angiotensin converting enzyme (ACE) inhibitory activity of in vitro digests of animal and plant proteins., 2018, 39(4): 6-12. (in Chinese)
[16] IWANIAK A, MINKIEWICZ P, DAREWICZ M. Food-originating ACE inhibitors, including antihypertensive peptides, as preventive food components in blood pressure reduction., 2014, 13(2): 114-134.
[17] PAN D, GUO Y. Optimization of sour milk fermentation for the production
of ACE-inhibitory peptides and purification of a novel peptide from whey protein hydrolysate., 2010, 20(7): 472-479.
[18] MOSLEHISHAD M, EHSANI M R, SALAMI M, MIRDAMADI S, EZZATPANAH H, NASLAJI A N, MOOSAVI-MOVAHEDI A A. The comparative assessment of ACE-inhibitory and antioxidant activities of peptide fractions obtained from fermented camel and bovine milk byPTCC 1637., 2013, 29(2): 82-87.
[19] LÓPEZFANDIÑO R, OTTE J, JVAN C. Physiological, chemical and technological aspects of milk-protein-derived peptides with antihypertensive and ACE-inhibitory activity.2006, 16(11): 1277-1293.
[20] WU S, FENG X, LAN X, XU Y, & LIAO D. Purification and identification of angiotensin-I converting enzyme (ACE) inhibitory peptide from lizard fish () hydrolysate., 2015, 13: 295-299.
[21] GARCÍA-MORENO P J, ESPEJO-CARPIO F J, GUADIX A, GUADIX E M. Production and identification of angiotensin I-converting enzyme (ACE) inhibitory peptides from Mediterranean fish discards., 2015, 18: 95-105.
[22] BHAT I, KARUNASAGAR I. Antihypertensive activity of fish protein hydrolysates and its peptides., 2018: 1-12.
[23] 翟爱华, 袁文帅. 米糠蛋白ACE抑制肽在大鼠体内降压效果的研究. 食品工业科技, 2015, 36(23): 348-352.
ZHAI A H, YUAN W S. Study on antihypertensive effect of the rice bran protein ace inhibitory peptides on rats., 2015, 36(23): 348-352. (in Chinese)
[24] LIU X, MIAO X, WU D, LIU C, FANG L, LIU J, MIN W. Purification and identification of ACE-inhibiting peptides from wild pine nut peptide fractions (PNPF).2017, 244(6): 1-10.
[25] TERASHIMA M, BABA T, IKEMOTO N, KATAYAMA M, MORIMOTO T, MATSUMURA S. Novel angiotensin-converting enzyme (ACE) inhibitory peptides derived from boneless chicken leg meat., 2010, 58(12): 7432-7436.
[26] LI X, LI Y, HUANG X, ZHENG J, ZHANG F, KAN J. Identification and characterization of a novel angiotensin I-converting enzyme inhibitory peptide (ACEIP) from silkworm pupa., 2014, 23(4): 1017-1023.
[27] WHITE B L, SANDERS T H, DAVIS J P. Potential ACE-inhibitory activity and nanoLC-MS/MS sequencing of peptides derived from aflatoxin contaminated peanut meal., 2014, 56(2): 537-542.
[28] RONG H, GIRGIH A T, ELODIE R, LAURENT B, XING-RONG J, ALUKO R E. Selective separation and concentration of antihypertensive peptides from rapeseed protein hydrolysate by electrodialysis with ultrafiltration membranes., 2016, 197(Pt A): 1008-1014.
[29] GAO D, CHANG T, LI H, & CAO Y. Angiotensin I-converting enzyme inhibitor derived from cottonseed protein hydrolysate., 2010, 9(53): 8977-8983.
[30] SHOBAKO N, OGAWA Y, ISHIKADO A, HARADA K, KOBAYASHI E, SUIDO H, KUSAKARI T, MAEDA M, SUWA M, MATSUMOTO M, KANAMOTO R, OHINATA K. A novel anti-hypertensive peptide identified in thermolysin-digested rice bran., 2017: 1700-1732.
[31] HUANG W H, SUN J, HE H, DONG H W, LI J T. Antihypertensive effect of corn peptides, produced by a continuous production in enzymatic membrane reactor, in spontaneously hypertensive rats., 2011, 128(4): 968-973.
[32] BELTON P S, DELGADILLO I, HALFORD N G, SHEWRY P R. Kafirin structure and functionality., 2006, 44(3): 272-286.
[33] KAMATH V, NIKETH S, CHANDRASHEKAR A, RAJINI P S. Chymotryptic hydrolysates of α-kafirin, the storage protein of sorghum () exhibited angiotensin converting enzyme inhibitory activity., 2007, 100(1): 306-311.
[34] 杜金娟. 甜高粱ACE抑制肽的制备及其特性研究[D]. 镇江: 江苏科技大学, 2013.
DU J J. Preparation and physicochemical properties of ACE-inhibitory peptides from sweet sorghum protein [D]. Zhenjiang: Jiangsu University of Science and Technology, 2013. (in Chinese)
[35] WU Q Y, DU J J, JIA J Q, KUANG C. Production of ACE inhibitory peptides from sweet sorghum grain protein using alcalase: Hydrolysis kinetic, purification and molecular docking study., 2016, 199: 140-149.
[36] CAMARGO F I, CORTEZ D A, UEDA-NAKAMURA T, NAKAMURA C V, DIAS FILHO B P. Antiviral activity and mode of action of a peptide isolated from sorghum bicolor., 2008, 15(3): 202-208.
[37] RIAZ M N.. USA: CRC Press, 2000.
[38] SHERI J. BATTERMAN‐AZCONA, LAWTON J W, BRUCE R. HAMAKER. Effect of specific mechanical energy on protein bodies and α‐zeins in corn flour extrudates., 1999, 76(2): 316-320.
[39] FAPOJUWO O, MAGA J A, JANSEN G R. Effect of extrusion cooking on in vitro protein digestibility of sorghum., 2010, 52(1): 218-219.
[40] DAHLIN K, LORENZ K. Protein digestibility of extruded cereal grains., 1993, 48(1): 13-18.
[41] HAMAKER B R, MERTZ E T, AXTELL J D. Effect of extrusion on sorghum kafirin solubility., 1994, 71(5): 515-517.
[42] ZHAN X, WANG D, BEAN S R, MO X, SUN X S, BOYLE D. Ethanol production from supercritical-fluid-extrusion cooked sorghum., 2006, 23(3): 304-310.
[43] 郭兴凤. 蛋白质水解度的测定. 中国油脂, 2000, 25(6): 176-177.
GUO X F. Determination of hydrolysis degree of protein.2000, 25(6): 176-177. (in Chinese)
[44] SHALABY S M, ZAKORA M, OTTE J. Performance of two commonly used angiotensin-I-converting enzyme inhibition assays using FAPGG and HHL as substrates., 2006, 73: 178-186.
[45] 解铁民, 高扬, 张英蕾, 李哲滨. 挤压参数对薏米挤出产品物理特性的影响. 食品与机械, 2013, 29(1): 18-22.
XIE T M, GAO Y, ZHANG Y L, LI Z B. Extrusion cooking suitability of job's tears and properties of extrudate., 2013, 29(1): 18-22. (in Chinese)
[46] YU C, LIU J, TANG X, SHEN X, LIU S. Correlations between the physical properties and chemical bonds of extruded corn starch enriched with whey protein concentrate., 2017, 7(20):11979-11986.
[47] LI M, HASJIM J, XIE F, HALLEY P J, GILBERT R G. Shear degradation of molecular, crystalline, and granular structures of starch during extrusion., 2014, 66(7/8): 595-605.
[48] DUODU K G, NUNES A, DELGADILLO I, PARKER M L, MILLS E N C, BELTON P S, TAYLOR J R N. Effect of grain structure and cooking on sorghum and maize in vitro, protein digestibility., 2002, 35(2): 161-174.
[49] SCHOBER T J, BEAN S R, BOYLE D L. Gluten-free sorghum bread improved by sourdough fermentation: biochemical, rheological, and microstructural background., 2007, 55(13): 5137-5146.
[50] HAMAKER B R, BUGUSU B A. Overview: sorghum proteins and food quality//Workshop on the proteins of sorghum and millets: enhancing nutritional and functional properties for Africa. Pretoria: South Africa, 2003.
[51] HERNÁNDEZ-LEDESMA B, CONTRERAS M D M, RECIO I. Antihypertensive peptides: production, bioavailability and incorporation into foods., 2010, 165(1): 23-35.
[52] MAHASUKHONTHACHAT K, SOPADE P A, GIDLEY M J. Kinetics of starch digestion and functional properties of twin- screw extruded sorghum., 2010, 51(3): 392-401.
[53] 杜双奎, 魏益民, 张波. 挤压膨化过程中物料组分的变化分析. 中国粮油学报, 2005, 20(3): 39-43.
DU S K, WEI Y M, ZHANG B. Changes of material components during extrusion., 2005, 20(3): 39-43. (in Chinese)
[54] BHATTACHARYA M, HANNA M A. kinetics of starch gelatinization during extrusion cooking., 2010, 52(3): 764-766.
[55] LI M, HASJIM J, XIE F W, HALLEY P J, GILBERT R G. Shear degradation of molecular, crystalline, and granular structures of starch during extrusion., 2014, 66(7/8): 595-605.
[56] GROPPER M, MORARU C I, KOKINI J L. Effect of specific mechanical energy on properties of extruded protein-starch mixtures., 2002, 79(3): 429-433.
[57] YURYEV V P, ZASYPKIN D V, ALEXEYEV V V, GENIN Y V, EZERNITSKAYA M G, TOLSTOGUZOV V B. Structure of protein texturates obtained by thermoplastic extrusion., 1990, 34(7): 607-613.
[58] MAURICE T J, STANLEY D W. Texture-structure relationships in texturized soy protein iv. influence of process variables on extrusion texturization., 1978, 11(1): 1-6.
[59] LI Y, SOPADE P A. Kinetics of protein digestion and molecular weight profiles in a model sorghum-barley blend as affected by extrusion conditions//Cereal Chemistry Conference, 2012.
[60] 方勇, 王红盼, 裴斐, 马宁, 汤晓智, 杨文建, 胡秋辉. 挤压膨化对金针菇-发芽糙米复配粉的消化特性及挥发性物质的影响. 中国农业科学, 2016, 49(23): 4606-4618.
FANG Y, WANG H P, PEI F, M NING, TANG X Z, YANG W J, HU Q H. Effect of extrusion on digestion properties and volatile compounds in germinated brown rice compounded of flammulina velutipes flour., 2016, 49(23): 4606-4618. (in Chinese)
[61] 陈锋亮, 魏益民, 张波. 物料含水率对大豆蛋白挤压产品组织化质量的影响. 中国农业科学, 2010, 43(4): 805-811.
Chen F L, Wei Y M, Zhang B. Effect of moisture content on quality of texturization of product extruded from soy protein isolate., 2010, 43(4): 805-811. (in Chinese)
[62] 房岩强, 魏益民, 张波. 蛋白质结构在挤压过程中的变化. 中国粮油学报, 2013, 28(5): 100-104, 111.
Fang Y, Wei Y M, Zhang B. Transformations of protein structure in extrusion, 2013, 28(5), 100-104, 111. (in Chinese)
[63] JAFARI M, KOOCHEKI A, MILANI E. Effect of extrusion cooking on chemical structure, morphology, crystallinity and thermal properties of sorghum flour extrudates., 2017, 75: 324-331.
[64] 梁婷婷, 佟立涛, 蒲华寅, 王丽丽, 周闲容, 鞠志远, 周素梅, 黄峻榕. 动植物源蛋白体外消化产物结构性质及ACE抑制活性. 食品科学, 2018, 39(4):6-12.
LIANG T T, TONG L T, PU H Y, WANG L L, ZHOU X R, JU Z Y, ZHOU S M, HUANG J R. Structures and angiotensin converting enzyme (ACE) inhibitory activity ofdigests of animal and plant proteins., 2018, 39(4): 6-12. (in Chinese)
[65] TOOPCHAM T, ROYTRAKUL S, YONGSAWATDIGUL J. Characterization and identification of angiotensin I-converting enzyme (ACE) inhibitory peptides derived from tilapia using, SK1-3-7 proteinases., 2015, 14: 435-444.
[66] WOOD A J, GOLDSBROUGH P B. Characterization and expression of dehydrins in water-stressed sorghum bicolor., 2010, 99(1): 144-152.
Preparation and Stability of Sorghum ACE Inhibitory Peptides by Extrusion-Enzyme Synergistic Method
ZHOU JianMin, YIN FangPing, YU Chen, TANG XiaoZhi
(College of Food Science and Engineering, Nanjing University of Finance and Economics/Collaborative Innovation Center for Modern Grain Circulation and Safety/Key Laboratory of Grains and 0ils Quality Control and Processing, Nanjing 210023, Jiangsu)
【Objective】Sorghum ACE inhibitory peptides were prepared by extrusion-enzyme synergistic method in order to provide a technical guidance to enhance the utilization efficiency of sorghum protein.【Method】Sorghum flour was introduced into an extruder, and then treated by α-amylase and alkaline protease to obtain the ACE inhibitory peptides. Effects of water content in sorghum flour, extrusion temperature and enzyme activity on the degree of hydrolysis and the activity and stability of ACE inhibitory peptides were investigated.【Result】With the increasing moisture content and extrusion temperature, the specific mechanical energy () decreased. During extrusion, the interaction between starch and protein in sorghum became loose, which broke the starch-protein complex, and the spherical protein in sorghum was broken up, and thus the sensitivity of sorghum protease was enhanced and more ACE peptides were obtained after alkaline protease treatment. The moisture content, extrusion temperature and the activity of α-amylase presented a significant effect on the degree of hydrolysis and the inhibition rate of ACE inhibitory peptides. With the increasing moisture content, the assemble degree of protein decreased, which increased the degree of hydrolysis and the inhibition rate of ACE inhibitory peptides. When the moisture content reached to 19%, the damage degree of the starch around protein decreased, leading to the gentle increase trend of the hydrolysis degree and the inhibition rate of ACE inhibitory peptides. When the extrusion temperature increased from 120℃ to 180℃, the damage degree of starch-protein complex in sorghum increased. Meanwhile, the denaturation degree of protein also increased. The degree of hydrolysis increased from 7.42% to 11.06%, and the inhibition rate of sorghum protein ACE inhibitory peptides increased from 46.57% to 53.41%. The sorghum flour was treated by a-amylase to remove the starch around the protein after extrusion, and then it was found that when the activity of α-amylase increased, the damage degree of protein-starch complex in sorghum increased, which provided more raw materials for the preparation of sorghum protein ACE inhibitory peptides, leading to the higher the degree of hydrolysis and the activity of ACE inhibitory peptides. When the activity of α-amylase increased to 2.0 U·g-1, the binding of α-amylase to starch reached saturation, and the degree of hydrolysis and the inhibition rate of ACE inhibitory peptides tended to be stable. the activity of ACE inhibitory peptide fluctuated within 68.1%-71.31% after being treated by different storage temperatures and pH, suggesting a good inhibitory activity. Aftersimulated gastrointestinal digestive enzymes digestion, the inhibitory activity of ACE inhibitory peptides was higher than 73%, which still maintained high value. The stability test indicated that sorghum ACE inhibitory peptides had good resistance to thermal, acid and alkaline treatment, and intestinal enzymes digestion.【Conclusion】The degree of hydrolysis and the inhibition rate of ACE inhibitory peptides all increased significantly by extrusion-enzyme synergistic method, while sorghum ACE inhibitory peptides had good stability, thus this work provided a new approach for the utilization of sorghum and the preparation of sorghum protein and ACE inhibitory peptides with potential use as functional food ingredients.
extrusion; α-amylase; sorghum ACE inhibitory peptides; stability
10.3864/j.issn.0578-1752.2019.02.012
2018-07-05;
2018-11-12
江苏高校优势学科建设工程资助项目(PAPD)
周剑敏,E-mail:9120111012@nufe.edu.cn。通信作者汤晓智,E-mail:warmtxz@njue.edu.cn
(责任编辑 赵伶俐)
