贮前光照处理对伽师瓜贮藏品质及部分防御酶活性影响
2019-01-28玛尔哈巴帕尔哈提白羽嘉张明明冯作山
玛尔哈巴·帕尔哈提,白羽嘉,2,李 梦,李 佳,张明明,王 瑾,冯作山,*
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052;2.新疆农业大学作物学博士后流动站,新疆乌鲁木齐 830052)
新疆甜瓜种质资源丰富,所产甜瓜含糖量高,品质优良,营养丰富,是国内优质甜瓜主产区[1-2]。伽师瓜是新疆甜瓜中最耐贮藏的一个品种,属于厚皮甜瓜的一个变种。伽师瓜每年8~9月采摘,瓜农先将采后伽师瓜置于遮阴棚下光照一个月左右,再转入地窖平放于沙土上贮藏,这种贮藏方式可将伽师瓜保存到来年2~3月,贮藏期长达5个月。光照处理是一种非加热物理处理[3],适当地用光线照射植物体,会推迟其生理老化[4]。王仲田等[5]发现对采后甜瓜光照1个月,可提高果实的呼吸强度,加速果实产生乙烯,提高果实乙醇和乙醛的含量,促进果实早衰,增加损耗,不利于贮藏;对甜瓜短时间光照3~5 d,可减少损耗,对贮藏有益。有研究报道光照可提高植物体总叶绿素、类胡萝卜素、番茄红素和VC含量。除此之外,光照对诱导CAT、POD和PPO等防御酶活性有积极影响作用,从而维持活性氧代谢平衡,延缓果蔬衰老,提高果蔬贮藏品质[6]。尽管光照是当地瓜农贮藏伽师瓜的办法,但伽师瓜光照研究鲜见报道。因此,本研究模拟伽师瓜光照环境,初步探讨光照对采后伽师瓜品质的影响,以期为后期伽师瓜的生产措施制定提供一定的理论依据,促进伽师瓜生产发展。
1 材料与方法
1.1 材料与仪器
伽师瓜 采摘于新疆喀什地区伽师县;80%丙酮、石英砂、碳酸钙粉、冰醋酸、无水醋酸钠、聚乙二醇6000、聚乙烯吡咯烷酮(K30)、曲拉通、愈创木酚、30% H2O2溶液、邻苯二酚、磷酸氢二钠、磷酸二氢钠、二硫苏糖醇 均为分析纯(AR),购自天津市光复精细化工研究所。
TGL-16G型高速冷冻离心机 上海安亭科学仪器厂;TU-1810PC型紫外-可见分光光度计 北京普析通用公司;SK2200H型超声波清洗器 上海科导超声仪器有限公司;DZKW-S-4型电热恒温水浴锅 北京市永光明医疗仪器厂;XHF-DY型高速分散器 宁波新芝生物科技股份有限公司;testo540型照度仪 德图仪器国际贸易(上海)有限公司;FA2104N型电子天平 上海民桥精密科学仪器有限公司;FE20型pH计 梅特勒-托利多仪器有限公司;FHR-1型硬度计 日本竹村电机制作所;WZB-35型便携式数显折光仪 上海精密科学仪器有限公司。
1.2 实验方法
1.2.1 样品处理 果实随机分成2组(每组80个),正式贮藏前14 d,一组采用12/12 h光照/避光交替处理,光照强度4500 lux,另外一组 24 h避光,所有果实均在25 ℃下进行;光照结束后,将2组样品放入7 ℃、相对湿度85%~90%冷库避光贮藏。
分别于第0、7、14、21、28、35、42、49 d取果皮和果肉组织,液氮速冻,-80 ℃保存。各处理每次取样6个果实,选取果实赤道周边部位均匀取样。
1.2.2 测定指标和方法
1.2.2.1 果实硬度 使用硬度计,围绕果实赤道部位,在等间距的6个位置测定果实硬度,单位:kg/cm2。
1.2.2.2 果实失重率 失重率(%)=(初始重量-最终重量)/初始重量×100。
1.2.2.3 可溶性固形物 取1 g果肉组织放入研钵磨碎,于4 ℃、8000×g离心10 min,取上清液使用折光仪测定,单位为°Brix。
1.2.2.4 总叶绿素及类胡萝卜素含量 参照朱广廉等[7]方法并修改。称取3 g冷冻果皮组织,加少量石英砂和碳酸钙粉,用5 mL 80%丙酮研成匀浆,再加15 mL 80%丙酮溶液继续研磨至组织变白,静置3~5 min后过滤定容至50 mL。以80%丙酮为空白,在波长663、645和440 nm处分别测定吸光度值,然后按照下列公式:总叶绿素质量浓度=20.3A645-8.1A663,类胡萝卜素质量浓度=8.73A440+2.1A663-9.1A645分别计算出总叶绿素和类胡萝卜素质量浓度,mg/L FW,然后换算成mg/g FW。实验重复3次。
1.2.2.5 还原糖含量 采用3,5-二硝基水杨酸法[8]。称取5 g冷冻果肉组织,用蒸馏水充分研磨成匀浆后定容至25 mL刻度试管。置80 ℃水浴保温30 min,过滤浸提液,重复提取2次,合并上清液定容至100 mL,作为还原糖提取液备用。反应体系:2 mL还原糖提取液,1.5 mL 3,5-二硝基水杨酸试剂。在沸水浴中加热5 min,冷却后以蒸馏水定容至25 mL。以蒸馏水为空白,在540 nm 波长测定吸光度值。根据下列公式计算还原糖含量(%)。实验重复3次。

式中:C:从标准曲线查得的葡萄糖毫克数,mg;V:样品提取液总体积,mL;N:样品提取液稀释倍数;VS:测定时所取样品提取液体积,mL;W:样品重量,g。
1.2.2.6 过氧化氢酶(CAT)活性 参照Ren等[9]方法并修改。分别称取10 g冷冻果肉组织和5 g冷冻果皮组织,分别加入15 mL和25 mL提取缓冲液(100 mmol/L pH7.5 磷酸缓冲液,5 mmol/L 二硫苏糖醇,5%(w/v)聚乙烯吡咯烷酮K30),充分研磨成匀浆后,于4 ℃、8000×g下离心30 min,上清液即为CAT酶提取液。酶促反应体系:2.9 mL 20 mmol/L H2O2,100 μL粗酶液。以蒸馏水为空白,立即在波长240 nm处测定吸光度值,然后每隔30 s测定一次,连续测定3 min。以每克鲜重样品每分钟吸光度值减少0.01为1个CAT酶活性单位(U/g FW)。实验重复3次。
1.2.2.7 过氧化物酶(POD)活性 采用愈创木酚法[10]。称取10 g冷冻果肉组织和5 g冷冻果皮组织,分别加入10和20 mL提取缓冲液(50 mmol/L pH5.5 醋酸缓冲液,1 mmol/L聚乙二醇6000,4%(w/v)聚乙烯吡咯烷酮K30,1%曲拉通),充分研磨成匀浆后,于4 ℃、8000×g下离心30 min,上清液即为POD酶提取液。酶促反应体系:3 mL 25 mmol/L愈创木酚溶液,0.5 mL酶提取液,200 μL 0.5 mol/L H2O2溶液。以蒸馏水为空白,立即在波长470 nm处测定吸光度值,然后每隔1 min 测定一次,连续测定6 min。以每克鲜重样品每分钟吸光度值增加1时为1个POD酶活性单位(U/g FW)。实验重复3次。
1.2.2.8 多酚氧化酶(PPO)活性 参照曹建康等[11]方法并修改。称取10 g冷冻果肉组织和5 g冷冻果皮组织,分别加入10和20 mL提取缓冲液(100 mmol/L pH5.5 醋酸缓冲液,1 mmol/L聚乙二醇6000,4%(w/v)聚乙烯吡咯烷酮K30,1%曲拉通),充分研磨成匀浆后,于4 ℃、8000×g下离心30 min,上清液即为PPO酶提取液。酶促反应体系:4 mL 50 mmol/L,pH5.5醋酸缓冲液,1 mL 50 mmol/L邻苯二酚溶液,100 μL 酶提取液。以蒸馏水为参比空白,立即在波长420 nm处测定吸光度值,然后每隔1 min测定一次,连续测定6 min。以每克鲜重样品每分钟吸光度变化值增加1时为1个PPO酶活性单位(U/g FW)。实验重复3次。
1.3 数据处理
使用SPSS 20.0软件进行差异性显著分析,利用Origin 8.5软件进行数据处理及绘图。
2 结果与分析
2.1 光照对伽师瓜果实硬度的影响
如图1所示,伽师瓜随着贮藏时间延长,果实硬度持续下降。第49 d时,光照和避光果实硬度较起始分别下降了12.04%和10.20%。光照与避光果实硬度从第7 d后开始出现显著差异(p<0.05)。结果表明,光照加快伽师瓜果实硬度下降。对“霞多丽”葡萄进行不同程度光照同样出现果实硬度下降现象,且重度光照较轻度光照硬度低[12],这与本研究结果相似。

图1 光照对伽师瓜果实硬度的影响Fig.1 Effect of illumination on fruit firmness of Jiashi melon
2.2 光照对伽师瓜果实失重率的影响
如图2所示,随着贮藏时间延长,果实失重率显著升高(p<0.05),且光照失重率高于避光。到贮藏结束时(第49 d),光照与避光果实失重率分别上升到6.06%和5.73%。此外,有研究表明,不同品种甜瓜在相同光照强度下失重率不同[13]。另外,果实失重率与光照强度呈相关性,研究发现生菜在高光照(2500 lux)、低光照(500 lux)和黑暗环境中的失重率分别为1.74%、1.35%和1.05%[14]。由此得出,光照加快伽师瓜果实失重率上升。

图2 光照对伽师瓜果实失重率的影响Fig.2 Effect of illumination on weight loss rate of Jiashi melon
2.3 光照对伽师瓜可溶性固形物含量的影响
如图3所示,光照和避光可溶性固形物含量随着贮藏时间延长均显著下降,但光照可溶性固形物含量始终高于避光。经过49 d贮藏,光照和避光可溶性固形物含量分别下降了25.13%和36.36%。光照与避光可溶性固形物含量变化之间存在显著差异(p<0.05)。结果表明,光照可有效维持伽师瓜贮藏期间营养物质含量,保持品质。然而,红光、太阳光、UV-C等间歇定时照射均不影响番茄果实贮藏过程中可溶性固形物的含量,且可溶性固形物含量在贮藏过程中变化较小[15]。因此,这可能与研究对象、光源类型和光照时间等因素有关。

图3 光照对伽师瓜可溶性固形物含量的影响Fig.3 Effect of illumination on total soluble solid of Jiashi melon
2.4 光照对伽师瓜果皮色素含量的影响
如图4所示,随着贮藏时间增加,光照与避光果皮总叶绿素含量(图4A)及类胡萝卜素含量(图4B)均呈先增加后减少趋势。光照果皮色素含量高于避光,且光照与避光两种色素含量变化均存在显著差异(p<0.05)。结果表明,光照可有效维持果皮色素含量。充足的光照促进伽师瓜果皮总叶绿素含量积累,使伽师瓜果皮颜色一直保持墨绿。

图4 光照对伽师瓜果皮色素含量的影响Fig.4 Effect of illumination on pigment content of Jiashi melon
2.5 光照对伽师瓜还原糖含量的影响
如图5所示,光照还原糖含量始终高于避光。贮藏前处理阶段,光照显著提高了还原糖含量,并在第14 d出现最大值。后期贮藏阶段,光照还原糖含量开始下降,但仍保持较高含量。第49 d,光照还原糖含量较第0 d上升了65.0%。对于避光,还原糖含量仅在贮藏前处理阶段略微上升,随后持续降低。第49 d较第0 d降低了33.8%。光照与避光果实之间还原糖含量变化差异显著(p<0.05)。糖分含量是衡量伽师瓜品质的主要依据,结果表明,光照对伽师瓜还原糖含量有重要影响作用。同样在不同品种甜瓜果实中,中度光照下果实还原糖含量均显著高于微弱光照[16]。
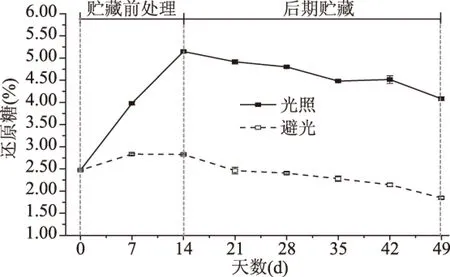
图5 光照对伽师瓜还原糖含量的影响Fig.5 Effect of illumination on reducing sugar content of Jiashi melon
2.6 光照对伽师瓜CAT酶活性的影响
CAT酶可通过清理植物自身在光合作用或呼吸代谢等途径中所产生的H2O2,来减少果蔬组织造成的氧化伤害[17]。由图6可知,光照CAT酶活性大于避光,果皮的CAT酶活性显著高于果肉(p<0.05)。对于果肉,光照CAT酶活性在贮藏前处理阶段略微下降,进入后期贮藏阶段呈先升高后降低趋势,而避光CAT酶活性在贮藏前处理阶段下降后又在后期贮藏阶段持续上升(图6A);对于果皮,光照和避光CAT酶活性均呈先上升后下降趋势(图6B)。研究报道,光照可以诱导CAT活性的上升,这有利于活性氧的清除,从而维持活性氧代谢的平衡,延缓果蔬贮藏期间的衰老[6]。

图6 光照对伽师瓜果肉(A)、果皮(B)CAT酶活性的影响Fig.6 Effects of illumination on CAT enzymatic activity in sarcocaro(A)and pericarp(B)of Jiashi melon
2.7 光照对伽师瓜POD酶活性的影响
POD的主要作用是清除果蔬生理代谢过程中所产生的H2O2和因此产生的有机过氧化物,在受到贮藏环境变化、外界刺激、病原菌侵染等作用时,果蔬组织中POD酶活性会做出相应的应答反应[18]。由图7可知,随着贮藏时间延长,果肉POD酶活性与果皮POD酶活性均呈先增加后减少趋势,光照POD酶活性大于避光,果皮的POD酶活性显著高于果肉(p<0.05)。光照与避光果肉分别在第35和42 d达到POD酶活性峰值,光照活性是避光的1.51倍(图7A);光照与避光果皮分别在第35和28 d达到POD酶活性峰值,光照活性是避光的1.24倍(图7B)。有研究表明,光照甜瓜随贮藏时间延长POD酶活性降低的原因与组织内CO2增加,氧的减少还有乙醛和乙醇在果实中的累积有关[19]。

图7 光照对伽师瓜果肉(A)、果皮(B)POD酶活性的影响Fig.7 Effects of illumination on POD enzymatic activity in sarcocaro(A)and pericarp(B)of Jiashi melon
2.8 光照对伽师瓜PPO酶活性的影响
在后熟衰老过程或在采后贮藏加工过程中,PPO酶活性参与果蔬自身抵御外界干扰过程[20]。由图8可知,果肉与果皮PPO酶活性均随贮藏天数增加而升高,但是,光照PPO酶活性大于避光,果皮PPO酶活性显著高于果肉(p<0.05)。到贮藏结束时,光照与避光果肉和果皮均在第49 d达到PPO酶活性最大值,光照分别是避光的1.44倍(图8A)和1.22倍(图8B)。同样的结果在苹果果皮组织中也有发现[21]。

图8 光照对伽师瓜果肉(A)、果皮(B)PPO酶活性的影响Fig.8 Effects of illumination on PPO enzymatic activity in sarcocaro(A)and pericarp(B)of Jiashi melon
3 结论
光照处理使伽师瓜果实硬度下降;增加了果实失重率,但是,光照较好保持了伽师瓜果肉可溶性固形物、还原糖含量,保持伽师瓜贮藏品质;光照处理促使伽师瓜果皮保持较高色素含量;同时,贮藏前光照处理还刺激了果实中CAT、POD和PPO酶活性,且果皮酶活性高于果肉。
作为环境因子中的一个重要因素,光不仅可以影响植物品质,而且参与植物防御机制,提高植物抵御外界干扰能力[22]。相关研究表明,光照会加快芹菜[23]、萝卜[24]、西兰花[25]等果实软化,增加失重率,严重时出现萎蔫现象,加快衰老,这与果实的后熟软化和蒸腾作用有关,本研究结果与上述报道基本一致。任何植物的生长都离不开光照,甜瓜作为喜光植物,在采摘后仍进行微弱的光合作用,不断积累营养物质和光合色素[26]。在光照条件下,植物的生理特性会发生相应变化,CAT、POD和PPO是植物次生物质生成过程中的关键酶,也是酶促防御系统的重要保护酶[27-29]。在本研究中,其活性改变预示着果实对光照刺激的化学防御体系正在发生改变。
