桉树焦枯病菌MDR基因生物信息学分析及功能解析
2019-01-25张清华张晓阳刘宏毅叶小真冯丽贞
张清华, 陆 芝, 张晓阳, 刘宏毅, 丁 奕, 叶小真, 冯丽贞
(福建农林大学林学院/福建农林大学森林保护研究所,福建 福州 350002)
杀菌剂的大量使用导致病原真菌对化学药剂逐渐产生抗性,病原真菌的多药耐药性已成为动植物真菌病害的治疗和防治过程中最急需解决的难题.多药耐药转运蛋白MDR(multidrug resistance)主要与多药耐药性相关,可通过将外源化学物质排出体外,减少外源化学物质对真菌的毒害作用或使病原真菌能够成功定植到寄主中.MDR转运蛋白属于ABC转运蛋白家族.MDR转运蛋白广泛存在于真核生物细胞中,其功能获得了较为广泛的研究,如烟曲霉(Aspergillusfumigatus)的Mdr1蛋白、构巢曲霉(A.nidulans)AtrD蛋白和裂殖酵母(Schizosaccharomycespombe)的Pmd1蛋白[1-3].植物病原真菌MDR转运蛋白除与多药耐药性相关外,还与其致病过程,如稻瘟病菌(Magnaportheoryzae)ABC3(MGG_13762)蛋白与病原菌穿透寄主的过程有关[4].小麦赤霉菌(Fusariumgraminearum)FGSG_06771基因突变体菌株的致病力明显下降[5].
桉树焦枯病(Calonectrialeaf blight)是热带和亚热带地区为害桉树生长的重要病害之一,严重威胁桉树产业的发展[6].桉树焦枯病由丽赤壳属(Calonectriaspp.)真菌引起,其无性态为帚梗柱孢属(Cylindrocladium)[7].据统计,Calonectria现有集群13个,共71种,其中CalonectriapseudoreteaudiiYA51是福建省内分布最广、致病力最强的病原菌株[8-10].研究发现桉树焦枯病菌CpABCB7基因在焦枯病菌侵染桉树48 h时上调表达,且在67个ABC基因中表达量最高.CpABCB7属于多药耐药蛋白MDR,桉树焦枯病菌中共有12个MDR蛋白[11].为了解MDR蛋白在桉树焦枯病菌的具体功能,本研究通过生物信息软件对桉树焦枯病菌MDR蛋白家族的理化性质、结构域、蛋白二级结构及三级结构进行分析,进一步通过qPCR检测在分生孢子阶段、孢子萌发阶段、桉树焦枯病菌接种24、48和72 h后及焦枯病菌在H2O2、NaCl、KCl、LiCl、放线菌酮、苦参碱、芦竹碱、百菌清和咪康唑胁迫下的表达情况,研究结果可为解析MDR基因的具体功能提供数据支撑,也可为阐述MDR基因与桉树焦枯病菌致病和抗药分子机制之间的联系奠定基础.
1 材料与方法
1.1 材料
1.1.1 供试菌株 供试菌株为C.pseudoreteaudiiYA51,由福建农林大学森林保护研究所于福建永安桉树焦枯病危害区采集分离获得.基因组NCBI(National Center for Biotechnology Information,https://www.ncbi.nlm.nih.gov/)检索编号MOCD 01000000.
1.1.2 主要培养基及试剂 总RNA提取试剂盒、反转录PCR试剂盒和实时荧光定量PCR试剂盒购自天根生化科技有限公司;NaCl、KCl、H2O2、葡萄糖和硼酸购自国药集团化学试剂有限公司;百菌清、放线菌酮、苦参碱、芦竹碱和咪康唑购自上海源叶生物科技有限公司.真菌培养采用PDB培养基,200 g 去皮土豆,20 g葡萄糖; 每升PDB液体培养基加15 g琼脂粉,制备PDA培养基.
1.2 方法
1.2.1 药物敏感性测定 放线菌酮、苦参碱、芦竹碱和咪康唑用乙醇溶解,配成100 mg·mL-1母液,4 ℃保存备用;百菌清用丙酮配置成10 mg·mL-1母液,4 ℃保存备用.将5种药物根据表1配置10倍液.待PDA培养基冷却至45~50 ℃后,将配置好的10倍液分别与PDA培养基以1∶9的比例充分混匀,制成含药平板.
表1药物浓度梯度
Table 1 The gradients of drugs mg·mL-1
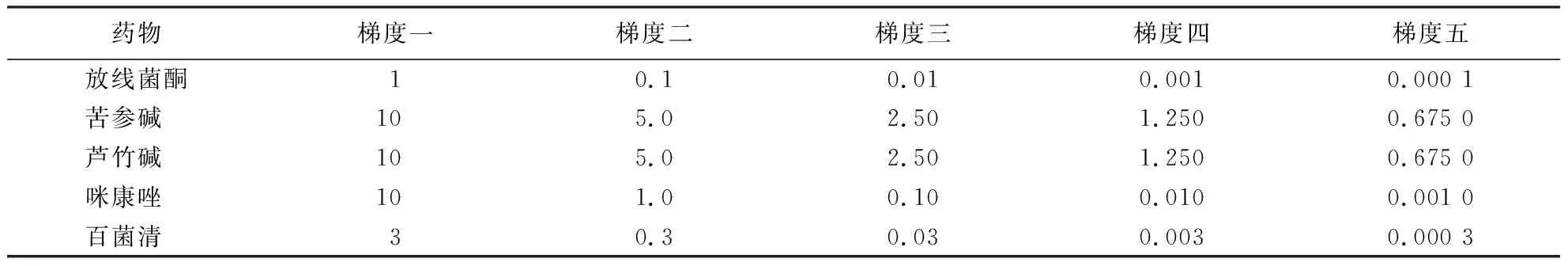
药物梯度一梯度二梯度三梯度四梯度五放线菌酮10.10.010.0010.000 1苦参碱 105.02.501.2500.675 0芦竹碱 105.02.501.2500.675 0咪康唑 101.00.100.0100.001 0百菌清 30.30.030.0030.000 3
将桉树焦枯病菌接种于PDA培养基上,28 ℃培养10 d后,在菌落边缘打取直径6.0 mm的菌饼,并分别接种于1.4.1制好的含药PDA平板的中央,菌丝面朝下,以加了等量无菌水的无药PDA平板为对照,每处理重复3次.28 ℃培养10 d后用十字交叉法测量菌落直径,按公式(1)计算菌丝生长抑制率.将浓度梯度值的菌丝生长抑制率,将抑制率转换为相应几率值,采用SPSS 19.0统计分析软件进行回归分析,分别计算5种杀菌剂的EC50.
(1)
1.2.2 生物信息学分析 通过ProtParam(http://web.expasy.org/protparam/)分析其理化性质.采用PBIL(https://prabi.ibcp.fr/htm/site/web/services/secondaryStructurePred-iction)在线分析工具PHD分析蛋白质二级结构,该分析基于ASTP和MaxHom.然后采用InterPro(http://www.ebi.ac.uk/interpro/)对MDR基因编码的蛋白序列进行分析,并结合SWISS-MODEL(https://swismodel.expasy.org/interactive)在线服务对MDR蛋白三级结构进行分析.最后,用SAVES(https://services.mbi.ucla.edu/SAVES/)在线服务对所构建的MDR蛋白三级结构进行验证.
1.2.3MDR基因表达分析 焦枯病菌侵染桉树叶片处理:同叶小真等[12]的方法.
药物胁迫:将桉树焦枯病菌接种于PDA培养基中,然后放置到恒温培养箱中培养7 d.根据1.4中计算出的5种药物的EC50配置含药PDB培养基.取边缘部位菌饼接种于含药培养基中,以加入无菌水的培养基作为对照组,每个锥形瓶中加入3个菌饼,置于恒温振荡器中28 ℃ 150 r·min-1振荡培养12 h.每个处理设置3个生物重复.振荡培养12 h后,用Miracloth收集菌丝并用锡箔纸包裹后液氮速冻,放入-80 ℃冰箱中保存.
氧胁迫:将桉树焦枯病菌接种于PDA培养基中,然后放置到恒温培养箱中培养7 d.取边缘部位菌饼接种于H2O2浓度为8 mmol·L-1的YEPD培养基中,以无菌水的YEPD培养基作为对照组,每个锥形瓶中加入3个菌饼,置于恒温振荡器中28 ℃ 150 r·min-1振荡培养12 h.每个处理设置3个生物重复.振荡培养12 h后,用Miracloth收集菌丝并用锡箔纸包裹后液氮速冻,放入-80 ℃冰箱中保存.
金属盐胁迫:将桉树焦枯病菌接种于PDA培养基中,然后放置到恒温培养箱中培养7 d.取边缘部位菌饼接种于分别含有0.8 mol·L-1NaCl、0.6 mol·L-1KCl、0.1 mol·L-1LiCl的YEPD培养基中,以加入无菌水的YEPD培养基作为对照组,每个锥形瓶中加入3个菌饼,置于恒温振荡器中28 ℃ 150 r·min-1振荡培养12 h.每个处理设置3个生物重复.振荡培养12 h后,用Miracloth收集菌丝并用锡箔纸包裹后液氮速冻,放入-80 ℃冰箱中保存.
分生孢子样品制备:将桉树焦枯病菌接种于PDA培养基中,然后放置到恒温培养箱中培养7 d.取边缘部位菌饼接种于改良PDA培养基(土豆40 g·L-1)中,振荡培养4 d后离心去上清,沉淀物用锡箔纸包裹后液氮速冻,放入-80 ℃冰箱中保存.
分生孢子萌发阶段样品制备:桉树焦枯病菌侵染寄主过程中,主要通过自然孔口进入桉树体内[13],暂未发现其他侵染结构;此外,焦枯病菌在叶片表面4 h即萌发[14,15].因此,本研究主要从分生孢子阶段和孢子萌发阶段(振荡培养4 h)来检测MDR基因的表达情况.将桉树焦枯病菌接种于PDA培养基中,恒温培养箱中培养7 d.取边缘部位菌饼接种于改良PDB培养基中,振荡培养4 d后过滤,收集孢子,将孢子加入YEPD培养基中,调节浓度为2×10-7spores·mL-1.置于恒温振荡器中28 ℃ 150 r·min-1振荡培养4 h,离心去上清后,用锡箔纸包裹后液氮速冻,放入-80 ℃冰箱中保存.
采用1.7.1的样品制备方法,总RNA提取、反转录PCR(reverse transcription PCR, RT-PCR)、实时荧光定量PCR(quantitative real-time PCR, qPCR)试剂盒均购自天根生化科技(北京)有限公司.采用Talent qPCR PreMix试剂盒进行qPCR,反应体系为:2×Talent qPCR Mix 10.0 μL,上游引物0.6 μL,下游引物0.6 μL,cDNA模板1.0 μL,50×ROX Reference Dye 0.4 μL,并加RNase-Free ddH2O至20 μL.引物设计采用Primer premier 6.0软件进行设计(表2),委托生工生物工程有限公司合成.采用2-△△Ct法计算焦枯病菌MDR基因的表达量.
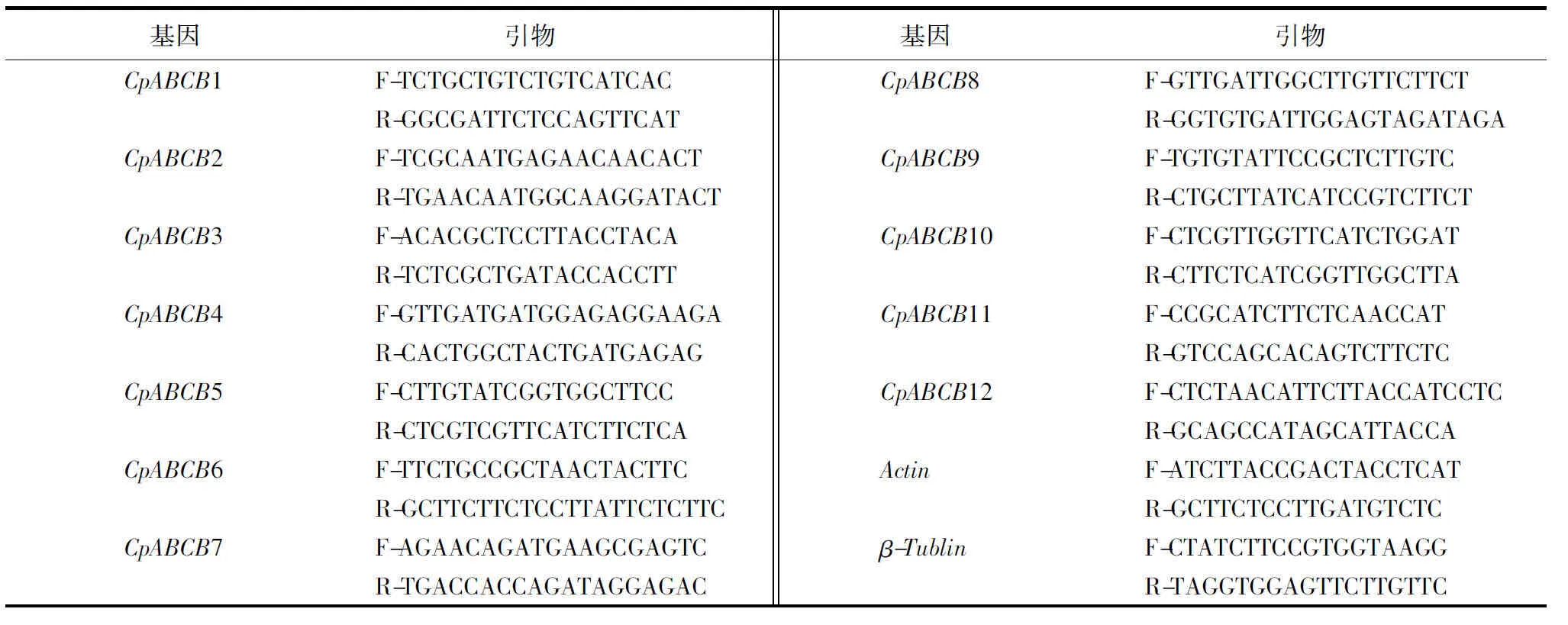
表2 桉树焦枯病菌内参基因及其对应引物Table 2 The primer of reference gene in C.pseudoreteaudii
2 结果与分析
2.1 药物对桉树焦枯病菌菌丝生长的抑制作用
采用SPSS软件分析放线菌酮、苦参碱、芦竹碱、百菌清和咪康唑对桉树焦枯病菌菌丝生长的抑制作用,结果表明,5种药剂的不同浓度梯度均能影响桉树焦枯病菌的菌丝生长量,且这种抑制作用与浓度呈正相关,浓度越高菌落直径越小、抑制率越高,且存在显著性差异(P<0.05),说明分析结果具有生物学统计意义.放线菌酮、苦参碱、芦竹碱、百菌清和咪康唑原药对桉树焦枯病菌的EC50分别为0.27、4.00、2.01、2.16和3.73 mg·mL-1.
2.2 MDR转运蛋白理化性质分析
利用ProtParam在线分析MDR转运蛋白的理化性质,结果显示,MDR转运蛋白中,除CpABCB12的氨基酸酸残基数为492 aa外,其余11个MDR转运蛋白的氨基酸残基数均在1100个以上.除CpABCB12外,其余11个MDR蛋白的分子质量均相差不大.其中,CpABCB1最大,分子质量为149804.34 u;在等电点处,库伦相互作用最小,有利于不同蛋白间接触.通过预测,MDR蛋白的理论等电点为5.48~8.76,CpABCB12转运蛋白的等电点偏碱性,而CpABCB1~CpABCB11转运蛋白的等电点偏酸性;当不稳定系数>40时,该蛋白不稳定蛋白,通过预测发现除CpABCB4(不稳定系数40.18)属于不稳定蛋白外,其余MDR蛋白均属于稳定蛋白;MDR蛋白的平均疏水性(grand average of hydropathicity, GRAVY)值均>0,表明MDR蛋白均为疏水性蛋白(表3).
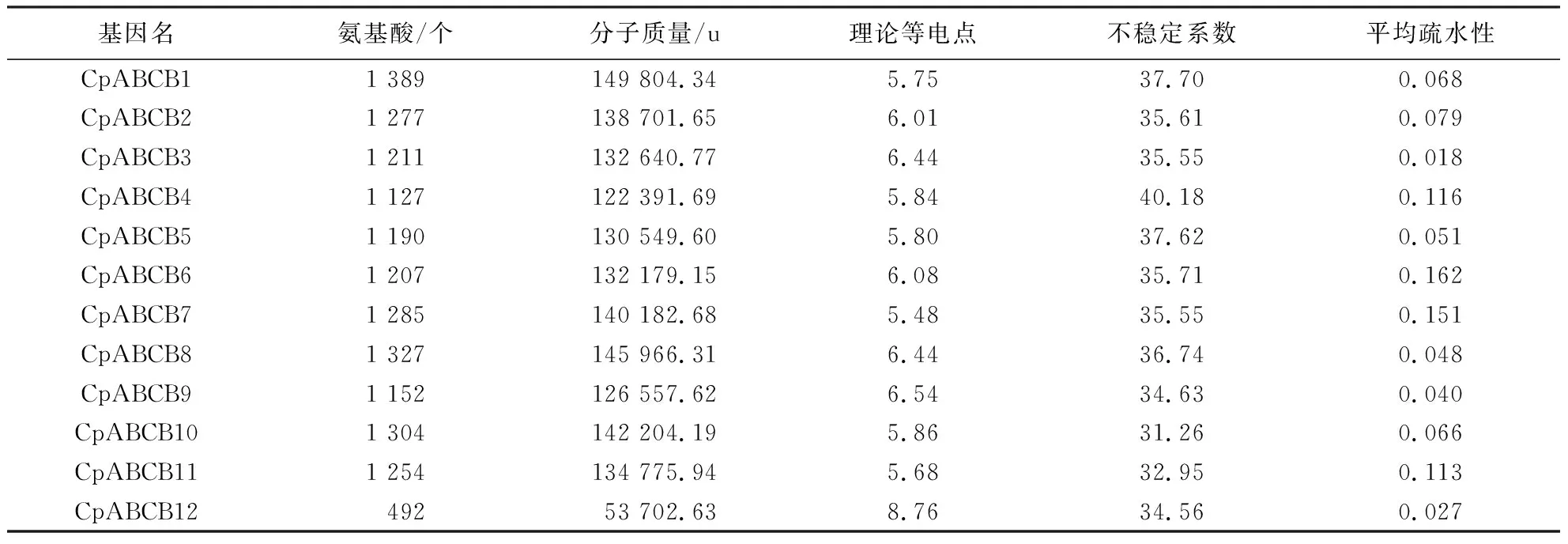
表3 MDR转运蛋白理化性质Table 3 Physicochemical properties of MDR transporter
2.3 MDR蛋白结构分析
桉树焦枯病菌MDR转运蛋白的二级结构采用PHIL的PHD在线服务进行分析,结果表明桉树焦枯病菌MDR转运的蛋白的组成均相同,分别为α-螺旋(α-helix)、β-折叠(β-sheet)和无规则卷曲(random coil).且桉树焦枯病菌MDR转运蛋白α-螺旋、β-折叠和无规则卷曲的占比差异性不大,占比从高到低的排列顺序为α-螺旋>无规则卷曲>β-折叠(图1).从分布上来说,CpABCB1~CpABCB11转运蛋白的结构域为(TMD-NBD)2,α-螺旋和β-折叠均匀分布在N端和C端.而CpABCB12的结构域为TMD-NBD,α-螺旋主要分布在N端.桉树焦枯病菌MDR转运蛋白的三级结构采用Swiss-model在线功能进行预测分析,结果共获得12个MDR转运蛋白的预测模型,预测结果与前面的二级结构预测结构基本一致(图2).CpABCB1~CpABCB11转运蛋白的三级结构主要由2个TMD结构域和2个NBD结构域组成,且N端和C端各有1个TMD结构和1个NBD结构.而CpABCB12转运蛋白只有1个TMD结构和1个NBD结构,N端为TMD,C端为NBD,半分子ABCB转运蛋白的NBD及TMD结构域可通过形成二聚体行使功能.上述结果说明这12个MDR转运蛋白均有明显的ABC转运蛋白的结构特征,因而具有MDR转运蛋白的活性和功能.
采用SAVES在线软件对12个MDR转运蛋白的预测结构进行质量评估,由拉氏构象(Ramachandran Plot)发现,除CpABCB10转运蛋白核心区域的残基位点仅占85.9%以外,其余MDR转运蛋白核心区域的残基位点均占90%以上.3D-1D Score>0.2的残基位点占65%以上即可证明,二面角是合理的氨基酸残基占绝大多数,具有稳定的空间结构,为合理的模型.所有MDR转运蛋白的3D-1D Score>0.2的残基位点均占80%以上.上述结果表明,Swiss-model预测的12个MDR转运蛋白均具有稳定的空间结构,所预测的模型合理.
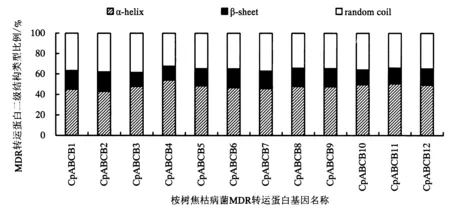
图1 MDR转运蛋白二级结构占比Fig.1 Proportion of secondary structure of MDR transporter
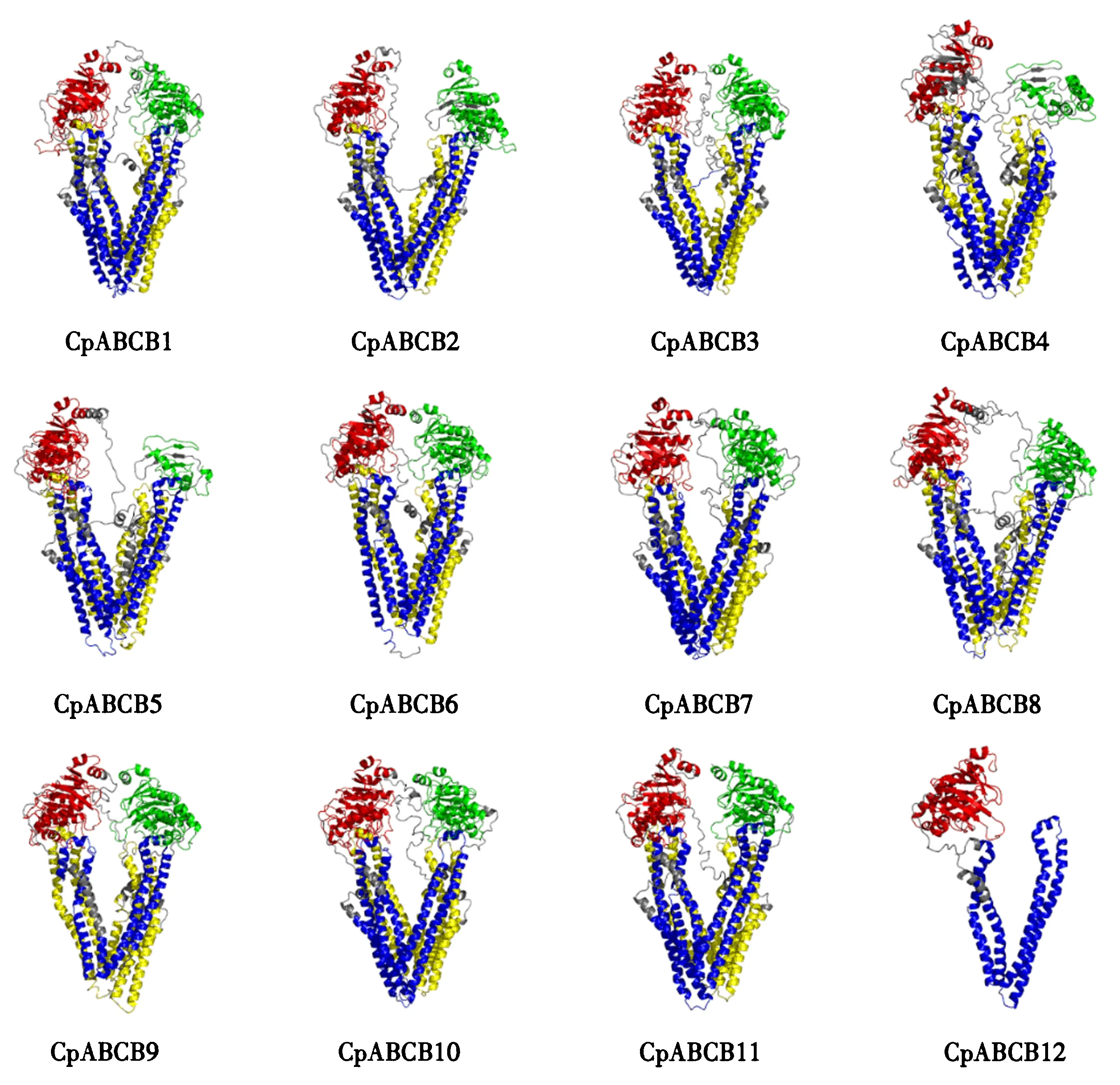
图2 MDR转运蛋白三级结构Fig.2 3D structure of MDR transporter
2.4 MDR基因表达分析
2.4.1 总RNA浓度及质量检测 超微量分光光度计检测结果显示,提取的RNA浓度在390至3100 μg·μL-1范围内,D260 nm/D280 nm均在1.8至2.2范围内,RNA无降解,纯度较好.总RNA的浓度和纯度均满足后续实验要求.
2.4.2 凝胶电泳检测结果 总RNA凝胶电泳结果如图3所示,总RNA具有典型的3种带型(28s、18s和5s),无可见的DNA污染.且条带是清晰并无拖拽的,表明提取的总RNA完整性良好,满足后续试验.
M为marker,1为CK1,2为H2O2,3为NaCl,4为KCl,5为LiCl,6为CK2,7为放线菌酮,8为苦参碱,9为芦竹碱,10为百菌清,11为孢子阶段,12为萌发阶段,13为接种48 h的对照组,14为接种48 h,15为CK3,16为接种24 h,17为CK4,18为接种,19为咪康唑.图3 总RNA凝胶电泳结果Fig.3 Electrophoresis results of total RNA
2.4.3MDR基因表达分析 采用qPCR的方法分析桉树焦枯病菌在分生孢子阶段、分生孢子萌发阶段、桉树焦枯病菌接种桉树叶片24、48和72 h后及焦枯病菌在含H2O2、NaCl、KCl、LiCl、放线菌酮、苦参碱、芦竹碱、百菌清和咪康唑诱导下的表达情况.采用-△△Ct进行计算,并采用生信人热图工具记录12个MDR基因在14种条件下的表达情况.红色代表下调表达,蓝色代表上调表达,且颜色越深代表表达越显著(图4).结果表明,仅CpABCB10基因在分生孢子及分生孢子萌发阶段上调表达.
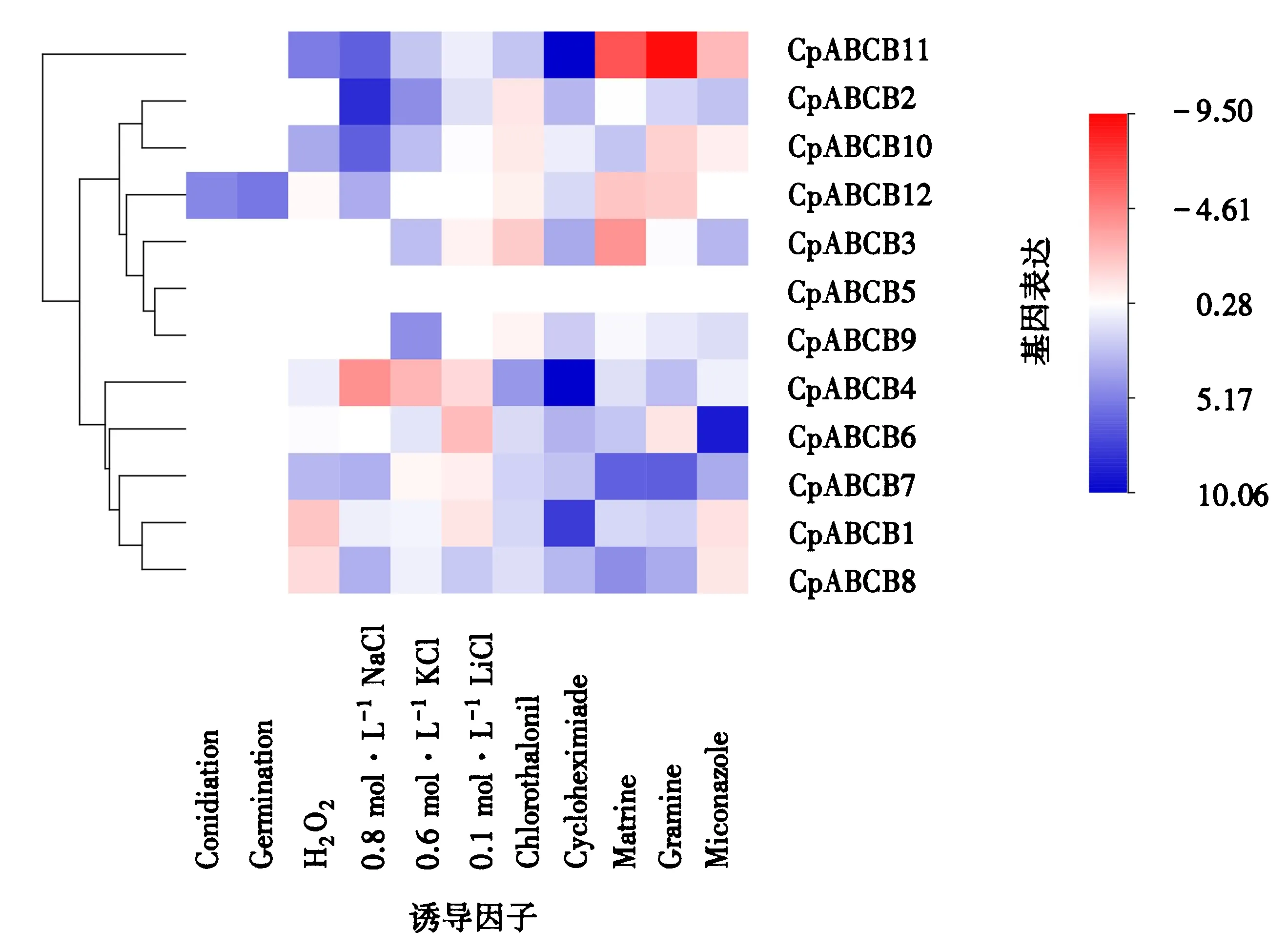
图4 MDR基因不同诱导条件下的表达情况Fig.4 The expression levels of MDR genes under different induction conditions
MDR基因在NaCl、KCl和LiCl条件下均发生不同程度的表达.NaCl和KCl胁迫下,均有5个MDR基因发生上调表达,1个基因发生上调表达.其中,CpABCB4基因在NaCl胁迫下表达倍数最高.KCl胁迫下CpABCB4和CpABCB5基因的表达情况均有较高的表达倍数;LiCl胁迫下,仅有2个基因发生上调表达,4个基因发生下调表达,且上调表达的CpABCB4和CpABCB9基因均不显著.
氧胁迫下,仅有CpABCB1基因在H2O2诱导下发生下调表达,CpABCB4、CpABCB6、CpABCB7、CpABCB8、CpABCB9和CpABCB11基因均发生上调表达.其中,CpABCB11基因的表达量最高.上述结果说明,CpABCB4、CpABCB6、CpABCB7、CpABCB8、CpABCB9和CpABCB11基因均能介导氧胁迫,且CpABCB11基因发挥主要作用.
MDR基因在放线菌酮、苦参碱、芦竹碱、百菌清和咪康唑胁迫下均发生不同程度的表达.百菌清诱导下,共有6个MDR基因发生上调表达,5个MDR基因发生下调表达,CpABCB8基因的表达倍数远高于其他MDR基因.放线菌酮诱导下,除CpABCB3基因外,其余MDR基因均发生上调表达.苦参碱和芦竹碱诱导下,分别有5个和6个基因发生上调表达,且均有4个基因发生下调表达.同时,表达倍数最高的均为CpABCB7基因.在咪康唑诱导下,共有6个基因发生上调表达,3个基因发生下调表达,且表达倍数最高的为CpABCB2基因.此外,有且仅有CpABCB7和CpABCB8基因在5种药物诱导下均发生表达.有部分基因在3种或4种药物诱导下能够上调表达,多数基因均能在2种及2种以上的药物诱导下发生上调表达.上述结果表明,CpABCB7和CpABCB8基因与桉树焦枯病菌对这5种药物的交替抗药性存在一定关联,还有部分基因与桉树焦枯病菌对3种或4种药物的交替抗药性存在一定关联.
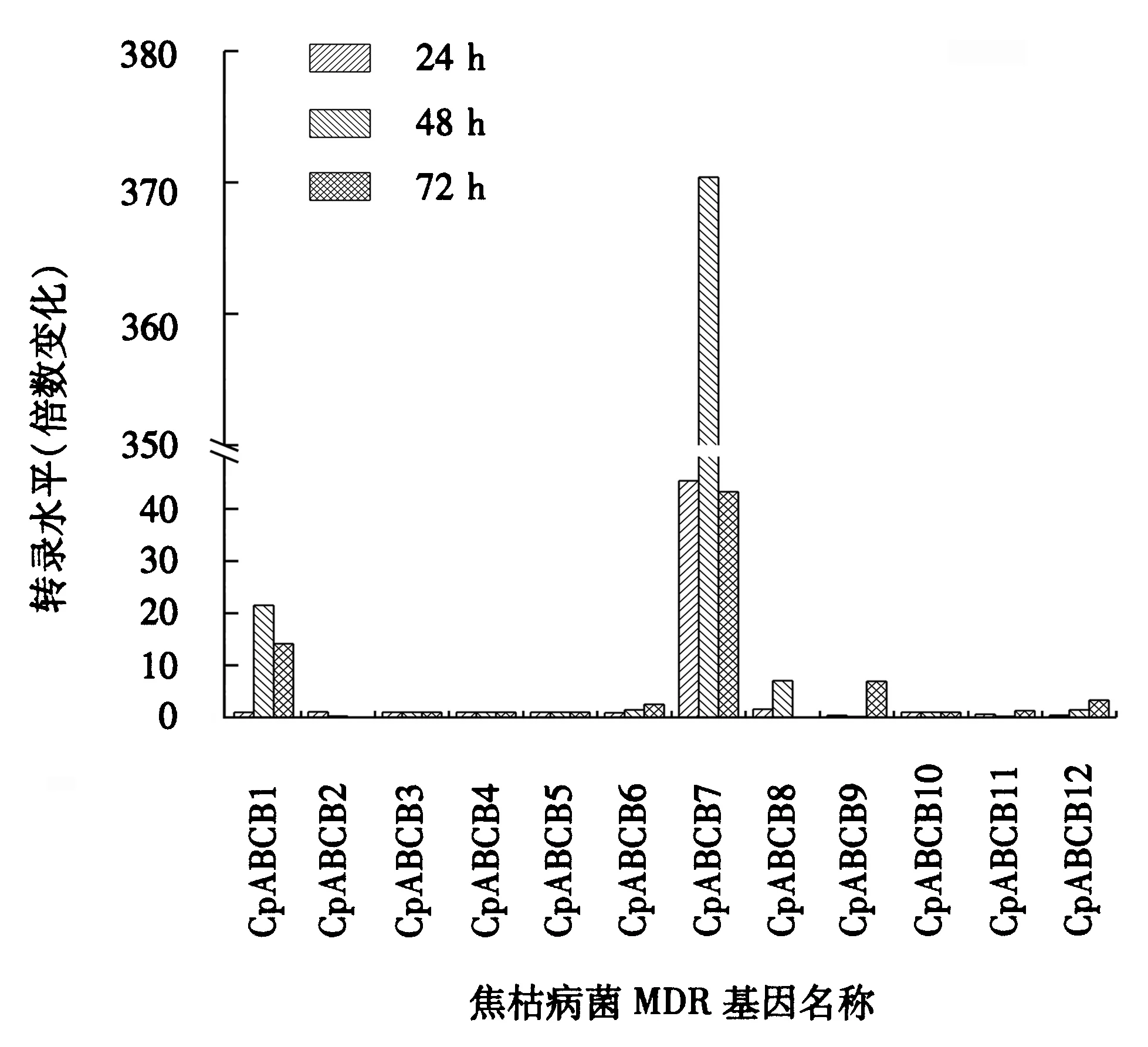
图5 MDR基因不同侵染阶段趋势图Fig.5 Trend plot of MDR gene at various infection stages
MDR基因在桉树焦枯病菌接种24 h、48 h和72 h后均发生不同程度的表达,不同基因在不同侵染阶段的表达趋势有所不同.图5显示,桉树焦枯病菌接种24 h后,仅有CpABCB7基因发生上调表达.桉树焦枯病菌接种48 h后,上调表达的基因由1个变为3个,除CpABCB7基因外,CpABCB1和CpABCB8基因也发生上调表达,且CpABCB7基因的表达倍数最高.树焦枯病菌接种72 h后,上调表达的基因增加至5个,CpABCB1和CpABCB7基因仍然发生上调达标,CpABCB8基因由上调表达变为下调表达,CpABCB6、CpABCB9和CpABCB12基因在此阶段发生上调表达.在桉树焦枯病菌接种24 h、48 h和72 h这3个阶段中,仅CpABCB7基因均发生上调表达,且表达倍数在这3个阶段均为最高,表达趋势先上升后下降.上述结果说明,CpABCB8基因桉树焦枯病菌仅在接种24 h后发挥作用;CpABCB1基因可能在桉树焦枯病菌接种24 h、48 h发挥较为重要的作用;桉树焦枯病菌接种72 h时,CpABCB6、CpABCB9和CpABCB12基因均可能发挥作用.
3 结论与讨论
MDR转运蛋白广泛存在于植物病原真菌中,主要分布于菌体细胞膜上,其功能主要与多药抗药性有关,通过转运抗真菌药物获得毒素以达到对真菌起到保护作用.本研究共从桉树焦枯病菌C.pseudoreteaudiiYA51全基因组进发现12个MDR转运蛋白.MDR转运蛋白属于ABCB亚族,其全分子结构域的拓扑结构应为(TMD-NBD)2型,除CpABCB12是结构为TMD-NBD半分子ABCB转运蛋白外,其余均为全分子[11].蛋白功能与蛋白结构密切相关,为了解MDR转运蛋白的功能与结构间联系,本研究通过对二级结构及三级结构进行预测,初步获得MDR转运蛋白三级结构的预测结果.且所预测的12个MDR转运蛋白的均具有稳定的空间结构,所预测模型均是合理的.三级结构与二级结构为典型的ABC转运蛋白[16-19],说明MDR基因的进化关系较为保守.
为解析MDR基因参与调控桉树焦枯病菌的具体功能,通过qPCR检测12个MDR基因在不同条件下的表达情况.结果表明,桉树焦枯病菌MDR基因在各种条件下均发生不同程度的表达.稻瘟菌ABC4基因被证明与芽管的萌发有关[20],稻瘟菌MoABC5、MoABC6和MoABC7基因也可参与维持分生孢子的稳定性[21].但尚未有研究表明ABCB基因参与调控芽管的萌发.在孢子及孢子萌发阶段,仅CpABCB10基因发生上调表达,说明桉树焦枯病菌MDR基因中仅CpABCB10基因可能参与调控孢子萌发.Zwiers et al[22]研究表明M.graminicola的MgAtr7基因与重金属离子的转运有关,且可通过该功能来维持菌体内离子的动态平衡.稻瘟菌ABC4基因还与Na+离子的转运有关.为明确MDR基因与金属离子的转运之间是否存在联系,通过qPCR对该功能进行初步研究,结果表明,MDR基因在3种离子条件下均有不同程度表达,NaCl条件下表达倍数最高的是CpABCB4基因,而KCl和LiCl条件下表达量最高的均是CpABCB9基因,说明CpABCB4和CpABCB9基因参与调控金属离子的转运,而其他基因可能发挥辅助作用或负调控作用.
随着桉树焦枯病菌的持续爆发,杀菌剂在防治过程中获得广泛应用,这可能导致病原菌对杀菌剂的抗药性持续增强.MDR转运蛋白则可通过将杀菌剂转运出病原菌体外来获得抗药性.楼天灵等的研究表明小麦赤霉菌在戊哇醇和朴海因处理后,FGSG_09697.3(MDR)基因的表达量比处理前分别上升了13.88倍和5.23倍,由该结果可知MDR基因与药剂敏感性之间有一定联系[5].粉红粘帚霉(Gliocladiumroseum)IK726的ABC基因ABC3260在绿针假单胞菌(Pseudomonascholoeaphtis)MA342发酵液诱导6 h后既发生上调表达等[23,24].而桉树焦枯病菌在放线菌酮诱导下CpABCB11基因的表达倍数最高,在百菌清和咪康唑诱导下CpABCB8和CpABCB2基因中表达倍数最高.CpABCB7基因苦参碱、芦竹碱中表达倍数均为最高.上述结果表明CpABCB7和CpABCB8基因可参与调控桉树焦枯病菌对外源化学的交替抗药性.
病原菌侵染寄主过程中,寄主可通过释放大量H2O2和次生代谢物质来抵抗病原菌的侵袭.Sun et al[4]研究表明稻瘟病菌ABC3转运蛋白参与氧化应激应答反应,并参与调控稻瘟病菌渗透和突破寄主.稻瘟菌MoABC5、MoABC6和MoABC7基因均可对H2O2产生应激响应.通过qPCR检测发现,桉树焦枯病菌中有多个MDR基因在H2O2条件下均发生上调表达.同时,楼天灵[5]通过对小麦赤霉菌MDR基因FGSG_06771.3的敲除发现,其致病能力显著下降.稻瘟菌ABC3基因病原菌对寄主的突破和渗透相关.本研究推测桉树焦枯病菌MDR基因可能存在类似的机制.CpABCB1、CpABCB6、CpABC7、CpABCB8、CpABCB9基因在焦枯病菌侵染桉树不同阶段均发生不同程度的表达.此外,MDR基因除转运杀菌剂外,还可通过转运植物源化学物来避免其对自身的毒害作用,如灰霉菌BcatrB转运蛋白在侵染拟南芥的过程中通过转运拟南芥分泌的植保素(亚麻芥素)来现菌株对拟南芥的成功侵染[25].赤霉菌(Gibberellapulicaris)MDR转运蛋白Gpabc1参与转运马铃薯产生的抗真菌毒素,使其能够抵御马铃薯块茎产生的抗真菌毒素的毒害作用[26].MDR基因在植物源化学物苦参碱和芦竹碱诱导下,分别有5个和6个基因发生上调表达.上述结果说明MDR基因可能与该机制有关.此外,在H2O2、植物源化学物诱导下及侵染过程,有且仅有CpABCB7基因均发生上调表达,说明CpABCB7基因可参与桉树焦枯病菌侵染寄主的整个过程.
上述结果表明,CpABCB10可能参与调控分生孢子稳定性和孢子萌发,CpABCB4和CpABCB9基因可参与调控金属离子的转运,CpABCB7和CpABCB8基因参与调控桉树焦枯病菌的抗药机制.此外,CpABCB7基因还能参与调控桉树焦枯病菌的整个致病过程.其余MDR基因发挥辅助作用或负调控作用.本结果为研究MDR基因的具体功能提供数据支撑,也可为研究MDR基因与桉树焦枯病菌致病和抗药分子机制之间的联系奠定基础.
