武夷岩茶对糖尿病大鼠肠道菌群的调节作用
2019-01-25马玉仙蒋慧颖曾文治雷郑延刘芷君杨江帆
马玉仙, 蒋慧颖, 曾文治, 雷郑延, 周 欢, 刘芷君, 倪 莉, 杨江帆
(1.福建农林大学园艺学院,福建 福州 350002;2.福州大学生物科学与工程学院食品科技研究所,福建 福州 350108)
现有的研究表明,肠道菌群与宿主之间具有相互作用的关系,健康人体肠道微生物的种类丰富,微生态稳定;而肠道菌群失衡则会引起一系列炎症的发生,进而使得宿主发生多种疾病[1-2].糖尿病是一类代谢性的疾病,发生原因复杂.越来越多的学者研究表明,肠道菌群与糖尿病之间有一定的相关性,从肠道菌群的角度来研究糖尿病已经成为一种趋势[3].链脲佐菌素(streptozotocin, STZ)是一种常见的致糖尿病的药物,具有造模率高、操作简单、模型稳定性好等特点.茶叶含有茶多酚、茶氨酸等天然活性物质,具有减肥降脂、抗氧化、调节肠道菌群、降血糖等功效[4-6],目前国内外对茶叶保健功效的研究很多,而关于茶叶调节糖尿病肠道菌群的研究寥寥无几.因此,本试验选取具有福建特色的武夷岩茶作为试验材料,试图探明茶叶对糖尿病大鼠肠道菌群的影响,旨在为茶叶降糖的深入研究提供依据.
1 材料与方法
1.1 材料
1.1.1 动物及茶样 SPF级健康成年雄性Wistar大鼠重(200±20) g,由上海斯莱克试验有限责任公司供应[许可证号:SCXK(沪)2012-0002],饲养地点在福建医科大学试验中心屏障动物试验室.大鼠饲养环境室温20~25 ℃,相对湿度40%~70%,明暗交替条件为12 h∶12 h. 武夷岩茶采购于武夷山正山世家茶业有限公司.
1.1.2 试剂 氯仿分析纯采购于江苏南通联海生物科技有限公司;粪便基因组DNA提取试剂盒(DP328)采购于北京天根生化科技有限公司;STZ(批号:S0130-1G)、柠檬酸、柠檬酸钠采购于北京博爱科贸有限公司.
1.1.3 仪器与设备 仪器与设备有AR5120 Sartorius电子分析天平(上海创未生物技术有限公司)、 5417R型高速离心机(德国Eppendorf公司)、TGL-16台式高效速冷离心机(湘仪离心机仪器有限公司)、HH-4型数显恒温水浴锅(常州国华电器有限公司)、 ULT1386-5-V41型-80 ℃超低温冰箱(赛默飞世尔科技有限公司)、GNP-9160型隔水式恒温培养箱(上海精宏试验设备有限公司)、SW-CJ-IFD型单人单面净化工作台(上海苏净实业有限公司)、WSZ-160A型漩涡振荡器(上海一恒科技有限公司)、YXOSG41280型手提式压力蒸汽灭菌锅(上海医用核子仪器厂).
1.2 武夷岩茶茶汤的制备
取100 g武夷岩茶,沸水浸提3次,茶水比分别为1∶20、1∶20、1∶10,提取时间分别为20、20、10 min,合并提取液,减压低温至(60±1) ℃,浓缩至100 mL,装瓶灭菌放至冰箱(4 ℃)中备用.灌胃前,将提取液摇匀使用[7].
1.3 STZ的配制
1.3.1 柠檬酸的配制 在2.1 g柠檬酸中加入100 mL双蒸水配制0.1 mol·L-1柠檬酸.
1.3.2 柠檬酸钠的配制 在2.94 g柠檬酸钠中加入100 mL双蒸水配制0.1 mol·L-1柠檬酸钠.
1.3.3 柠檬酸缓冲液的配制 28 mL 0.1 mol·L-1柠檬酸与22 mL 0.1 mol·L-1柠檬酸钠混合后,用双蒸水定容至100 mL,调节pH至4.2.
1.3.4 STZ的配制 在避光条件下,将STZ溶解于0.1 mol·L-1柠檬酸缓冲液中,配制成的1% STZ置于冰浴上,现配现用.
1.4 动物造模及分组
1.4.1 造模 将50只雄性健康大鼠适应性喂养一周.随机选取10只作为正常对照组,剩余40只作为试验组.试验组大鼠禁食24 h,连续2 d腹腔注射STZ,每次剂量30 mg·kg-1[8].正常对照组大鼠持续2 d腹部注射相同剂量的柠檬酸缓冲液.注射72 h后,大鼠禁食8 h,检测大鼠尾静脉血糖,当血糖值≧16.7 mmol·L-1,且伴随着“三多一少”症状(多饮,多食,多尿,体重减少),即造模成功.
1)武夷岩茶的剂量均以大鼠体重来计算.
1.4.2 动物分组 将糖尿病大鼠随机分成武夷岩茶高、中、低剂量组和模型对照组.按表1的剂量[9],连续灌胃30 d.
1.5 肠道内容物的采集
30 d后,结束灌胃.大鼠空腹12 h,腹腔注射2 mL·kg-1水合氯醛进行麻醉,以剖开腹腔的方式处死大鼠,收集大鼠盲肠的肠道内容物,放在冰箱(-80 ℃)中备用.
1.6 肠道内容物DNA的提取和Illumina高通量测序
采用DNA提取试剂盒提取肠道内容物DNA,用2%琼脂糖凝胶电泳检测DNA的纯度和浓度,提取的DNA置-20 ℃条件下保存[10].取适量DNA样品于离心管中,用无菌水将样品稀释至1 ng·μL-1,根据V3~V4区序列,合成带有Barcode的特异引物,引物序列为515F(5′-CCTAYGGGRBGCASCAG-3′)和806R(5′-GGACTACNNGGGTATCTAAT-3′),以稀释后的基因组DNA为模板,进行PCR扩增.根据PCR产物浓度进行等量混样,充分混匀后,采用2%琼脂糖凝胶电泳检测PCR产物,回收目的条带.将PCR产物送至北京诺禾致源生物信息科技有限公司建库,使用HiSeq2500 PE250测序平台进行上机测序.
将测序得到的原始数据进行拼接、过滤,除去低质量的序列,得到有效数据.利用Uparse软件,对所有组别的全部有效序列进行聚类,默认以97%的一致性将序列聚类成为OTU,进一步将 OTU的代表序列进行物种注释,将其结果绘制成稀疏曲线.基于样品测序产生的OTU结果,对单个样品的物种丰度(包含Chao指数、ACE指数)进行分析,计算单个样本的Alpha多样性(即Shannon指数),指数的大小对应着样本中物种的多样性丰富程度,二者呈正比.
1.7 数据分析
试验数据采用SPSS 17.0软件分析,并进行t检验,以平均值±标准差表示.
2 结果与分析
2.1 大鼠肠道内容物DNA的测序基本数据
提取正常对照组,模型对照组,武夷岩茶高、中、低剂量组5组大鼠肠道内容物的DNA,采用Illumina HiSeq测序平台进行测序,在16S rDNA V3~V4区中获得的高质量序列数为3 387 619条,样本序列数为62 422~79 397条,平均序列数为72 077条,平均序列长度为409 bp.由图1的稀释曲线可知,各组OTU数量的变化与测序数量的增长呈正比,增大的幅度会随着测序数量的增加而逐渐变缓,说明测序深度已经基本覆盖到样品中的所有物种.
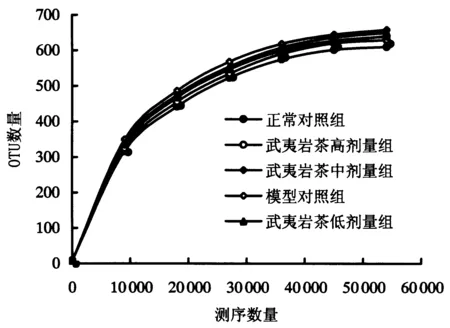
图1 肠道菌群的稀释曲线Fig.1 Rarefaction curve analysis of intestinal microflora
2.2 大鼠肠道菌群物种的丰度与多样性
OTU数量[11]表示大鼠肠道内容物中微生物的丰度,数值越大表明微生物越丰富.从表2可知,与正常对照组相比,糖尿病组大鼠的OTU数量显著增加(P<0.05),武夷岩茶各剂量组可以显著抑制这种趋势,其抑制效果与武夷岩茶的剂量呈正相关.
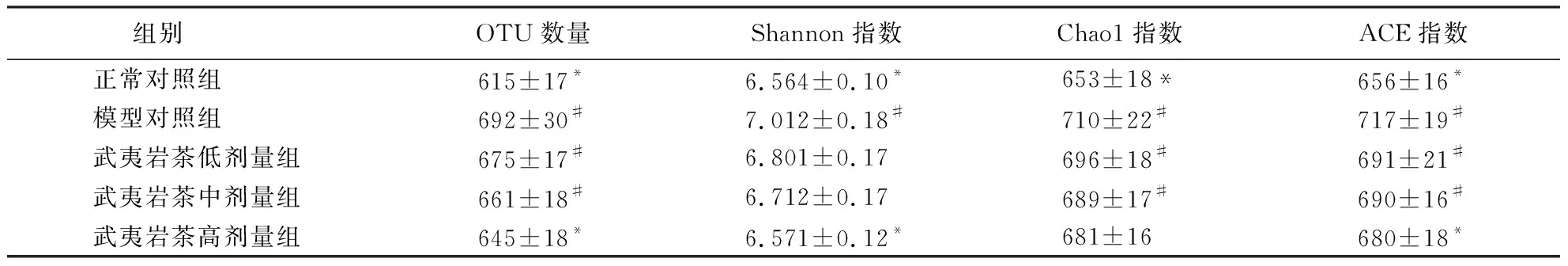
表2 大鼠肠道内容物的OTU数量及Alpha多样性1)Table 2 OTU number and Alpha diversity of fecal microflora in all groups
1)与模型对照组比较,*表示P<0.05;与正常对照组比,#表示P<0.05.
ACE指数、Chaol指数和Shannon指数越大表明肠道菌群结构的丰度越高,多样性越丰富[12].表2显示:与正常对照组相比,模型对照组大鼠的ACE指数、Chaol指数显著升高(P<0.05),而武夷岩茶各剂量组的丰度均低于模型对照组,其中,武夷岩茶高剂量组的ACE指数显著低于模型对照组(P<0.05),表明武夷岩茶可以降低糖尿病大鼠肠道菌群的丰度.与正常对照组相比,糖尿病大鼠的Shannon指数显著上升(P<0.05),武夷岩茶各剂量组则抑制了这种趋势,其中,武夷岩茶高剂量组的效果显著(P<0.05).可见,糖尿病显著提高了大鼠肠道菌群的多样性,而武夷岩茶可以抑制这种趋势,其中以武夷岩茶高剂量组的效果最佳.
2.3 大鼠肠道的整体群落结构
图2显示,各组大鼠肠道微生物在门的水平组成上主要包括厚壁菌门、拟杆菌门、变形菌门、放线菌门等,其中,厚壁菌门和拟杆菌门约占序列总数的80%.与正常对照组(29.2%)相比,糖尿病组大鼠的拟杆菌门含量显著降低至20.7%(P<0.05),武夷岩茶各剂量组则有效抑制了这种现象,其中以武夷岩茶高剂量组的抑制效果最为显著(P<0.05),拟杆菌门的含量为25.7%;与正常对照组(4.06%)相比,糖尿病组变形菌门的含量增加至13.19%(P<0.05),灌胃武夷岩茶后,变形菌门的相对丰度均下降,其中以武夷岩茶高剂量组的效果最为显著(P<0.05),变形菌门的含量为6.09%.
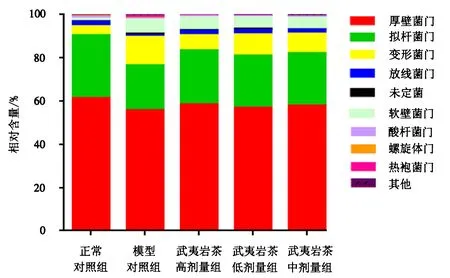
图2 门水平上大鼠肠道菌群的分布Fig.2 Relative abundance of rat intestinal microflora at phylum level
图3显示,在属的水平上,各组大鼠肠道微生物相对丰度较高的为乳酸杆菌属.Allobaculum是一种有益菌,对肠道具有一定的保护作用.糖尿病组大鼠的肠杆菌属含量由正常对照组的0.13%上升至0.32%,埃希氏菌—志贺菌氏属含量由正常对照组的0.29%上升至2.39%,克里斯滕森氏菌属含量由正常对照组的2.43%上升至8.00%,这3种属的含量都明显上升(P<0.05);糖尿病组大鼠的Romboutsia含量由正常对照组的10.06%下降至5.07%,瘤胃球菌属含量由正常对照组的1.67%下降至1.0%,双歧杆菌属含量由正常对照组的0.6%下降至0.1%,Allobaculum含量由正常对照组的4.15%下降至了1.0%,这4种属的含量下降明显(P<0.05).灌胃武夷岩茶后,糖尿病大鼠的肠道菌群开始恢复正常,其中以武夷岩茶高剂量组的效果显著,表明武夷岩茶能改善糖尿病大鼠肠道的菌群结构.
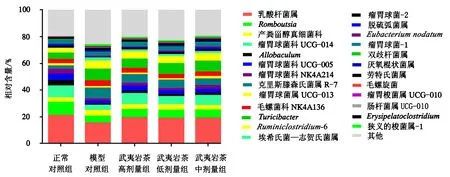
图3 属水平上大鼠肠道菌群的分布Fig.3 Relative abundance of rat intestinal microflora at genus level
2.4 大鼠肠道菌群结构的差异性
将属水平丰度排名在前25的菌群,以不同组间丰度相似性聚类的方式制作热图.热图是通过不同颜色来反映各组大鼠肠道菌群结构组成的相似性和差异性,样品聚类树为各组大鼠间基于群落组成的层次聚类分析结果.从样品聚类树和各组菌群的颜色(图4)可以看出,糖尿病组与正常对照组的差异显著,武夷岩茶各剂量组与模型对照组之间具有差异性,武夷岩茶高剂量组与中剂量组的相似性较高.表明武夷岩茶能改善糖尿病大鼠肠道的菌群结构,其中以武夷岩茶高剂量的改善效果好.
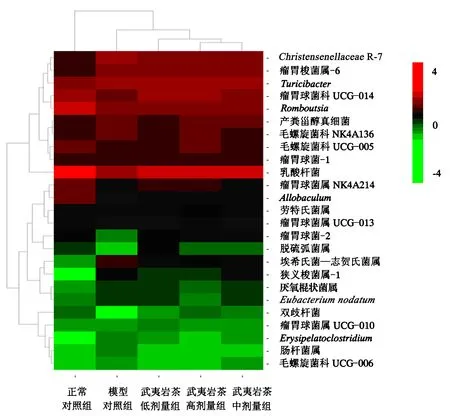
图4 大鼠肠道菌群的热图和聚类树Fig.4 Heat map analysis of rat intestinal flora
3 讨论
本试验以武夷岩茶为研究对象,采用高通量测序技术检测糖尿病大鼠肠道菌群的变化,发现糖尿病大鼠肠道菌群的多样性明显高于正常对照组(P<0.05),这与张芹等[13]的研究结果一致.对糖尿病大鼠灌胃不同剂量的武夷岩茶后,其肠道菌群的多样性显著降低(P<0.05),且多样性的减少与武夷岩茶的剂量呈正相关.同时,本试验还发现糖尿病的发生会引起肠道菌群的失调,这与李先锋等[14]、肖党生等[15]的研究结果一致,证明糖尿病的发生影响了肠道菌群的种类和数量,而肠道菌群在糖尿病的发展过程中起着关键作用.
肠道菌群中拟杆菌门和厚壁菌门的丰度与糖尿病的发生密切相关,它们主要参与了肠道内糖、脂的代谢等过程,对宿主的健康起重要作用[16-17].王雯玲[18]研究表明,糖尿病大鼠拟杆菌门和厚壁菌门的数量显著下降,变形菌门的数量减少.Larsen et al[19]对糖尿病患者肠道菌群的研究表明,糖尿病患者中拟杆菌的数量显著减少,与本试验的研究结果一致.而本试验灌胃武夷岩茶后,相对于模型对照组大鼠,武夷岩茶组大鼠体内拟杆菌门的相对丰度增大,变形菌门的相对丰度减小,推测这可能与武夷岩茶的降糖作用有关.乳酸杆菌会调节肠道的pH,同时产生H2O2抑制病原菌在肠道内的增值,以保持肠道微生态的平衡.刘婷婷[20]对比2型糖尿病患者与正常对照人群,发现糖尿病患者肠道的乳酸杆菌数量显著高于正常对照人群(P<0.001);而本试验结果表明,正常对照组大鼠肠道的乳酸杆菌相对丰度高于模型对照组,与张芹等[13]的研究结果一致.陈佩等[21]对糖尿病小鼠灌胃鼠李糖乳酸杆菌的结果表明,鼠李糖乳酸杆菌可显著降低糖尿病小鼠的血糖含量.图3、4显示,灌胃武夷岩茶后,乳酸杆菌、Allobaculum、肠杆菌、瘤胃球菌的相对丰度都有所恢复,其中,武夷岩茶高剂量组的相对丰度接近于正常对照组,揭示了武夷岩茶可能是通过对这些菌的调节作用,起到降低大鼠血糖的效果.
本试验结果表明,糖尿病大鼠的肠道菌群出现了失调现象,武夷岩茶可以调节这种现象,调节作用与武夷岩茶的剂量呈正相关.
