双特异性溶瘤腺病毒通过调节活性氧引起人肺癌细胞凋亡
2019-01-25张冬娜蒋本春房金波马艺珍朱羿龙朱光泽金宁一
白 冰,张冬娜,蒋本春,房金波,马艺珍,朱羿龙,朱光泽,李 霄,金宁一
(长春中医药大学吉林省院士工作站,长春 130117)
肺癌是全世界最常见的恶性肿瘤之一,其发病率与死亡率在过去几十年间迅速增长,已成为我国城市人口恶性肿瘤死亡原因的第一位。非小细胞肺癌包括腺癌、大细胞癌,鳞状细胞癌,与小细胞肺癌相比具有癌细胞生长分裂速度慢,扩散转移晚等特点。非小细胞肺癌发生率约占所有类型肺癌的80~85%,约75%的患者发现时已处于中晚期,五年生存率极低[1]。肺癌占所有男性癌症的18%,占全部女性癌症的7%。
近十年来,世界各国已经应用多种溶瘤腺病毒在Ⅰ期和Ⅱ期临床实验中对数百位患者进行治疗,而且中国已经率先批准了溶瘤腺病毒用于肿瘤治疗,美国和欧洲目前也在进行有关溶瘤腺病毒的Ⅲ期临床试验[2]。Onyx-015是由美国Onyx公司开发的一种能够在肿瘤细胞中特异性复制并裂解肿瘤细胞的腺病毒药物。Onyx-015可与化疗联合运用于肿瘤治疗,具有良好的疗效。研究表明,溶瘤腺病毒对对肺癌[3]、膀胱癌[4]、前列腺癌[5]、乳腺癌[6]、胃癌[7]等多种肿瘤细胞均有显著性抑制作用。本研究所采用的基于肿瘤特异性启动子hTERTp、病毒复制必须基因E1A和凋亡素基因Apoptin通过RAPAd.I腺病毒载体系统构建而成的溶瘤腺病毒ATV是由李霄[8]等构建,具有肿瘤特异性杀伤和肿瘤特异性复制能力的双特异性溶瘤腺病毒。ATV通过诱导肿瘤细胞凋亡抑制肿瘤细胞增殖,ATV诱导人宫颈癌细胞及人肺癌细胞凋亡的凋亡率分别可达到(45.315±5.013)%[9]和(73.96±2.31)%[10]。本研究通过CCK-8检测、Hoechst染色、Annexin V-FITC/PI流式细胞术、胞浆活性氧检测一系列体外实验验证双特异性溶瘤腺病毒可通过调节活性氧水平引起人肺癌细胞凋亡。
1 材料与方法
1.1 细胞、病毒与主要试剂 双特异性溶瘤腺病毒(ATV)由本实验室构建并保存,人肺癌细胞A549由本实验室冻存。0.25%胰酶,胎牛血清购自BI公司;F12培养液购自Hyclone公司;CCK-8检测试剂盒购自东仁化学科技有限公司;Hoechst染料购自美国Lf i e公司,Annexin V-FITC/PI凋亡检测试剂盒购自BD公司;人活性氧(ROS)ELISA试剂盒购自默沙克生物科技公司。
1.2 CCK-8检测法检测A549细胞增殖 将处于对数生长期的A549细胞以5×103个/孔密度培养于96孔板中,于37 ℃,5% CO2培养箱中培养24 h,用1、10、50 moi两种重组腺病毒ATV和Ad-Mock感染A549细胞,继续培养12、24、48、72 h,每孔加入10 μL CCK-8,于37 ℃,5% CO2培养箱中孵育2 h,用酶标仪在450 nm测定各孔OD值,通过公式计算ATV对两种细胞抑制率,确定最佳感染剂量。
1.3 Hoechst染色法检测A549细胞的凋亡情况 将处于对数生长期的A549细胞以4×105个/孔密度培养于6孔板中,于37 ℃、5% CO2培养箱中培养24 h,用50 moi的两种重组腺病毒ATV和Ad-Mock分别感染两种细胞,于培养箱中继续培养12、24、48、72 h,每孔加入稀释后的Hoechst 100 μL,避光孵育15 min,倒置在荧光显微镜下拍照并分析结果。
1.4 Annexin V-FITC/PI流式法检测ATV诱导A549细胞凋亡率 将处于对数生长期的A549细胞以2.5×105个/孔密度培养于6孔板中,于37 ℃,5%CO2培养箱中培养24 h,用50 moi两种重组腺病毒ATV和Ad-Mock感染A549细胞,于培养箱中继续培养12、24、48、72 h,向细胞中加入Annexin V-FITC和PI,避光孵育20 min,利用FACS流式细胞仪进行检测并分析结果。
1.5 胞浆活性氧检测 将处于对数生长期的A549细胞以5×103个/孔密度培养于96孔板中,于37 ℃,5%CO2培养箱中培养24 h,用50 moi两种重组腺病毒ATV和Ad-Mock感染A549细胞,于12、24、48、72 h用活性氧检测试剂盒中的样品稀释液将细胞吹下,超声破碎3 000 r/min离心10 min,取上清为待检样品。参照说明书将样品稀释液 48 μL,及上述各待测样品 2 μL加于酶标板孔底部,晃动混匀。置 37 ℃温箱中温育 30 min,加入洗涤液洗涤五次,拍干。除空白孔外每孔加入酶标试剂 50 μL,依照以上步骤再温育和洗涤一次。每孔先加入显色剂 A 50 μL,再加入显色剂 B 50 μL,轻轻震荡混匀,37 ℃避光显色15 min。每孔加终止液50 μL,用酶标仪在450 nm测定各孔OD值。
1.6 统计方式 采用SPSS 19.0统计学软件进行数据统计,并且以均数±标准差(± s )表示,组间比较均采用t检验,规定P<0.05为差异具有统计学意义。
2 结果
2.1 CCK-8法检测ATV对A549细胞增殖的抑制作用 CCK-8检测结果表明,ATV对A549细胞具有明显抑制作用,且该作用具有时效与剂效关系,而Ad-Mock对A549细胞无明显抑制作用。如图1所示,ATV在12、24、48、72 h对A549细胞均具有不同程度的抑制作用,且抑制率随时间的增长而增强;剂量分别为1 moi、10 moi、50 moi的ATV对A549细胞均具有不同程度的抑制作用,且抑制率随剂量的增加而增强,感染剂量为1 moi时,ATV对A549细胞的抑制作用随时间的增长无明显变化(P>0.05)且在各个时间点,ATV与Ad-Mock对A549细胞的抑制作用均无明显差异(P>0.05),感染剂量为10 moi和50 moi时,ATV对A549细胞抑制作用随时间的增长显著增强(P<0.05)且ATV与Ad-Mock对A549细胞的抑制作用在48与72 h存在显著性差异(P<0.05),由该结果可得出结论:50 moi为ATV的最佳感染剂量。
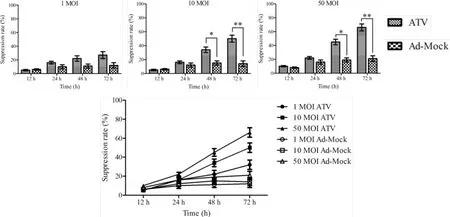
图1 CCK-8法检测ATV对A549细胞的抑制率
2.2 Hoechst法检测ATV对A549细胞的抑制方式 Hoechst能够与细胞DNA结合,经紫外光激发后发出蓝色荧光。在荧光显微镜下观察到感染50moi ATV与Ad-Mock后的A549细胞如图2所示,ATV感染后的A549细胞,48、72 h均有部分细胞呈核碎裂典型的浓染和边集现象,随着时间的增长,该现象更加明显;而Ad-Mock感染后的A549细胞呈现均一的蓝色荧光。由该结果可知,ATV能够引起A549细胞凋亡。
2.3 Annexin V-FITC/PI流式法检测ATV对A549细胞抑制途径 通过Annexin V-FITC/PI流式检测,如图3所示,表明ATV可诱导A549细胞凋亡,且凋亡率随时间的增长而增大,具有时间效应,而Ad-Mock对A549细胞凋亡无明显影响。在48与72 h,A549细胞的凋亡率分别为50.54%和75.30%,ATV与Ad-Mock对A549细胞的凋亡率存在显著性差异(P<0.05),该结果表明ATV可引起A549细胞凋亡。
2.4 胞浆活性氧水平检测结果 胞浆活性氧检测结果如图4所示,ATV感染A549细胞12、24、48、72 h,细胞活性氧水平随时间的增长而提高,具有时间效应,而Ad-Mock组和A549细胞对照组细胞活性氧水平随时间的增长无明显变化(P>0.05),在48 h与72 h,ATV感染的A549细胞中活性氧水平显著高于Ad-Mock组和A549细胞对照组(P<0.05),A549细胞凋亡率随A549细胞中活性氧含量的增加而提高,该结果表明ATV可通过调节A549细胞中活性氧水平引起A549细胞凋亡。
3 讨论

图2 Hoechst 染色检测ATV对A549细胞抑制方式(400×)

图3 Annexin V-FITC/PI流式检测ATV对A549细胞抑制途径

图4 A549细胞胞浆活性氧水平
活性氧(ROS)是细胞新陈代谢过程中产生的带有未成对电子的原子、原子团或分子,具有稳定性极低、易分解等特点。包括过氧化氢、超氧阴离子、一氧化氮自由基及羟基自由基等[11]。ROS主要储存在线粒体和还原性辅酶Ⅱ等氧化酶类中,其中线粒体是ROS产生最重要的场所。约有90%的ROS在线粒体氧化磷酸化产生ATP的过程,由分子氧经线粒体内膜呼吸链复合体Ⅰ及复合体Ⅲ传递产生。ROS作为信号分子能引起肿瘤细胞自噬、凋亡、耐药及增殖抑制。ROS介导的凋亡途径包括:通过增加线粒体膜通透性转运孔开放,使细胞色素C释放,激活半脱氨酸蛋白酶,活化caspases-9,并形成凋亡小体及多种蛋白复合物,进而活化下游 caspase-3,放大死亡信号,诱导细胞凋亡[12-14]。也可以通过泛素化使 caspase-8 蛋白的表达减少从而诱导凋亡。ROS也可以通过激活p53从而调节Wnt/β -catenin途径及介导 NF-κB从而引起凋亡。
在雷公藤红素作用肿瘤细胞的过程中,陈国柱等[15]、张志强等[16]研究发现雷公藤红素对非小细胞肺癌细胞株 H1299 的杀伤作用与细胞内 ROS 的蓄积和 NF-κB通路的活性抑制有关。另外一些研究表明雷公藤红素还可以通过 ROS/JNK 通路诱导人胶质母细胞瘤细胞[17]、骨肉瘤细胞[18]等的凋亡。此外,ROS 也与肿瘤耐药性有关,诱导 ROS 产生可以增加肿瘤细胞对药物的敏感性从而诱导肿瘤细胞的凋亡[19]。β-胡萝卜素作用于食管鳞癌细胞后,能够引起细胞内ROS含量增加,降低线粒体膜电位,触发细胞色素C 的释放,从而诱导凋亡蛋白 Bax 表达降低,蛋白Bcl-2、Casepase-3 表达增加,促使食管鳞癌细胞发生凋亡,证明β-胡萝卜素能够通过调节ROS水平促进食管鳞癌细胞凋亡从而对其起到抑制作用[19]。青蒿琥酯可以诱导人肝癌细胞产生活性氧,活性氧引起 Bcl-2 水平下调以及 Bax 水平上调,使线粒体通透性增加、膜电位丧失,释放细胞色素C,激发典型的线粒体凋亡通路,从而诱导肝癌细胞凋亡从而对其起到了抑制作用[20]。
本研究通过CCK-8明确了ATV能够显著性抑制A549细胞的增殖,通过Hoechst和Annexin V-FITC/PI流式确定了ATV能够导致A549细胞凋亡,表明了ATV主要通过诱导A549细胞凋亡的方式来抑制A549细胞的增殖。通过检测A549细胞内胞浆活性氧水平,明确了ATV诱导A549细胞的凋亡与胞内活性氧含量的关系,即A549细胞的凋亡率随细胞中活性氧含量增加而升高,验证了双特异性溶瘤腺病毒ATV可通过调节活性氧水平引起人肺癌细胞A549细胞凋亡。
