甲苯胺蓝自组装的N, P, S共掺杂多孔碳电催化氧化NADH∗
2019-01-25翟秀荣李永红李继森岳呈阳雷晓武
翟秀荣, 李永红, 李继森,岳呈阳, 雷晓武
(1.济宁学院化学与化工系,山东 曲阜273155;2. 宁夏医科大学公共卫生与管理学院,宁夏 银川750004)
NADH是目前已知300多种脱氢酶的辅酶[1],在氧化还原反应中可被氧化成NAD+,测定由脱氢酶催化反应产生的NADH是发展底物专一性脱氢酶生物传感器的基础。NADH在传统的裸电极如金、碳和铂电极上的氧化是不可逆的[2-3],需要较高氧化电位,易造成电极表面污染。因此,人们致力于研究新的电极材料和构建方法去降低NADH的氧化过电位和减少电极表面的污染。一些碳材料如碳纳米管[4]、有序介孔碳[5]和电子介体如酚噻嗪类染料[6]常用来降低NADH的氧化过电位,但是仍存在氧化能力不够和修饰电极不稳定等问题[7]。
碳材料如石墨烯[8]、碳纳米管[9]和多孔碳[10]等广泛用于电极材料。其中,多孔碳展现出优越于其他碳材料的独特性质如好的热和机械稳定性、较高的导电性、较大比表面积和可调的孔径等[11]。杂原子如N、B、P、S慘杂的多孔碳材料可以引入更多的缺陷点位,显示出更优异的电催化活性[12]。杂原子掺杂的多孔碳用于催化甲醇[13]、过氧化氢[14]和氧气[15]的研究已被报道。然而,N, P, S共掺杂的多孔碳 (N, P, S@PC)应用于电催化氧化NADH的研究还未见报道。
氧化还原介质甲苯胺蓝(TBO)通过简单的自组装方法修饰到N, P, S@PC表面,制备了一种新的电化学复合材料N, P, S@PC-TBO。N, P, S@PC既是TBO自组装的载体又是NADH的催化剂。实验结果表明,由于N, P, S@PC和TBO之间的协同效应,N, P, S@PC-TBO修饰的玻碳(GC)电极具有较好的电催化NADH的性能。
1 实验部分
1.1 仪器与试剂
CHI 660C电化学工作站(上海辰华仪器有限公司,中国)用于所有的电化学测定。电化学实验采用经典的三电极体系:修饰的GC电极(直径为3 mm)为工作电极,铂丝电极为对电极,Ag/AgCl/KCl(3 mol/L)为参比电极。扫描电镜图(SEM)由JSM-6700F扫描仪(日本)获得。X射线能量散射光谱(EDS)由由JEM-2100PLUS高分辨透射光谱仪(日本)获得。所有电化学实验均在室温下进行。
N, N′-二甲基甲酰胺(DMF)和NADH(还原型)均购自百灵威科技有限公司。TBO购自Sigma-Aldrich公司(美国)。浓度为1/15 mol/L pH为7.0的磷酸盐缓冲溶液为支持电解质。其它试剂均为分析纯。所有用水均为二次蒸馏水。
1.2 N, P, S@PC的合成
根据文献报道合成N, P, S@PC[16]。我们首先根据文献报道方法制备金属-有机框架化合物(MOF)[17]。然后,加入到含有三苯基磷(P源)、三氰二胺(N源)和二甲亚砜(S源)的甲醇溶液中,过滤后在900 ℃的N2氛围下焙烧。最后,所得样品分别用稀盐酸和二次蒸馏水洗涤。
1.3 修饰电极的制备
修饰前,裸GC电极分别用0.3 μm和0.05 μm的Al2O3粉末在麂皮上抛光,然后依次在乙醇和二次蒸馏水中超声清洗,并在N2下吹干。最后,裸GC电极在支持电解质中,以50 mV/s的扫描速率,在-0.5-1.2 V电位之间进行循环伏安扫描20圈。
将62 mg TBO溶于40 mL pH=4.0的Mcllvine缓冲溶液中可制取5 mmol/L的甲苯胺蓝溶液。10 mg N, P, S@PC超声2 h可均匀分散于10 mL DMF中,得1.0 mg/mL的N, P, S@PC悬浮液。取5 μL 1.0 mg/mL 的N, P, S@PC悬浮液滴于GC电极表面,红外灯下干燥。然后将N, P, S@PC/GC电极置于5 mmol/L的TBO溶液中浸泡2 h自组装TBO,得N, P, S@PC-TBO/GC电极。裸GC电极置于5 mmol/L的TBO溶液中浸泡2 h可得TBO/GC电极。所得的电极分别置放于支持电解质中,以50 mV/s的扫描速率,在-0.6-0.6 V范围内扫描至循环伏安图稳定。
2 结果与讨论
2.1 N, P, S@PC和复合物N, P, S@PC-TBO表征
图1(A)和(B)所示是N, P, S@PC和复合物N, P, S@PC-TBO的SEM。从图1(A)可看出,N, P, S@PC材料具有几百纳米的多孔结构。而孔道的存在有利于电解质的传输和电子的转移。然而,当TBO自组装到N, P, S@PC表面后,表面形貌发生了明显的变化(图1(B))。
为进一步探究所得N, P, S@PC材料的元素组成,我们采用EDS对其进行表征,如图1(C)所示。从EDS图上可清楚的看出,其所含有的元素分别为:C、N、P、S、O、Cu和Si,其中Cu和Si为制样时铜网基底元素。

图1 (A)N, P, S@PC的SEM;(B)N, P, S@PC-TBO的SEM;(C)N, P, S@PC的EDS Fig.1 (A) SEM of N, P, S@PC; (B) SEM of N, P, S@PC-TBO composite; (C) EDS of N, P, S@PC
2.2 N, P, S@PC-TBO/GC电极的电化学性质
图2所示为裸GC、TBO/GC、N, P, S@PC/GC和N, P, S@PC-TBO/GC电极在支持电解质中的循环伏安图。裸GC电极(曲线1)和N, P, S@PC/GC(曲线3)均未出现明显的氧化还原峰。TBO/GC电极(曲线2)呈现了一对TBO的氧化还原峰[18]。N, P, S@PC-TBO/GC电极(曲线4)呈现出很明显的TBO氧化还原峰,半波电位E1/2(由氧化峰电位和还原峰电位计算所得的中间电位)在-359 mV左右。N, P, S@PC-TBO/GC电极与其它三个电极相比较,展现出最高的背景电流。这可能是由以下两大因素引起的:① N, P, S@PC 具有较高的比表面积。② N, P, S@PC和TBO具有协同的导电性能。
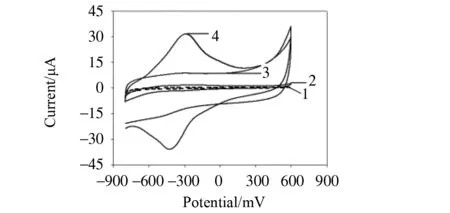
图2 裸 GC(曲线1),TBO/GC(曲线2),N, P, S@PC/GC(曲线3)和N, P, S@PC-TBO/GC(曲线4)电极在支持电解质中的循环伏安曲线,扫描速率:50 mV/sFig.2 Cyclic voltammograms for the bare GC (curve 1), TBO/GC (curve 2), N, P, S@PC/GC (curve 3) and N, S@PC-TBO/GC (curve 4) electrode at a scan rate of 50 mV/ s, in the supporting electrolyte
图3(A)所示为N, P, S@PC-TBO/GC电极在不同电位扫描速率下的循环伏安图。随着扫描速率的增大,阳极和阴极峰的峰电位分别向正和负的方向移动,因此两峰间的距离△Ep越来越大。扫描速率为30 mV/s时,△Ep为104 mV。扫描速率为210 mV/s时,△Ep为206 mV。这表明N, P, S@PC-TBO/GC电极的氧化与还原峰的峰电位与扫描速率有关。然而,半波电位E1/2的大小几乎与扫描速率无关。当扫描速率在30-210 mV/s的范围内时(图3(B)),氧化峰和还原峰的峰电流均与扫描速率呈现直线关系,这说明N, P, S@PC-TBO修饰电极的氧化还原过程是一个快速的表面控制过程。

图3 (A):N, P, S@PC-TBO/GC电极在支持电解质中,在不同扫描速率:30, 60, 90, 120, 150, 180 和 210 mV/ s下的循环伏安曲线。(B):阳极和阴极峰的峰电流与扫描速率的关系曲线Fig.3 (A):Cyclic voltammograms of the N, P, S@PC-TBO/GC electrode recorded at different scan rates: 30, 60, 90, 120, 150, 180 and 210 mV/ s from inner to outer. (B): cathodic and anodic peak currents versus scan rate in the supporting electrolyte
如图4所示为N, P, S@PC-TBO/GC电极连续扫描的循环伏安图,通过电流的降低考察电极的稳定性。在支持电解质中,以50 mV/s的扫描速率,电位从-0.80-0.60 V连续扫描60圈后,电流几乎没有降低。这说明N, P, S@PC-TBO/GC电极具有较好的稳定性,可能归因为:N, P, S@PC与TBO的之间存在氢键相互作用力。

图4 N, P, S@PC-TBO/GC电极在支持电解质中,以50 mV/ s的扫描速率,连续扫描60圈的循环伏安曲线Fig.4 Cyclic voltammograms recorded at the N, P, S@PC-TBO/GC electrode for 60 cycles in the supporting electrolyte, scan rate: 50 mV/ s
2.3 N, P, S@PC-TBO/GC电极电催化氧化NADH性能
通过循环伏安和安培技术表征N, P, S@PC-TBO/GC电极电催化氧化NADH的性能。图5比较了裸GC(A)、 TBO/GC(B)、N, P, S@PC/GC(C)和 N, P, S@PC-TBO/GC(D)电极于支持电解质中电催化氧化1.0 mmol/L NADH的循环伏安图。由图5(A-C)可见,在裸GC电极,TBO/GC电极和N, P, S@PC/GC电极上,NADH的氧化峰电位分别出现在+0.319,-0.050和-0.074 V。N, P, S@PC/GC电极和TBO/GC电极与裸GC电极相比,NADH的氧化峰电位发生了明显的降低,这表明N, P, S@PC和TBO都具有较好的电催化NADH的性能。而对于N, P, S@PC-TBO/GC电极(图5D),NADH氧化峰电位出现在-0.203 V,并且氧化峰电流有显著提高,这说明此修饰电极具有最好的电催化氧化NADH的性能。图6所示为,在-0.203 V的应用电位下,不同电极在支持电解质中连续加入0.2 mmol/L NADH的计时电流曲线。裸GC电极的电流响应非常小(曲线1),TBO/GC电极(曲线2)和N, P, S@PC/GC电极(曲线3)的电流响应分别为0.66和0.95 μA。特别是N, P, S@PC-TBO/GC电极能更快、更灵敏的电催化氧化NADH。加入0.2 mmol/L NADH后,N, P, S@PC-TBO/GC电极(曲线4)催化电流达到了2.42 μA。N, P, S@PC-TBO/GC电极电流的响应时间分别由TBO/GC电极的3 s和N, P, S@PC/GC电极的16 s降低到了2 s。
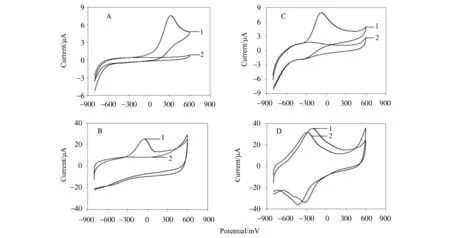
图5 裸GC(A)、TBO/GC(B)、N, P, S@PC/GC(C)和N, P, S@PC-TBO/GC(D)电极在支持电解质中的循环伏安图,扫描速率为:50 mV/s。曲线1和2分别对应加与不加1.0 mmol/L NADHFig.5 Cyclic voltammograms of the bare GC(A), TBO/GC (B), N, P, S@PC/GC (C) and N, P, S@PC-TBO/GC (D) electrode with (curve 1) and without (curve 2) 1.0 mmol/L NADH in the supporting electrolyte, respectively, in all cases

图6 应用电位为-0.203 V时,裸 GC(1)、TBO/GC(2)、N, P, S@PC/GC(3)和 N, P, S@PC-TBO/GC(4)电极连续加入0.2 mmol/L NADH的电流-时间曲线Fig.6 Amperometric current response of the bare GC(1), TBO/GC(2), N, P, S@PC/GC(3) and N, P, S@PC-TBO/GC (4) electrode upon successive addition of 0.2 mmol/L NADH, at the applied potential of-0.203 V
N, P, S@PC-TBO/GC电极电催化氧化NADH的氧化峰电位进一步降低、催化电流进一步提高,可能是以下因素引起的:① N, P, S@PC与TBO之间有相互作用,可以提高TBO的吸附量;② N, P, S@PC可以促进TBO与NADH之间的电子和离子转移;③ N, P, S@PC与TBO之间有协同电催化氧化NADH的作用。
图7(A)、(B)所示为N, P, S@PC-TBO/GC电极检测NADH的催化电流与浓度之间的关系,线性方程为:y= 0.007 6x+0.8,其中y代表电流(μA),x代表NADH浓度(μmol/L)。检测的线性范围为1×10-6-2×10-3mol/L(相关系数为0.997),检测限为3×10-7mol/L (信/噪 = 3),灵敏度为107.6 μA/( mmol·L-1·cm-2)。
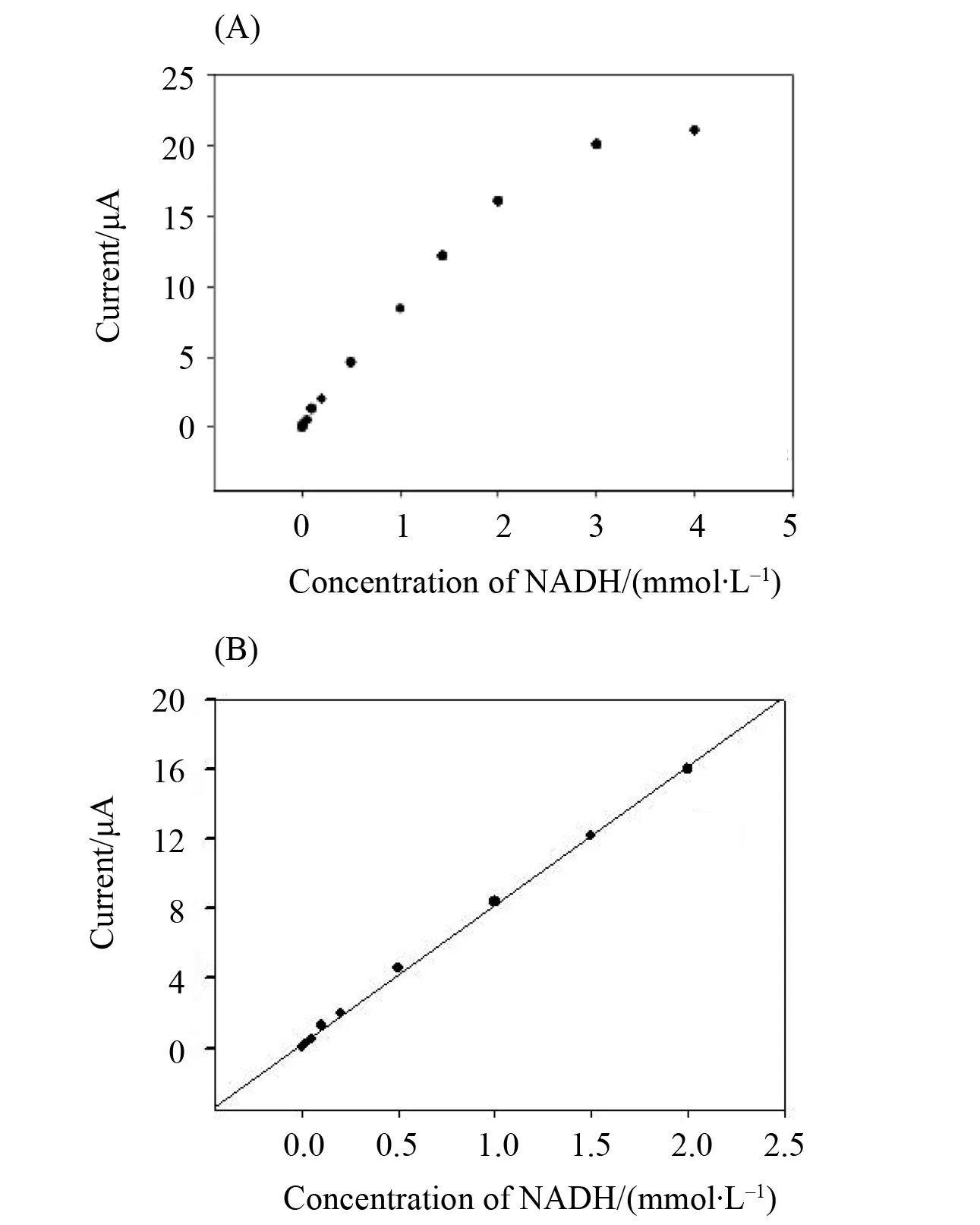
图7 应用电位为-0.203 V时,N, P, S@PC-TBO/GC电极测定NADH的标准曲线Fig.7 Calibration curve for NADH for the N, P, S@PC-TBO/GC electrode, at the applied potential of-0.203 V
通过长时间安培电流的改变来考察N, P, S@PC-TBO/GC电极电催化氧化NADH的稳定性能。图8所示为在应用电位为-0.203 V时,连续35 min电催化氧化NADH后电流降低了约12%。在-0.203 V应用电位下,共存的干扰物质如抗坏血酸和尿酸的响应相对于NADH的响应可忽略,这表明N, P, S@PC-TBO/GC电极具有较高的选择性。同一根N, P, S@PC-TBO/GC电极连续10次测量0.2 mmol/L NADH,其相对标准偏差为4.9%。用5根不同N, P, S@PC-TBO/GC电极对0.2 mmol/L NADH进行检测,其相对标准偏差为4.6%。以上结果表明,N, P, S@PC-TBO/GC电极在低电位检测NADH时具有良好的重现性。
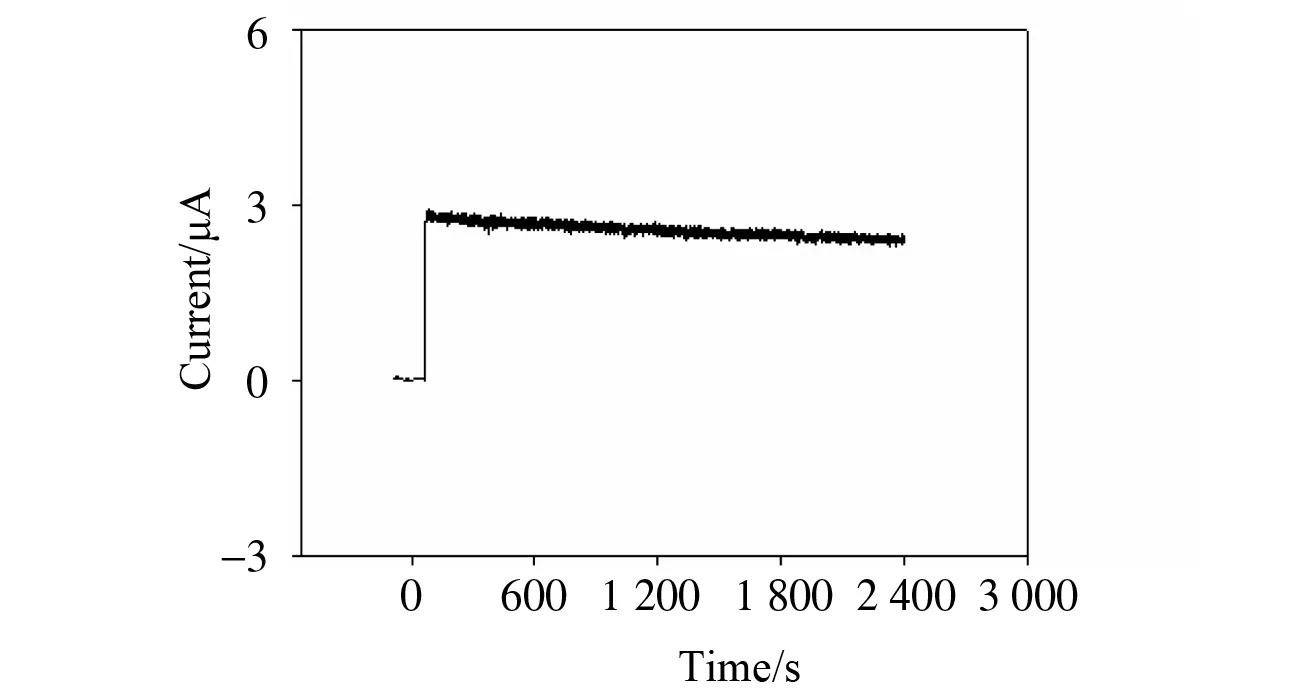
图8 应用电位为-0.203 V时,N, P, S@PC-TBO/GC电极在支持电解质中加入0.2 mmol/L NADH的电流-时间曲线Fig.8 Stability of the current response of 0.2 mmol/L NADH at the N, P, S@PC-TBO/GC electrode at the applied potential of-0.203 V in the supporting electrolyte
3 结 论
将TBO自组装到N, P, S@PC的表面制备了一种新的复合物N, P, S@PC-TBO。由于N, P, S@PC和TBO的之间协同效应,N, P, S@PC-TBO修饰的GC电极具有较好的电催化NADH的性能如:低的应用电位、快的响应时间、宽的线性范围、低的检测限和好的稳定性。因此,N, P, S@PC-TBO/GC电极在构建检测NADH的电化学生物传感器领域中有广泛的应用前景。
