三种植物生长物质对马铃薯低温抗冷性的影响
2019-01-24王国莉陈兆贵张银枚龚冠平3文佩玲
王国莉,陈兆贵,张银枚,2,龚冠平,3文佩玲
(1.惠州学院生命科学学院,广东惠州516007;2.华南师范大学生命科学学院,广东广州516031;3.暨南大学生命科学学院,广东广州516032)
植物对零度以上低温的耐受能力、适应和抵御能力称为植物的抗冷性[1].马铃薯(Solanum tuberosum L.)是全球第四大粮食作物[2],生长季节短,最适生长温度为13~21℃[3],低温冷害不仅抑制植株生长,还引起代谢紊乱,植株萎蔫甚至死亡,严重影响马铃薯的产量和品质[4].在我国南方,冬种马铃薯的播种期为10月至11月,次年2月至3月收获[3],这期间低温甚至霜冻会对马铃薯生产造成极大影响,如2010年广东惠东霜冻,马铃薯受灾面积0.34万hm2,直接经济损失高达2026万元[5].因此生产上选择适宜的抗寒诱导剂来提高马铃薯的低温抗性,具有重要意义.脱落酸(Abscisic aicd,ABA)作为一种逆境激素[6],是从众多抗寒诱导剂中筛选出的、作用效果最好的[7-9].研究证实外源ABA能提高油菜[10]、甜椒[11]、草莓[12]等植物的抗冷性,主要是通过提高植株的光合速率、降低质膜的过氧化作用、提高抗氧化酶活性等来实现的.在植物细胞生长和分化过程中,多胺有着极为重要的调节作用.在冷害条件下,多胺生成酶发挥作用,与细胞膜的磷脂部位相结合抵抗逆境,保护植物,防止细胞溶质外渗,从而提高植物抗冷性.用亚精胺(Spermidine,Spd)或精胺处理,可以提高冷胁迫下玉米种子[13]、辣椒幼苗[14]以及茄子种子和幼苗的抗冷性[15].油菜素内酯(Brassinolide,BR)是一种天然植物激素,被称为第六激素[16],广泛存在于植物的各个器官中[16].植物经过低浓度 10-5~10-6mg·L-1处理便能表现出明显的生理效应,能提高植物对低温的抗性[17].外源BR可以提高玉米幼苗的抗冷性[18],增加长鞭红景天耐低温的能力[19],诱导番茄幼苗的抗冷性[20],作用方式可能是通过避免植物幼苗生成过量的自由基,或者是通过诱导形成自由基清除剂来减轻膜脂过氧化作用的程度,以此来稳定膜的结构与功能,加强膜的抵御能力,从而使植物适应低温逆境的变化[21].本研究采用不同浓度的脱落酸、亚精胺和油菜素内酯处理马铃薯苗,通过模拟低温冷害条件,筛选诱导马铃薯抗冷性的最适浓度,以期在生产中推广应用并提高马铃薯的种植效益.
1 材料与方法
1.1 实验材料
试验所用马铃薯薯种购自惠州冬种马铃薯生产基地,品种为费乌瑞它,切块后在实验室外置于育苗盒中培育5周,至株高10~16 cm时,选取3组长势一致、健康生长的马铃薯苗进行处理.第1组63株,分成7组,每组9株,5个处理组分别喷施100 mL 的5、10、15、20、25 mg·L-1的ABA溶液,2个对照组喷施蒸馏水.第2组54株,分成6组,每组9株,4个处理组分别喷施100 mL 0.01、0.1、0.5和1 mmol·L-1的亚精胺溶液,2个对照组喷施蒸馏水.第3组54株,分成6组,每组9株,4个处理组分别喷施100 mL 0.001、0.01、0.1和1 mg·L-1的BR溶液,2个对照组喷施蒸馏水.
喷施时添加吐温80,叶片上下表面均匀喷洒,直至叶缘有水珠滴下,之后在常温下放置30 min,待叶片完全晾干后,将处理和低温对照(CK2)放置于提前设定好参数的人工气候培养箱,温度为10℃,光照强度2400 lx,相对湿度80%,每天光照12 h.常温对照(CK1)在温度20℃,光照强度2400 lx,相对湿度80%的人工气候培养箱培养,每天光照12 h.处理72 h后,从培养箱取出马铃薯植株,立即测定其生理生化指标.
1.2 马铃薯苗的冷害症状及冷害分级
低温处理开始后,每天定时观察和记录马铃薯植株的冷害状况,并对冷害症状进行分级.0级:马铃薯叶片正常,未受伤害;1级:仅少数马铃薯叶片边缘有轻度的皱缩萎蔫,部分叶片变软;2级:半数以下的叶片萎蔫,但主茎未死,复燃后仍能存活;3级:半数以上的叶片萎蔫死亡;4级:整株植株死亡[22]。

1.3 生理生化指标的测定
叶绿素含量的测定参照张志良[23]的方法;可溶性蛋白含量的测定采用考马斯亮蓝G250染色法[23];可溶性总糖含量的测定采用蒽酮比色法[23];相对电导率的测定参照陈爱葵[24]的方法;丙二醛含量的测定采用硫代巴比妥法[23];超氧化物歧化酶活性的测定采用氮蓝四唑法[23];过氧化物酶活性的测定采用愈创木酚法[23].每个处理重复测定三次,取平均值.
1.4 数据处理
实验数据采用SPSS19.0软件进行统计分析,采用邓肯新复极差法进行多重比较,小写英文字母表示差异显著水平.用Excel 2013作图.
2 结果分析
2.1 不同处理对低温胁迫下马铃薯苗形态指标的影响
由表1可知,未经ABA处理的马铃薯苗(CK2)低温下有植株发生萎蔫,少数叶片变软蜷缩,叶尖变成褐色,冷害等级为2级,冷害指数最高,达16.67%.10和15 mg·L-1ABA处理的植株生长良好,未表现出明显冷害症状,冷害等级为0级,冷害指数为0.经5、20和25 mg·L-1ABA处理的个别植株发生萎蔫,少数叶片变软并且蜷缩,冷害等级为1级,冷害指数分别是8.33%、5.56%和5.56%.
未经SPD处理的马铃薯苗(CK2)低温胁迫下有些植株发生萎蔫,冷害等级为2级,冷害指数达到22.22%.经0.01、0.1和1 mmol·L-1Spd处理的马铃薯苗仅个别植株的叶片萎蔫变软,冷害等级1级,冷害指数分别为11.11%、5.56% 和2.78%.0.5 mmol·L-1Spd处理的马铃薯苗叶片,生长状况良好,冷害等级0级,冷害指数为0.
未经BR处理的马铃薯苗(CK2)低温胁迫下有60%的植株叶片完全萎蔫,其余叶片也有轻微冻伤,冷害级别3级,冷害指数5.42%.但经不同浓度BR处理的马铃薯苗冷害症状减轻,0.01 mg·L-1BR处理的马铃薯苗生长状况良好,叶片饱满,叶面有光泽,植株健壮,冷害0级,冷害指数为0;经1 mg·L-1的BR处理的马铃薯苗整体生长状况良好,仅个别的叶片萎蔫和变软,冷害1级,冷害指数为1.25%;经过0.001 mg·L-1和0.1 mg·L-1的BR处理的马铃薯苗有50%的叶片萎蔫和轻微的冻伤,冷害2级,冷害指数为2.92%.
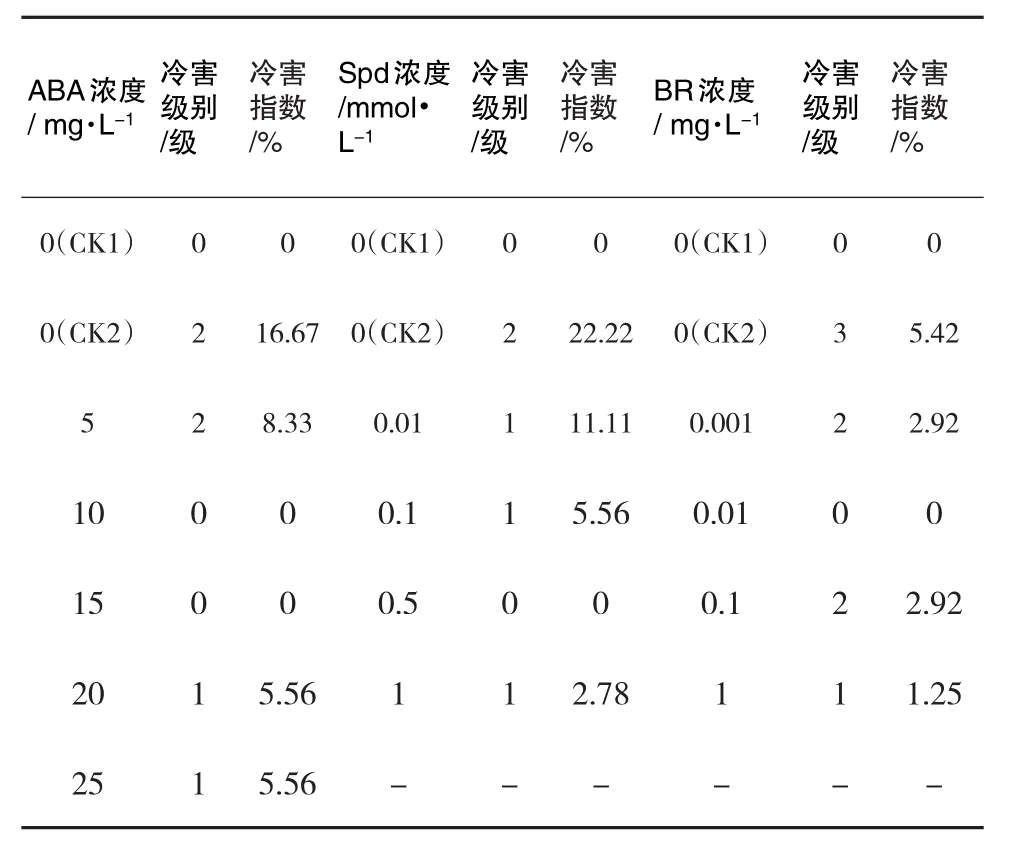
表1 马铃薯植株的冷害程度
2.2 不同处理对低温胁迫下马铃薯苗叶片叶绿素含量的影响
从图1可知,未经ABA处理的马铃薯苗(CK2)低温下叶绿素含量与CK1比较显著下降28.04%,经5、10、15、20、25 mg·L-1ABA处理的叶绿素含量低温下呈现先升高后降低的趋势,分别较低温对照显著增加27.64%、42.22%、32.10%、26.89%和19.86%,以10 mg·L-1处理的叶绿素含量最高,与其它处理比较差异显著.
未经SPD处理的马铃薯苗(CK2)低温胁迫下叶片的叶绿素含量与CK1比较显著下降36.46%,经Spd处理的马铃薯苗低温下较对照的叶绿素含量显著增加,0.5 mmol·L-1处理的叶绿素含量最高,较低温对照增加68.33%,0.01、0.1和1.0 mmol·L-1处理则分别增加12.75%、45.98%和42.03%.
未经BR处理的马铃薯苗(CK2)低温胁迫下叶片的叶绿素含量显著下降,0.01、0.1和1 mg·L-1BR处理的叶绿素含量与常温对照比没有显著差异,0.01 mg·L-1BR处理的叶绿素含量最高,较低温对照显著增加50.20%.0.001 mg·L-1处理的叶绿素含量显著高于低温对照,但叶绿素含量较其它3个处理显著降低.这说明采用BR处理可以有效减缓低温下马铃薯苗叶绿素的降解速度.
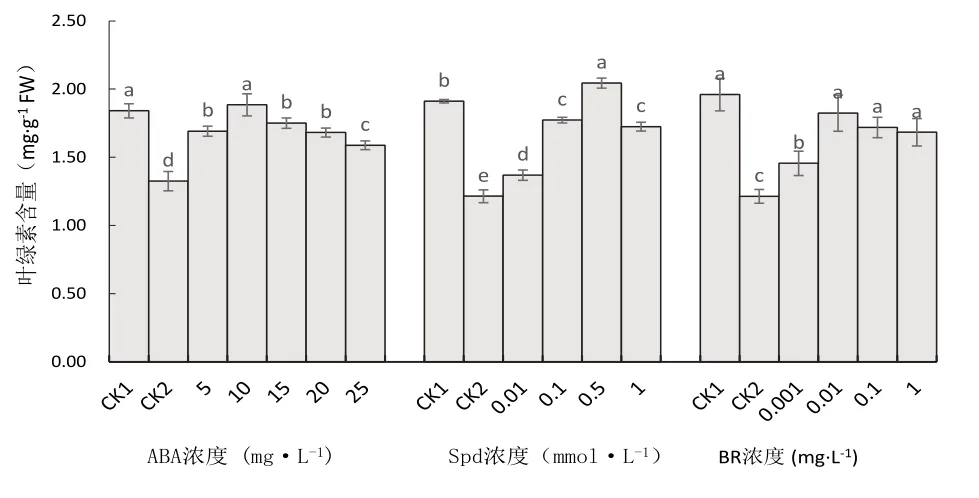
图1 不同处理对马铃薯苗叶片叶绿素含量的影响
2.3 不同处理对低温胁迫下马铃薯苗叶片可溶性蛋白含量的影响
从图2可以看出,低温胁迫下马铃薯的对照及经5、15、20、25 mg·L-1ABA处理的可溶性蛋白含量与常温对照比没有显著差异,10 mg·L-1ABA处理的可溶性蛋白含量较低温对照显著增加16.06%,其含量也显著高于常温对照和其它处理.
低温下未经Spd处理的马铃薯叶片可溶性蛋白含量较常温对照显著降低10.18%,Spd处理的可溶性蛋白含量较低温对照显著增加,0.5 mmol·L-1Spd处理的可溶性蛋白含量最高.经0.01、0.1和1.0 mmol·L-1处理的可溶性蛋白含量较低温对照分别增加9.54%、19.26%和21.44%.
未经BR处理的马铃薯苗(CK2)低温胁迫下的可溶性蛋白含量较常温对照和其它处理都显著下降,0.01 mg·L-1BR处理的可溶性蛋白含量显著高于低温和常温对照,比低温对照增加20.48%,0.001、0.1和1.0 mg·L-1BR处理的可溶性蛋白含量则分别比低温对照显著增加9.55%,12.99%和9.05%.
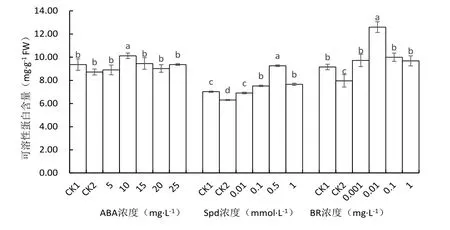
图2 不同处理对马铃薯苗叶片可溶性蛋白含量的影响
2.4 不同处理对低温胁迫下马铃薯苗叶片可溶性总糖含量的影响
从图3可知,低温下未经ABA处理的马铃薯叶片内可溶性总糖含量较常温对照显著下降28.49%,经5、10、15、20、25 mg·L-1ABA处理的可溶性总糖含量呈先升后降趋势,分别较低温对照显著增加26.38%、33.63%、32.58%、22.59%、15.13%.以10 mg·L-1ABA处理的可溶性总糖含量最高,与常温对照相比差异不显著.
低温胁迫时,未经Spd处理的马铃薯苗(CK2)叶片的可溶性总糖含量较常温对照显著降低28.89%,采用Spd处理可以显著增加叶片的可溶性总糖含量,以0.5 mmol·L-1Spd处理的可溶性总糖含量最高,较低温对照显著增加96.56%,并显著高于常温对照.经0.01、0.1和1.0 mmol·L-1Spd处理的可溶性总糖含量则分别增加35.97%、76.94%和53.18%.
低温下未经BR处理的马铃薯苗(CK2)叶片的可溶性总糖含量较常温生长的植株显著下降,但BR处理可显著增加可溶性总糖的含量,与低温对照比较,采用0.001、0.01、0.1和1.0 mg·L-1BR处理的可溶性总糖含量分别增加19.58%、44.9%、37.75%和35.48%,以0.01 mg·L-1BR处理的可溶性总糖含量最高,并显著高于常温对照.
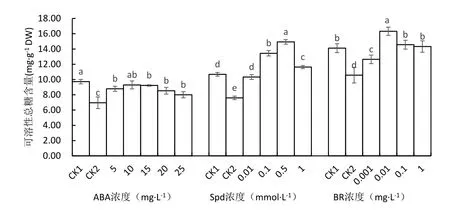
图3 不同处理对马铃薯苗叶片可溶性总糖含量的影响
2.5 不同处理对低温胁迫下马铃薯苗叶片相对电导率的影响
由图4可知,与常温对照相比,低温下未经ABA处理的马铃薯(CK2)叶片的相对电导率显著增加273.76%,采用5、10、15、20、25 mg·L-1ABA处理的相对电导率较低温对照显著下降52.44%、71.18%、70.54%、54.4%、30.92%,其中10 mg·L-1和15 mg·L-1ABA处理的相对电导率接近,显著低于其它处理,与常温对照比差异不显著.
低温胁迫下所有马铃薯叶片的相对电导率显著增加,未经Spd处理的马铃薯(CK2)叶片的相对电导率比常温对照显著增加85.72%,Spd处理的相对电导率较低温对照显著下降,以0.1和0.5 mmol·L-1处理的相对电导率最低,比低温对照下降37.15%和37.89%,0.01和1.0 mmol·L-1处理的相对电导率比低温对照低11.84%和26.67%.
低温下未经BR处理的马铃薯(CK2)叶片的相对电导率较常温对照显著增加,采用0.001、0.01、0.1和1.0 mg·L-1BR处理的相对电导率较低温和常温对照显著下降,分别较低温对照下降25.12%、78.26%、31.95%和20.00%,以0.01 mg·L-1BR处理的相对电导率最低.由此说明,低温胁迫时BR处理可以有效减轻马铃薯叶片细胞膜的损伤程度,减少细胞电解质向外渗漏,增加其抗冷性.
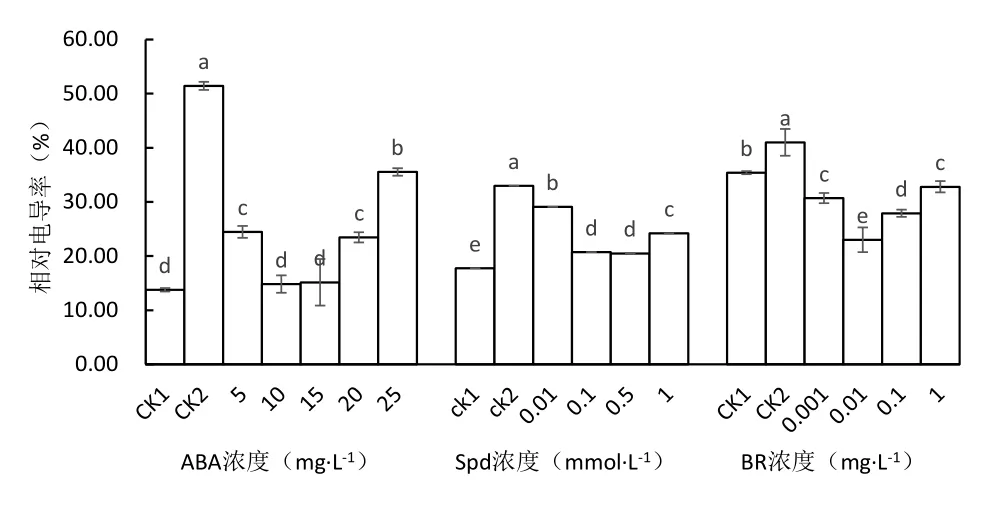
图4 不同处理对马铃薯苗叶片相对电导率的影响
2.6 不同处理对低温胁迫下马铃苗薯叶片丙二醛含量的影响
从图5可知,低温胁迫使马铃薯苗叶片的丙二醛含量与常温对照相比显著增加,未经ABA处理的低温对照的丙二醛含量增加64.25%.经过5、10、20 mg·L-1ABA处理的丙二醛含量分别较低温对照显著下降20.18%、30.32%、12.23%,以10 mg·L-1ABA处理的丙二醛含量下降最多,与其他处理相比差异显著.15和25 mg·L-1ABA处理的丙二醛含量与低温对照相比差异不显著.
低温胁迫下,低温对照、0.01、0.1和1.0 mg·L-1Spd处理的马铃薯苗叶片的丙二醛含量显著高于常温对照,低温对照的丙二醛含量最高,较常温对照显著增加23.96%.0.01、0.1和0.5 mmol·L-1Spd处理的丙二醛含量较低温对照显著下降,以0.5 mmol·L-1处理的丙二醛含量最低,比低温对照显著下降27.25%,0.01和0.1 mmol·L-1处理的丙二醛含量则分别降低7.07%和14.54%,1.0 mg·L-1Spd处理的丙二醛含量与低温对照比差异不显著.
在BR处理试验中,低温对照的马铃薯苗叶片中丙二醛含量较常温对照显著增加,但经BR处理的丙二醛的含量较低温对照显著下降.0.001、0.01、0.1和1.0 mg·L-1BR处理的丙二醛含量分别较低温对照下降13.53%、45.81%、19.40%和23.39%,以0.01 mg·L-1处理的植株叶片丙二醛含量最低,其它处理与常温对照比差异不显著.这说明在低温胁迫下BR处理的马铃薯苗可以有效减缓丙二醛的生成,保护细胞膜的完整性,减轻马铃薯苗低温伤害程度,增强其抗冷性.
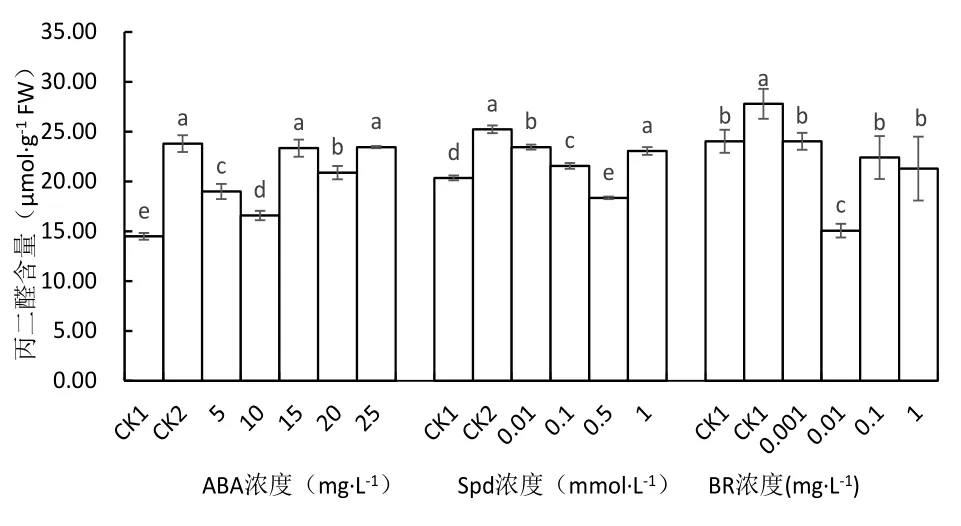
图5 不同处理对马铃薯苗叶片丙二醛含量的影响
2.7 不同处理对低温胁迫下马铃薯苗叶片SOD活性的影响
从图6可以看出,与常温对照相比,未经ABA处理的马铃薯苗(CK2)的SOD活性显著下降41.35%,经5、10、15、20、25 mg·L-1ABA处理的SOD活性较低温对照显著增加63.97%、92.46%、54.62%、59.77%、55.09%,10 mg·L-1ABA处理的SOD活性显著高于对照和其它处理.
低温胁迫下,未经Spd处理的马铃薯(CK2)叶片的SOD活性较常温对照显著降低28.99%,所有Spd处理的SOD活性都显著高于低温对照,0.5 mmol·L-1Spd处理的SOD活性最高,较低温对照显著增加57.14%,并高于常温对照;0.01、0.1和 1.0 mmol·L-1Spd处理的SOD活性较低温对照显著增加28.16%、39.93%和26.91%.
低温下未经BR处理的马铃薯(CK2)叶片的SOD活性比常温对照显著下降41.34%,BR处理能显著增加马铃薯叶片的SOD活性,0.01和1 mg·L-1BR处理的SOD活性显著高于对照和其它处理,0.01 mg·L-1BR处理的酶活性最高,较低温对照显著增加69.77%,0.001、0.1和1.0 mg·L-1BR处理的酶活性则分别增加45.67%、37.08%和37.67%.

图6 不同处理对马铃薯苗叶片SOD活性的影响
2.8 不同处理对低温胁迫下马铃薯苗叶片POD活性的影响
从图7可以看出,低温胁迫下,未经ABA处理的马铃薯(CK2)的POD活性较常温对照显著下降50.48%,经5、10、20 mg·L-1ABA处理的POD活性显著增加,高于低温对照98.08%、99.04%、28.17%,且5 mg·L-1和10 mg·L-1ABA处理的POD活性与常温对照比差异不显著,10 mg·L-1ABA处理的POD活性最高.
低温下未经Spd处理的马铃薯(CK2)的POD活性较常温对照显著下降28.07%,经Spd处理的所有马铃薯的POD活性显著增加,以0.5 mmol·L-1处理的POD活性最高,比低温对照增加96.49%,0.01、0.1和1.0 mmol·L-1Spd处理的POD活性分别增加31.58%、87.72% 和40.35%,0.1、0.5和1.0 mmol·L-1Spd处理的POD活性亦显著高于常温对照.
与常温对照相比,低温下未经BR处理的马铃薯叶片的POD活性显著下降107.95%.BR处理能显著增加低温胁迫下马铃薯叶片的POD活性,0.01 mg·L-1BR处理的POD活性最高,较低温对照显著增加97.95%,0.001、0.1和1.0 mg·L-1BR处理的酶活性分别增加68.24%,84.62% 和85.57%.0.01、0.1和1.0 mg·L-1BR处理的酶活性与常温对照比差异不显著.
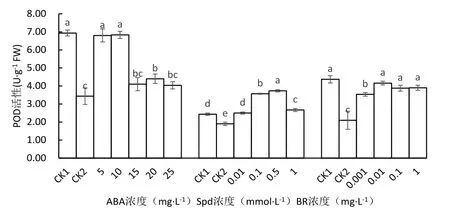
图7 不同处理对马铃薯苗叶片POD活性的影响
3 讨论与结论
低温是影响马铃薯生长和产量的重要环境因素[25].广东是我国南方冬种马铃薯的主要产区,惠州地区种植范围非常广泛.现如今惠州已经建成两个冬种马铃薯的国家级万亩高产示范区[26],种植面积已达1万hm2[27].但鉴于惠州整个冬季气温比较低,历年冬季平均温度均在14.5℃左右[28],因此研究马铃薯的低温抗冷性并选择适宜抗寒诱导剂极具现实意义.
低温下植物体内生理生化指标的变化可以较好地反映植物的耐冷性情况.叶绿素是植物进行光合作用、促进有机物合成,为植物生长发育提供能量的重要保障[10,29].低温下植物体内亲水性的可溶性蛋白含量增加,可以降低细胞水势阻止细胞过度失水,还可参与植物基因的表达,促进抗冻性蛋白的合成[30].可溶性总糖在低温逆境下可通过降低植物细胞的水势和稳定细胞膜大分子的结构,来降低低温对植物细胞的伤害[31].因此在低温胁迫时,植物体内叶绿素、可溶性蛋白和可溶性总糖的含量越高,植物的低温耐性越强.相对电导率和丙二醛的含量都能够反映植物细胞膜的受损伤程度[32].低温下植物相对电导率增加是因为细胞膜的选择透过能力下降,导致细胞内含物外渗引起的[33];丙二醛是植物发生脂膜过氧化作用的产物,含量越高说明细胞膜受到的伤害越严重[34].SOD和POD都能够催化植物体内活性氧(·O2-、·OH-、H2O2)转化生成H2O和O2,减少氧自由基的伤害,增强植物的低温耐性[16,35].同等条件下,SOD和POD活性越高,植物的抗冷性越强.
我们发现,与常温对照相比,低温胁迫下马铃薯叶片的叶绿素含量、可溶性蛋白含量、可溶性总糖含量均显著下降,相对电导率和丙二醛的含量显著升高,SOD和POD活性显著下降,说明低温对马铃薯造成的伤害比较严重,表现为叶片变软、蜷缩,叶尖变成褐色,受冷害严重的植株直接萎蔫等[37].
ABA作为一种逆境激素,在植物遭遇寒冷、干旱等逆境条件时体内ABA含量都会增高.王慧等[7]已经从众多抗寒诱导剂中筛选出脱落酸为作用效果最好的抗寒诱导剂[8-9].研究证实脱落酸能够缓解叶绿素的降解,提高油菜的光合速率[10];通过提高甜椒叶片的可溶性蛋白、可溶性糖等渗透调节物质的含量,增强甜椒幼苗的抗冷性[11];能够显著降低草莓的丙二醛含量和电导率[12],减轻膜脂的过氧化作用;亦可通过提高香蕉幼苗冷胁迫期间超氧化物歧化酶(SOD)、过氧化物酶(POD)的活性,缓解低温对香蕉幼苗的伤害程度[22].
在植物细胞生长和分化过程中,多胺有着极为重要的调节作用.在冷害逆境条件下,多胺生成酶发挥作用,与细胞膜的磷脂部位相结合抵抗逆境,保护植物,防止细胞溶质外渗,从而提高植物抗冷性.曹玉杰[36]用尸胺处理降低了黄瓜幼苗电解质渗透率和丙二醛含量,提高了可溶性蛋白、可溶性糖和脯氨酸含量,SOD、POD和过氧化氢酶(CAT)活性显著上升,提高了黄瓜幼苗的抗冷性.郑昀晔等[13]发现亚精胺和精胺可在冷胁迫情况下提高玉米种子CAT、SOD、POD活性,提高发芽率,缩短发芽时间.张帆[14]等发现亚精胺能提高辣椒幼苗叶绿素、脯氨酸含量,降低丙二醛含量,增强辣椒幼苗的抗冷性,降低死亡率.张彦萍[15]等发现用0.25 mmol·L-1的亚精胺和精胺处理‘丰研2号’茄子种子,可显著提高种子在低温胁迫条件下的活力,提高茄子幼苗的抗氧化酶活性和脯氨酸含量,显著降低幼苗细胞质膜透性和丙二醛含量.
BR是一种天然植物激素,被称为第六激素,广泛存在于植物的各个器官中[16].虽然在植物体内BR含量极低,但其生理活性却非常高,植物经过低浓度10-5-10-6mg·L-1处理便能表现出明显的生理效应,能提高植物对低温的抗性[17].BR对植物的作用方式可能是通过避免植物幼苗生成过量的自由基,或者是通过诱导形成自由基清除剂来减轻膜脂过氧化作用的程度,以此来稳定膜的结构与功能,加强膜的抵御能力,从而使植物适应低温逆境的变化[21].闫慧萍[18]等发现BR处理能提高可溶性糖和可溶性蛋白含量,从而提高玉米幼苗的抗冷性;马令法[19]等发现BR处理能提高POD活性和SOD活性,从而增强栽培长鞭红景天耐低温胁迫的能力;袁凌云[20]等研究发现BR处理能有效的减缓丙二醛积累和降低相对电导率,从而能提高番茄幼苗的抗冷性.
但经ABA、Spd、BR处理后,与低温对照比较,马铃薯叶片的叶绿素含量、可溶性蛋白含量、可溶性总糖含量增加,相对电导率和丙二醛的含量下降,SOD和POD活性亦升高.尤其是采用10 mg·L-1和15mg·L-1ABA处理、0.5 mmol·L-1Spd处理以及0.01 mg·L-1BR处理的冷害指数均为0,各生理和生化指标均显著优于对照和其它处理,这为生产上使用适宜浓度抗寒诱导剂来提高马铃薯的低温耐性提供了理论支持.
由于脱落酸溶液见光易分解,建议在霜冻前一天早晨或者傍晚光线较弱的时候施用.而亚精胺属于低毒性芳香胺类化合物,可引起轻微皮肤刺激和过敏反应,使用时须穿戴必要的防护用具并站上风位置.
