饥饿—复投喂对虎龙斑FAS及CPT-1A表达的影响
2019-01-24马细兰黄文俞刘炎丰
马细兰,黄文俞,刘炎丰
(惠州学院 生命科学学院,广东 惠州 516007)
虎龙斑是广东省大亚湾水产实验中心通过不同石斑鱼杂交产生的新品种,父本为鞍带石斑鱼(Epinephelus lanceolatus),母本为棕点石斑鱼(Epinephelus fuscoguttatus).虎龙斑肉质好、生长速度快,养殖前景相当广阔,具有非常大的市场潜力和经济效益[1].石斑鱼为肉食性暖水性鱼,饲养成本高.考虑到渔业生产过程中,受季节、饵料、投喂不均等的影响,在养殖过程中会受到饥饿胁迫的影响,很多渔民在饲养过程中都会考虑产出与成本的问题,有时会采取间断投喂的方式.
脂肪酸合成酶(Fatty Acid Synthase,FAS)是内源性脂肪酸合成过程的关键酶,它将丙二酸单酰辅酶A、还原型辅酶Ⅱ、乙酰辅酶A在体内催化合成16碳的饱和软脂酸盐.在脂肪酸合成酶里面,底物和中间产物在不同的功能结构域中(可在同1酶分子,也可在不同酶分子)传递,最终完成整个脂肪酸的合成[2].高等动物中脂肪酸合成酶是由一条多肽链构成的多功能酶,一般以二聚体形式存在,且每个亚基都含有一ACP结构域.FAS是体内脂肪代谢过程中重要的功能蛋白酶,从体内FAS的含量可以了解鱼类脂肪代谢的情况,迄今,不少学者对鱼类FAS基因进行了研究,柳敏海等[3]对鮸鱼进行短期饥饿处理,发现体内脂肪酸合成酶的含量随着饥饿时间的延长而呈现下降趋势;乔秋实等[4]研究了建鲤周期性饥饿再投喂对其生长、体组成、消化酶的影响;苏尚顺[5]对斑马鱼的研究发现,饥饿使FAS的含量显著降低,且随着饥饿时间的增加,含量下降幅度变缓.目前在国内尚未有关于饥饿-再投喂对虎龙斑肝脏FAS表达影响的报道.
肉毒碱棕榈酰基转移酶(carnitine palmitoyltransferase,CPT)包括CPT-1和CPT-2 两种.其中CPT-1位于线粒体外膜的内表面,催化线粒体外膜上所形成的酰基辅酶A向肉毒碱转移,形成脂酰肉碱,进而通过内膜,并在位于线粒体内膜内表面的CPT-2催化下转运脂酰基到线粒体基质从而进行β氧化.由此可见CPT-1是脂酰辅酶A穿过线粒体膜而进入线粒体基质的关键酶,是脂肪酸β氧化过程的限速酶,它对脂肪的分解起着重要的调节作用.CPT-1在不同的动物中有不同的类型,在哺乳动物中有肝型(L-CPT或CPT-1A)、肌肉型(M-CPT或CPT-1B)以及脑型(CPT-1C)三种类型,不同的CPT-1A构型具有组织表达和物种特异性.CPT-1A在肝脏、肾脏、心脏和小肠中均有表达,其中肝脏的CPT-1A氧化速率最高、活性最强;CPT-1B在心肌、骨骼肌、睾丸以及一些脂肪酸氧化能力较高的组织中有表达;而CPT-1C则在中枢神经系统中表达[6].在水产动物中,仅见虹鳟、金头鲷以及黄颡鱼CPT1基因的研究报道,结果表明它们均有两种亚型:CPT-1A和CPT-1B[6].CPT-1A比CPT-1B具有对肉毒碱更高的亲和力,同时对CPT抑制剂——丙二酰辅酶A有更低的敏感性.因此,CPT-1A在更高的程度上调节机体内脂肪酸氧化的过程,是影响脂肪沉积的重要因素之一,对机体正常的生命活动有重要作用[7].国内对哺乳动物的CPT-1A基因研究开展得较多,在鱼类中研究较少.郑家浪等克隆了虾虎鱼和黄颖鱼的CPT-1A基因并对其表达和动力学性质进行了相关研究[8],蒋左玉等研究了VC对普安银鲫胚胎发育中CPT-1A活性的研究[9],不少学者对鱼类的脂肪酸代谢及饥饿胁迫对鱼类代谢的影响进行了相关的研究[3,10].迄今为止,国内尚未见虎龙斑CPT-1A基因表达的相关研究报道.
本实验拟通过对虎龙斑进行不同时间段的饥饿以及不同时间段的复投喂处理,利用酶联免疫法(ELISA),比较分析不同处理对肝脏FAS、CPT-1A含量的影响;应用相对实时荧光定量PCR(Real-time quantitative PCR)方法比较检测虎龙斑肝脏组织中FAS、CPT-1A基因表达情况,以探讨不同饥饿处理及复投喂处理对虎龙斑脂肪代谢的影响,为进一步深入研究饥饿胁迫下虎龙斑脂肪代谢的分子机理提供基础.
1 材料和方法
1.1 材料
1.1.1 实验鱼与实验设计
虎龙斑取自广东省海洋渔业实验中心,挑选个体大小相近的同一批虎龙斑,鱼龄为6个月,暂养两个月后开始进行实验.实验分为12个组,分别为起始对照组0d(C0),连续投喂10d,20d,30d,40d的对照组(C10,C20,C30,C40);分别饥饿10d,20d,30d,40d的饥饿组(S10,S20,S30,S40);饥饿10d后复投喂10d,饥饿20d后复投喂10d,饥饿30d后复投喂10d的复投喂组(R20,R30,R40).按照实验分组的投喂条件进行饲养,养殖水温在20~27℃,氨氮0.04~0.05mg/L,溶氧5.66~7.87mg/L,养殖鱼池为圆柱形鱼池,半径约为0.5m,水深约为1m.每次杀鱼取样前先测量体重、体长,采集实验鱼肝组织,一部分置于干净的离心管(用于酶测定),另一部分置于装有1mL RNA冻存液的离心管中,用冰盒带回惠州学院立即放4℃冰箱,可以保存约1年(用于分子实验).
1.1.2 实验试剂
总RNA提取试剂Trigol Reagent试剂盒购于北京鼎国昌盛生物技术有限责任公司;PrimeScript™II Reverse Transcriptase试剂盒、Premix Taq™(Ex Taq™ Version 2.0 plus dye)试剂和SYBR®Premix Ex Taq™ II(Tli RNaseH Plus)试剂盒、DNA MarkerDL2000均购于Ta-KaRa宝生物工程(大连)有限公司;鱼CPT-1A ELISA试剂盒购于上海研谨生物科技有限公司.
1.1.3 仪器设备
普通PCR基因扩增仪为苏州东胜兴业公司产品;Gel Doc 2000凝胶成像系统为BIORAD(U.S.A)公司产品;GL-20B高速冷冻温离心机为德国Eppend公司产品;7500荧光定量PCR仪为美国应用生物系统中国分公司的产品;Thermo Scientific Multiskan GO全波长酶标仪,借用惠州市出入境检验检疫局.
1.2 实验方法
1.2.1 ELISA检测、FAS、CPT-1A酶含量
本实验所用试剂盒是应用双抗体夹心法测定样本中鱼脂肪酸合成酶FAS和肉毒碱棕榈酰基转移酶1A(CPT-1A)水平.具体方法参试剂盒说明书,简述如下:
(1)样品准备:将冷冻保存肝脏样品置于真空冷冻干燥机中冷冻干燥后称取三份平行样,每份重量为0.1g,装入1mL离心管中,每管加入900μL的PBS(PH=7.4,浓度稀释10倍),之后用小型匀浆机将样品充分匀浆(冰上操作),匀浆后3000r 4℃离心20min,低温离心后小心将上清液移入新的离心管,重复低温离心操作,重新收集上清液,4℃保存.
(2)操作步骤:在酶标包被板上第一行设置标准品孔10孔,将标准品逐一稀释浓度分别为12ng/ml(1、2孔),8ng/ml(3、4孔),4ng/ml(5、6孔),2ng/ml(7、8孔),1ng/ml(9、10孔).将第二行设为空白孔(空白对照孔不加样品及酶标试剂,其余操作步骤一致),将第三、四、五行设为实验组.在待测样品孔中加入样品稀释液40μL,再加待测样品10μL(此时样品稀释5倍),轻轻晃动混匀后封膜,置于37℃温育30min;温育后小心揭掉封板膜,弃去液体,每孔加满稀释30倍的洗涤液,静止30s,弃去,重复洗涤五次;之后每孔加酶标试剂50μL,封膜,37℃温育30min.温育后小心揭掉封板膜,弃去液体,每孔加满稀释30倍的洗涤液,静止30s,弃去,重复洗涤五次;然后每孔依次加显色剂A和显色剂B各50μL,震荡,37℃避光显色15min;最后每孔加入50μL终止液.以空白对照孔调零,450nm波长依照顺序测量每孔的吸光度(OD值),收集数据,以作实验结果分析.
1.2.2 相对实时荧光定量PCR
用Real-time PCR检测不同饥饿处理对CPT-1A mRNA表达的影响,荧光实时定量PCR分析所用引物为:

实验结果采用2-△△CT相对定量方法分析,比较经处理的样品和未经处理的样品的FAS、CPT-1A mRNA表达差异.
2 结果
2.1 饥饿-复投喂对肝脏FAS、CPT-1A酶含量的影响
2.1.1 ELISA标准曲线
将ELISA试剂盒中标准品配置成不同浓度后,测量OD值,以OD值为横轴,浓度为纵轴,制作回归曲线,从图1可以看出,各点在曲线上,R²=0.997或0.999,故标准品回归方程可用.
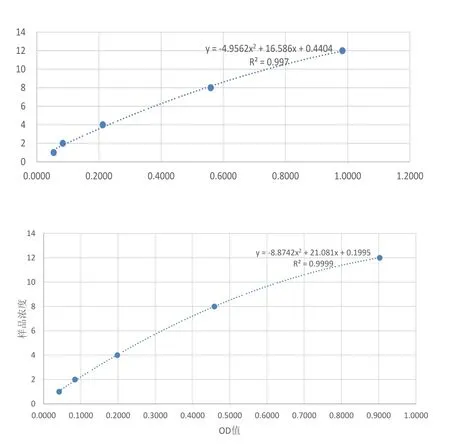
图1 ELISA标准品回归曲线 (上:FAS;下:CPT-1A)
2.1.2 肝脏中FAS、CPT-1A的含量
将所得样品OD值减去空白孔的OD值,带入标准品回归方程计算出相应样品的浓度,再将计算所得的值乘于50,即得肝脏中FAS、CPT-1A含量,如表1所示.
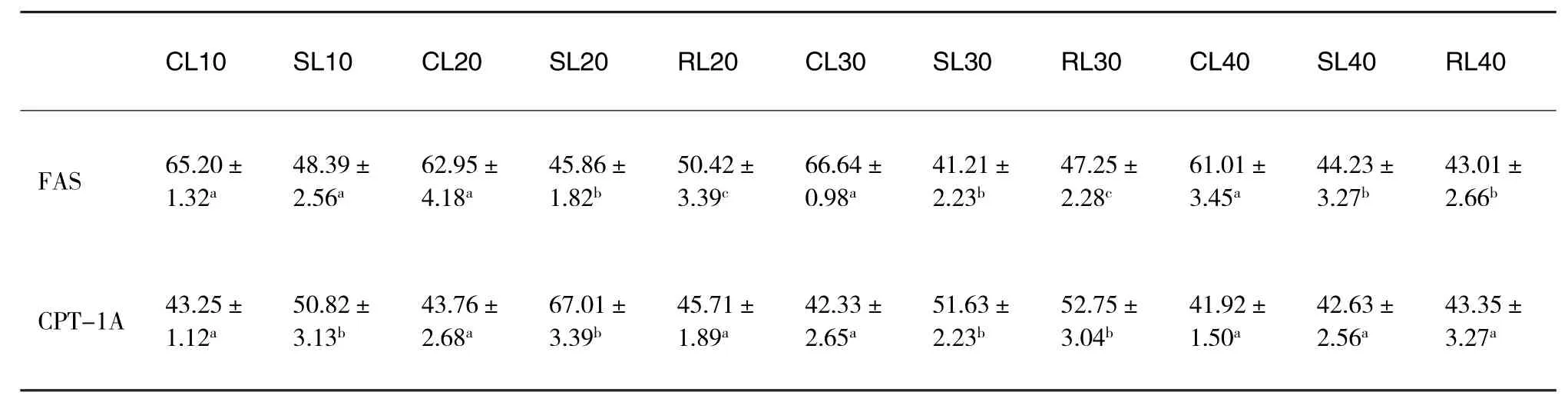
表1 饥饿-再投喂对虎龙斑肝脏FAS和CPT-1A含量的影响ng/g(n=3)
由表1可以看出,连续投喂的各对照组肝脏之间FAS含量无显著变化(P>0.05),含量在61.01~66.64 ng/g之间.与对照组相比,饥饿组FAS含量显著下降(P<0.05),饥饿30d后含量降到最低;复投喂后肝脏FAS含量则显著上升(P<0.05),但饥饿40d后复投喂10d,FAS的含量没有回升,SL40与RL40间FAS含量无显著差异(P>0.05).CPT-1A的变化与FAS相反,即饥饿10-30d后CPT-1A含量显著上升(P<0.05),饥饿20d后含量达到最高,SL20比CL20升高了约53%,随之有所下降,但SL30显著高于CL30(P<0.05);复投喂后肝脏CPT-1A含量则显著降低(P<0.05),至第 40d时CL40,SL40,RL40各组间CPT-1A含量无显著差异(P>0.05).
2.2 饥饿-复投喂对肝脏FAS、CPT-1A mRNA表达的影响
2.2.1 总RNA电泳检测
用0.8%琼脂糖凝胶电泳检测总RNA的质量,由图2可以观察到从上到下28S、18S、5S rRNA三条明显清晰的条带,无明显拖带,说明总RNA质量较好,可用作模板进行逆转录.
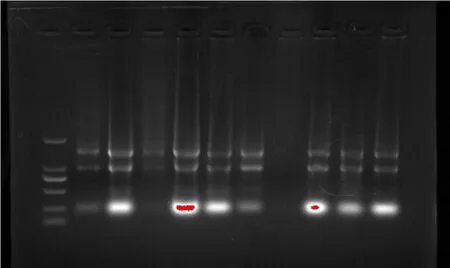
图2 虎龙斑肝脏总RNA
2.2.2 cDNA质量电泳检测
以检测质量良好的总RNA为模板,使用Prime-Script™ II Reverse Transcriptase(TaKaRa)反转录试剂盒进行逆转录,再用内参基因β-actin进行普通PCR扩增,用1.5%琼脂糖凝胶电泳检测,从图3可以看出,各cDNA均可扩出单一、明亮的β-actin基因条带,说明cDNA质量良好,可用于下一步实时定量PCR.
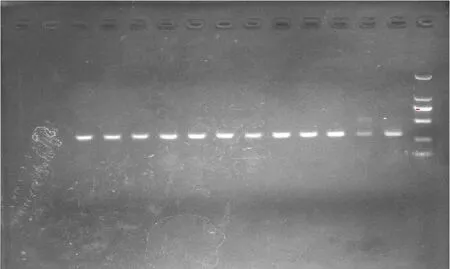
图3 虎龙斑肝cDNA质量电泳检测
2.2.3 相对定量结果分析
用7000 System SDS Software软件处理分析相对定量PCR结果,荧光阈值设为0.05095290,基线软件自动计算,将C0天的β-actin设为1,设置置信度为95%,将一些偏离平均值的数据剔除后,软件自动计算后即可得到CPT-1A基因的相对表达量.

图4 第10天肝脏FAS、CPT-1A表达水平
由图4可以看出,与对照组相比,饥饿10d后,肝脏FSA的表达水平显著下降,相反CPT-1A基因表达量显著上升(P<0.05).
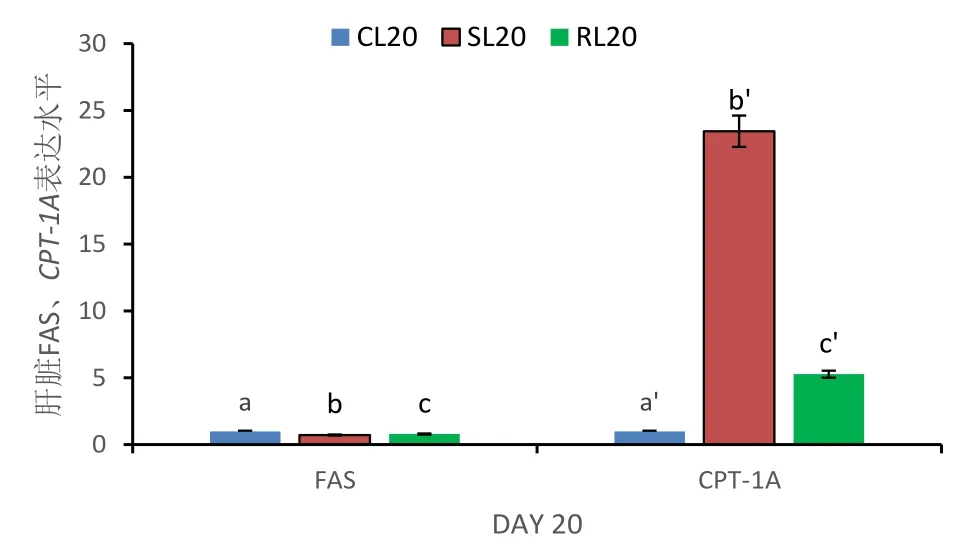
图5 第20天肝脏FAS、CPT-1A表达水平
从图5可以看出,饥饿20d后,FAS基因表达水平明显降低,CPT-1A基因的表达量极显著升高,达到最高值(P<0.05);复投喂后,相对于同期饥饿组,FAS基因表达水平明显降低升高,但低于同期对照组水平(P<0.05);相反,复投喂后CPT-1A基因的表达量显著下降,但仍高于对照组水平(P<0.05).

图6 第30天肝脏FAS、CPT-1A表达水平
由图6可知,饥饿30d后,FAS基因表达水平明显降低,CPT-1A基因的表达量显著升高(P<0.05);复投喂10d后,肝脏FAS基因和CPT-1A基因的表达量与饥饿组相比均无显著变化(P>0.05),但与对照组相比,FAS基因表达水平下降,CPT-1A基因的表达量升高(P<0.05).

图7 第40天肝脏FAS、CPT-1A表达水平
从图7可以看出,饥饿40d,FAS基因表达量显著下降,但CPT-1A表达量对照组无显著差异;复投喂组与饥饿组FAS、CPT-1A的表达量相比,均无显著差异(P>0.05).
3 讨论
鱼类遭受饥饿胁迫时,体内的代谢会发生适应性的变化,通过调节体内各种基因的表达,以控制体内的各种酶含量,来应付环境胁迫使得体内各种生命活动得以维持.
3.1 饥饿-复投喂对虎龙斑FAS的影响
虎龙斑在饥饿条件下,肝脏中FAS基因表达量和FAS的含量都会下降.饥饿使虎龙斑不能从外界获得食物,无法得到能量,体内脂肪酸合成酶FAS的反应底物减少,从而使FAS基因表达量下降(P<0.05),FAS含量随之下降(P<0.05).饥饿后复投喂,虎龙斑又可从外界重新获得能量,部分用于维持机体正常生命活动,多余的部分则需要储存,因此,体内FAS基因表达量开始增加(P<0.05),体内FAS含量相对于同期饥饿组也有所上升,但由于前期饥饿了10d,体内FAS的含量相对下降较多,因此并未上升到同期对照组的水平.饥饿30d的肝脏中,不管FAS基因的表达量和FAS的含量,在饥饿20d的基础上进一步下降,这与朱大世[8]对草鱼进行饥饿28d后得到的结论相似.饥饿40d(SL40)后虎龙班肝脏FAS的表达量和FAS的含量与SL30相比,几乎没有变化,推测饥饿30d后,虎龙斑的机体内能量几乎耗尽,再继续饥饿10d,对FAS的表达几乎没有影响;RL40的FAS基因表达量和FAS的含量相对于SL40几乎没有什么变化,可能是因为饥饿30d后,鱼机体损伤过大,即使复投喂10d,短时间内也没办法恢复机体功能.这与鲁雪报[11]等对中华鲟幼鱼的饥饿再投喂研究结果类似.
3.2 饥饿-复投喂对虎龙斑CPT-1A的影响
饥饿-复投喂对虎龙斑CPT-1A的影响与FAS刚好相反.连续投喂的对照组,其CPT-1A基因表达量和CPT-1A的含量在小范围内波动但变化不显著(P>0.05),刚好满足鱼体内正常的代谢活动所需,不需要额外分解脂肪酸来提供能量.在饥饿10d时,由于虎龙斑没有从外界获得代谢活动所需能量,随着体内糖原的消耗殆尽,机体开始启动肝组织脂肪的消耗,此时CPT-1A基因的表达量开始上升(P<0.05),使得CPT-1A的含量也随着上升(P<0.05),CPT-1A将长链脂肪酸转移到线粒体内进行氧化以供应能量.饥饿20d时,由于缺乏外源物质,体外无法供能,需要分解体内物质来供能,此时鱼体内CPT-1A基因继续大量表达(P<0.05),CPT-1A大量合,含量达到最高值,用以分解更多的脂肪酸来提供能量.虎龙斑在饥饿10d后复投喂10d(RL20),一方面虎龙斑可从外界重新获得食物,由此获得能量来维持体内代谢平衡,另一方面饥饿10d后CPT-1A基因大量表达已生成较多的CPT-1A,可供在复投喂前期继续使用,因此CPT-1A基因的表达量开始下降(P<0.05),CPT-1A的含量也明显下降(P<0.05).饥饿30d时,不管是CPT-1A基因表达量还是CPT-1A的含量,在饥饿20d的基础上进一步下降,但是依旧高于对照组(P<0.05),可能是因为随着饥饿天数增多,肝组织中的脂肪含量越来越少,底物缺乏使得CPT-1A基因表达水平随之降低,而饥饿20d后进行投喂10d,RL30的CPT-1A基因表达量与CPT-1A的含量与SL30相接近,仍明显高于对照组,说明饥饿时间太长,复投喂不能使基因表达量恢复到正常水平.到了实验第40d后,对照组、饥饿组以及复投喂组之间的CPT-1A基因表达量与CPT-1A的含量无显著差异,可能是因为饥饿时间太长,虎龙斑肝脏内的脂肪几乎消耗殆尽,使得饥饿组CPT-1A的表达量下降到与对照组水平接近,且鱼体可能受损,复投喂时间不够,表达没有办法完全恢复,导致SL40和RL40的表达量和含量接近.因此,虎龙斑肝脏CPT-1A基因在饥饿时表达上升,复投喂后下降.
综上所述,FAS(脂肪酸合成酶)基因和CPT-1A(肉毒碱棕榈酰基转移酶1A)基因均参与了虎龙斑饥饿及复投喂时的代谢活动.FAS在动物体质沉积中发挥重要作用,当动物从食物中摄取的能量超过机体的需要时,FAS基因的表达量增加,并翻译合成脂肪酸合成酶FAS,把正常代谢剩余的能量在脂肪组织和肝脏中转化成脂肪;相反过来,当动物从食物中摄取的能量少于机体的需要时,FAS基因表达量减少.当虎龙斑处于饥饿状态,缺乏外来能源时,机体启动肝脏CPT-1A基因表达,合成CPT-1A,来以分解肝脏脂肪,产生能量,维持正常的代谢活动.
