启动子探针载体的构建及橡胶树白粉菌启动子筛选鉴定
2019-01-23徐良向刘耀廖小淼王义Rajaofera何其光刘文波林春花缪卫国
徐良向 刘耀 廖小淼 王义 M.J.N. Rajaofera 何其光 刘文波林春花 缪卫国
(海南大学热带农林学院 热带农林生物灾害绿色防控教育部重点实验室,海口 570228)
橡胶是我国的重要战略资源,也是我国亚热带地区的重要经济产业。橡胶树白粉病是由橡胶树白粉菌(Oidium heveae)侵染引起的世界橡胶树重要病害之一[1]。该病具有蔓延速度快、危害严重、防治难度大等特点,病重时对橡胶树的生长和胶产量均有显著的影响,造成较大的经济损失[2-3]。
启动子是通过调节转录因子的结合进而募集RNA聚合酶来控制基因表达,是影响基因能否转录的重要功能单位之一[4]。因此,mRNA翻译成蛋白质与启动子活性直接相关。真核生物的DNA中只有约5%的序列片段是基因,而从DNA中找到基因是从DNA来认识生命的关键,基因前面一般会出现一段叫启动子的调控序列,用来帮助基因进行表达,如果能从DNA中定位出启动子,就能找到基因,同时可以帮助确定转录起始位点的位置,因此启动子的识别是基因研究中的重要一环[5]。此外,大多数基因工程菌都在使用花椰菜花叶病毒35S(Cauliflower mosaic virus35S,CaMV35S)启动子作为调控目的基因表达的启动子,随着研究的深入,研究者已经发现该型启动子在更广范围的应用上越来越凸显出它的不足,如陶彦彬等[6]通过将JcUEP启动子与CaMV35S启动子的活性比较,发现其具有比CaMV35S启动子更强的活性,可作为CaMV35S启动子的替代品。因而,筛选寻找到具有广泛应用价值的启动子、丰富启动子资源仍然是一项很有意义的工作。
橡胶树白粉菌是一种活体寄生病原真菌。由于其具有无法离体培养及未发现有性世代,导致关于橡胶树白粉菌分子生物学方面的研究仍处于技术摸索阶段[7]。本项目组已经完成了橡胶树白粉菌基因组的研究,发现其基因组数据的复杂且独特性为启动子的筛选研究提供了资源保障。橡胶树白粉菌的基因功能研究尚未建立成熟的研究体系,通过研究启动子的结构和功能,与报告基因融合检测进而分析目标基因的表达模式不失为一种很好的基因研究模式。贾娇等[8]通过对灰葡萄孢钙调磷酸酶基因启动子的克隆研究,明确了该基因与灰葡萄病菌的致病性的关系,并对葡萄灰霉病的防治提供了具有实用性的方法。故而从启动子着手探索橡胶树白粉菌重要致病因子,研究病原菌致病性生理生化机制,结合现代生物技术,进行橡胶树抗病性鉴定和抗病育种方面研究是橡胶树白粉病防治的一种新思路。目前对启动子的识别仅依靠生物信息学研究远远不够,所得到的假阳性启动子较多,还需实验来加以验证其启动活性。基于对橡胶树白粉菌基因的搜寻和功能的探索,启动子的筛选研究工作变得尤为重要。
本研究构建适用于橡胶树白粉菌启动子活性筛选和检测的探针载体pUC19-K,利用该载体比较HO-73中LY1、LY2、LY3、LY4四个预测的启动子活性,筛选得到高水平转录报告基因的启动子LY2、LY3,旨为橡胶树白粉菌启动子的发现、优化改造和利用奠定基础。
1 材料与方法
1.1 材料
橡胶树白粉菌菌株HO-73由本实验室筛选并保存;大肠杆菌DH5α感受态细胞购自北京全式金生物技术有限公司;质粒pBI121由本实验室保存;质粒pUC19、限制性内切酶、T4DNA连接酶为TaKaRa公司产品;普通DNA产物回收试剂盒、琼脂糖凝胶DNA回收试剂盒、普通质粒小提试剂盒购自Omega Bio-Tek公司;卡那霉素、氨苄青霉素购自上海生物工程有限公司。
LB培养基:1%(W/V)Tryptone,0.5% Yeast Extract,1%NaCl,调节 pH 7.0,121℃灭菌 20 min。(固体培养基添加1.6%琼脂粉)
1.2 方法
PCR超保真扩增目的基因片段、电泳、胶回收、酶切、连接、转化等操作按文献[9]方法进行。
1.2.1 启动子探针载体pUC19-K的构建及功能验证 以质粒pBI121为模板,用Primer Premier5.0设计引物KanF/R、35SF/R(表1)分别扩增卡那霉素抗性基因Kan的编码区序列和CaMV35S启动子序列。PCR扩增条件:95℃预变性5 min;95℃ 50 s,56℃40 s,72℃ 50 s共35个循环;72℃ 5 min。将扩增得到的大小一致的目的片段用琼脂糖凝胶DNA回收试剂盒纯化回收。用BamHI和HindIII双酶切纯化产物Kan和质粒pUC19,再用DNA产物纯化试剂盒分别回收双酶切的目的片段和质粒片段,在T4DNA连接酶的作用下16℃进行连接,构建pUC19-K质粒,转化克隆菌株大肠杆菌DH5α,通过菌液PCR和酶切验证筛选阳性克隆并进行测序。
测序正确后,用BamHI和EcoRI双酶切纯化产物CaMV35S和质粒pUC19-K,再用普通DNA产物纯化试剂盒分别回收目的片段和双酶切的质粒片段,并用T4DNA连接酶连接,构建了pUC19-35S-K载体,转化克隆菌株大肠杆菌DH5α,通过菌液PCR和酶切验证筛选阳性克隆并进行测序。

表1 Primer Premier5.0设计的引物序列
1.2.2 利用启动子探针载体对橡胶树白粉菌HO-73启动子的筛选 设计引物LY1F/R、LY2F/R、LY3F/R、LY4F/R(表1)从橡胶树白粉菌基因组DNA中扩增4种不同的启动子。PCR扩增条件:95℃预变性 5 min;95℃ 40 s,59℃ 40 s,72℃ 40 s共35个循环;72℃ 5 min。将扩增得到的片段大小一致的产物用琼脂糖凝胶DNA回收试剂盒纯化回收。用BamHI和EcoRI双酶切纯化产物和质粒pUC19-K,再用普通DNA产物纯化试剂盒分别回收目的片段和双酶切的质粒片段,并用T4DNA连接酶连接,分别构建了pUC19-LY1-K、pUC19-LY2-K、pUC19-LY3-K、pUC19-LY4-K等4个质粒,转化大肠杆菌DH5α,用菌液PCR及酶切验证筛选阳性克隆并进行测序。
1.2.3 含不同启动子重组载体菌株的卡那霉素耐受性实验 将保存于-80℃冰箱中的含有pUC19-K、pUC19-35S-K、pUC19-LY1-K、pUC19-LY2-K、pUC19-LY3-K、pUC19-LY4-K重组质粒的DH5α甘油菌取出置于冰盒中,待甘油菌融化后吸取100 μL菌液,在LB(含卡那霉素和氨苄青霉素)液体培养基中于37℃恒温培养箱中振荡复苏培养12 h,再蘸取少量复苏培养菌液,在LB(含卡那霉素和氨苄青霉素)平板上采用三段划线法进行划线。后置于37℃恒温培养箱中倒置培养12 h。挑取平板上长出的单菌落,接种于5 mL的LB(含卡那霉素)液体培养基中,将试管倾斜放置于37℃恒温摇床中,150 r/min振荡培养8 h。取200 μL已摇好的种子液,加入到96孔酶标板中,用酶标仪测定OD600吸光值。根据测得的OD600值计算各个不同重组子的接种量(表2)。

表2 种子液OD600值及接种量的计算
设置7个卡那霉素梯度浓度分别为0、100、200、400、600、800、1 000 μg/mL。根据上一步计算出的接种量进行接种,将接好的试管放入到37℃恒温摇床中以150 r/min的转速振荡培养。为了消除试管在培养过程中由于试管倾斜角度等的不同而造成的系统误差,在振荡培养时,把所有试管插入到试管架中,试管架水平放置,以尽量使结果具有可比性。在培养至12 h时取样,测定样品在600 nm处的吸光值。本次实验重复3次。
2 结果
2.1 启动子探针载体的构建
启动子探针载体的构建流程如图1。以pBI121载体为模板,KanF/R为引物,扩增得到Kan(798 bp)片段(图2)。扩增片段经BamHI/HindIII双酶切,克隆入质粒pUC19相应的酶切位点,得到pUC19-K重组质粒。质粒构建完成后进行双酶切验证,结果与预期一致(图3)。
2.2 探针载体功能检测
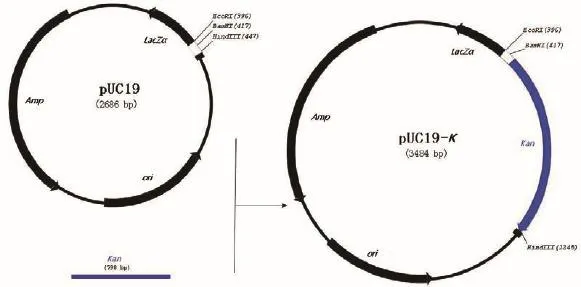
图1 启动子探针载体构建过程
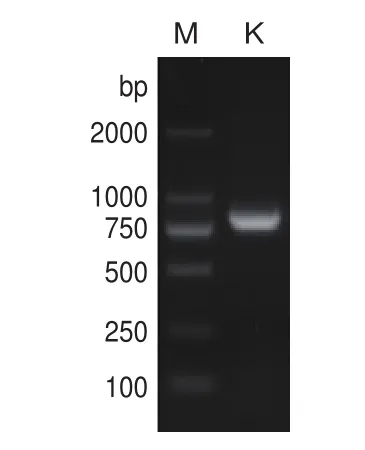
图2 卡那霉素抗性基因PCR扩增图谱
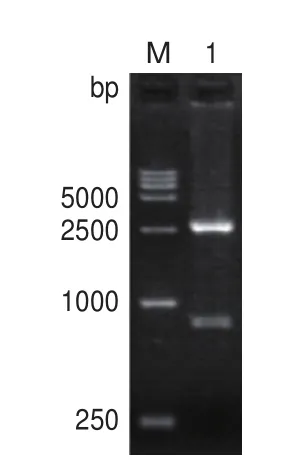
图3 pUC19-K的双酶切验证图谱
以pBI121载体为模板,根据CaMV35S启动子的序列设计引物,扩增出CaMV35S片段,连入到启动子探针载体pUC19-K中,测序验证得到正确的转化子。观察在含卡那霉素和氨苄青霉素的LB板上两菌株的生长状况,可发现pUC19-35S-K菌株可以在含有卡那霉素的平板上生长,而pUC19-K菌株则不生长(图4)。
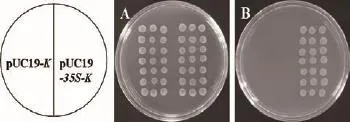
图4 探针载体pUC19-K功能检测图
2.3 橡胶树白粉菌启动子的筛选和活性鉴定
以HO-73基因组为模板,根据Promoter Scan预测的4个启动子序列设计引物,分别扩增出4个启动子片段(图5)。连入到启动子探针载体pUC19-K中,获得正确的转化菌株。在只含氨苄青霉素的LB平 板 上 pUC19、pUC19-K、pUC19-35S-K、pUC19-LYx-K都可以生长,在含氨苄青霉素和卡那霉素的LB平板上只有pUC19-35S-K、pUC19-LYx-K能生长。检测筛选得到正确的转化子pUC19-LY1-K、pUC19-LY2-K、pUC19-LY3-K、pUC19-LY4-K(图 6)。

图5 五种启动子的PCR扩增图谱

图6 启动子活性初步验证
以pUC19-K为对照对挑选的正确转化子pUC19-LY1-K、pUC19-LY2-K、pUC19-LY3-K、pUC19-LY4-K、pUC19-35S-K等5株菌的启动子活性进行了比较,从卡那霉素耐受性结果(表3),可以看出含LY3、LY4启动子片段转化子在卡那霉素浓度为1 000 μg/mL培养下OD600值仍然高,相对于含CaMV35S启动子片段的菌株,三者对卡那霉素的耐受性存在显著差异,菌液浓度相比高达50倍左右,故从对卡那霉素耐受性实验结果表明供试启动子的起始转录活性由强到弱依次为LY2≈LY3>LY1>LY4>CaMV35S(图 7)。
3 讨论
启动子是基因表达调控的重要元件,深入研究启动子的结构和功能,通过与报告基因融合来检测目标基因的表达模式是近年来功能基因组学研究广泛采用的一种方法[10-11]。目前对启动子的研究主要有两种方式,计算机软件预测和实验筛选。常用的预测启动子的软件有PromoterScan[12]和Promoter2.0[13-14]。目前,常通过对实验材料的基因组酶切,将片段整合到报告基因前,构建启动子探针载体,通过报告基因是否表达来筛选启动子片段。常用的报告基因有LacZ基因[15]、卡那霉素抗性基因[16]、GUS基因[17]、GFP基因[18]等。计算机软件预测虽然是一种简单快捷的方法,但预测的启动子假阳性较多[19],因而预测的启动子活性强度和功能研究必须要有实验证据。本研究通过软件预测与实验筛选相结合实现了对启动子的更精准定位
橡胶树白粉菌是一类专性活体寄生真菌[20],本项目组已经完成了橡胶树白粉菌基因组的研究,发现该病菌的基因组数据复杂且独特,初步分析并筛选获得了90余个启动子,可为分离活性较强的启动子提供可靠的研究材料。同时,橡胶树白粉菌致病基因功能研究尚未建立成熟的研究体系,通过研究启动子的结构和功能,与报告基因融合检测进而分析目标基因的表达模式不失为一种很好的致病基因研究模式。此外,近年来大量诱导型、特异性启动子被克隆和功能分析,并已广泛应用于基因工程中,然而在应用过程中也暴露出一些问题,例如CaMV35S启动子在黑暗条件下具有弱启动活性[21-22],筛选的特异性启动子调控表达水平不高[23],不能满足人们的多种应用需求等急需解决的问题。因而从橡胶树白粉菌HO-73中筛选强启动子是一项很有意义的工作。

表3 37℃ 120 r/min培养12 h后不同Kanamycin浓度培养菌液OD600值
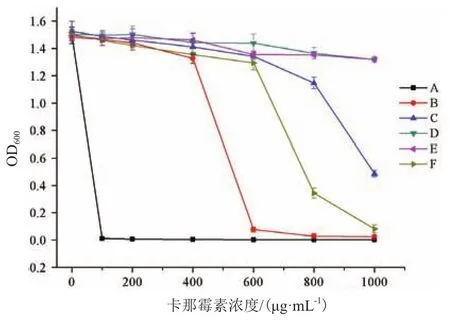
图7 37℃120 rpm培养12 h后不同卡那霉素浓度培养菌液OD600值折线图
本研究通过筛选克隆橡胶树白粉菌启动子区域,对其表达特征进行初步探究,并与CaMV35S启动子强弱进行比较分析。构建的启动子活性检测载体pUC19-K含Amp、ori、MCS、Kan等 元 件,Kan可编码一种氨基糖苷磷酸转移酶[24],这种酶在细胞中合成且可分泌到外周质腔,使卡那霉素磷酸化,从而干扰了它们向细胞内的主动转移,进而保护宿主不受这些抗生素的影响[25]。Kan是启动子检测的报告基因,能够定性定量地表明其上游启动子活性的强弱,其方向与质粒本身的启动子相反,这样可以避免质粒本身对启动子带来的影响。通过检测4种启动子的卡那霉素耐受性,我们发现LY2、LY3的活性相对较强,因此推断在受到卡那霉素胁迫下,LY2、LY3调控卡那霉素抗性基因大量编码可分泌到外周质腔的氨基糖苷磷酸转移酶,以保护宿主不受卡那霉素的影响。由此可见,该启动子探针载体可以分析出所预测启动子的活性和强度,具备了启动子探针载体的主要功能。利用此启动子探针载体,可以有效地在大肠杆菌DH5α中进行Oidium heveaeHO-73强启动子筛选和启动子活性测定。
通过分析各启动子的活性区别,我们推断可能是各启动子序列结构存在着区别以及启动子区域上顺式作用元件距离转录起始位点的远近导致的差异。同时,启动子区的重要顺式作用元件拷贝数可能参与了调控下游基因表达的强度及模式,但是关于其影响下游基因表达的分子机制还不清楚,在今后的研究中仍需进一步实验验证。
4 结论
本研究构建的启动子活性检测载体能灵敏地快速反映启动子活性的差异。此启动子探针载体能够作为橡胶树白粉菌HO-73中筛选强启动子和启动子活性检测的有效工具。所验证正确的启动子可以作为增加内源基因转录和表达及进行启动子改造的候选启动子。由于此启动子探针载体也能在大肠杆菌等其他革兰氏阴性细菌中进行复制,因此也可用于其他细菌或真菌强启动子的筛选和启动子活性检测。
