棉花GhDMT3的功能验证及生物信息学分析
2019-01-23杨笑敏王俊娟王德龙陆许可陈修贵郭丽雪王帅陈超王晓歌韩明格叶武威
杨笑敏 王俊娟 王德龙 陆许可 陈修贵 郭丽雪 王帅 陈超王晓歌 韩明格 叶武威
(中国农业科学院棉花研究所 棉花生物学国家重点实验室 农业部棉花遗传改良重点开放实验室,安阳 455000)
S-腺苷甲硫氨酸(S-adenosyl methionine,SAM)在DNA甲基转移酶的催化下把甲基(-CH3)转移到DNA分子中特定碱基上的过程称为DNA甲基化的过程[1]。多数发生在CpG岛的胞嘧啶第5位碳原子(C5)上,通常发生在对称序列CG中,但是在CHG和CHH(H=A、C或T)序列中也有发生[2]。DNA甲基化是一种广泛存在的表观遗传过程,包括转座子的抑制、基因组印记[3]、X染色体失活[4]、细胞分化[5]和胚胎发育[6]。在胁迫条件下植物通过DNA甲基化过程,诱导一些与抗逆相关的基因表达,增强植物的抗逆性,维持植物的生长发育和进化过程[7]。DNA甲基化是一种植物响应逆境胁迫的分子机制[8]。植物中存在2种DNA甲基化方式:一种是维持甲基化(Maintenance methylation),通过半保留复制把双链DNA分子的一条链存在甲基化,另一条链没被甲基化的亲代甲基化模式传递给子代[9];另一种是从头甲基化(De novomethylation),通过不同的DNA甲基转移酶催化将不存在甲基化的DNA双链形成甲基化[10]。植物中的C5-DNA甲基转移酶有4种,维持DNA甲基转移酶(Methyltransferase,MET)家族[11];染色质甲基化酶(Chromomethylase,CMT)家族[12];Dnmt2;结构域重排甲基转移酶(Domains rearranged methyltransferase,DRM)家族可以在RNA指导下,催化胞嘧啶从头甲基化,以及维持非CpG位点的甲基化[13];MET、CMT与动物的DNMT1 为同源[14];DRM 与动物的 DNMT3 同源[15]。
非生物胁迫严重影响和制约着农作物的产量和品质。当烟草发生渗透胁迫时(NicotianaL.)组织培养细胞的异染色质区会发生DNA超甲基化[16]。CHROMOMETHYLASE3(SLCMT3)基因可以使Chr番茄果实的成熟,提高控制成熟关键基因的表达[17];当萝卜(Raphanus sativusL.)受到重金属铬胁迫时DNA的甲基化水平会升高[18];玉米(Zea maysL.)受到冷胁迫时,根系通过降低核小体中心DNA甲基化水平诱导ZmMI1表达,受到盐胁迫时玉米幼苗zmPP2C甲基化将下调和zmGST表达量也下调[19];大豆受干旱、冷、盐胁迫时,根中CaDRM1和CaDRM2的表达量上调,以应对胁迫压力[20];苜蓿种子发育和结瘤的早期阶段MtDRM1和MtDRM2高度表达,MtDRM3在种子和结节发育阶段表达量高[20]。DNA甲基转移酶与抗逆性密切相关,深入对DNA甲基转移酶的作用机制进行研究,对进一步挖掘抗逆基因具有重要意义。
棉花作为重要的经济作物,其棉纤维可以制作成织物,棉籽可以榨油,在人们的日常生活中应用广泛。胁迫条件下,棉花产量会大幅度减产;DNA甲基转移酶可以增强植物的耐受性,GhDMT3是DRM家族的一员,在水稻中鉴定出2个DRM家族相关基因、苜蓿中鉴定出4个DRM家族的成员、在大豆中发现5个DRM家族相关基因、在玉米和拟南芥中各含有2个DRM家族的成员,而棉花中的DNA甲基转移酶研究较少。本研究通过对棉花GhDMT3进行生物信息学分析,并构建pYL156:GhDMT3沉默载体,对其进行功能验证,为提高棉花抗逆性奠定基础。
1 材料与方法
1.1 材料
陆地棉TM-1由中国农业科学院棉花研究所品种资源研究室保存。所用菌种为大肠杆菌E.coliDH5α,农杆菌 LB3101、pYL156、pYL192(辅助载体)和pYL156:GhDMT3(阳性对照载体)载体由中国农业科学院棉花研究所基因组测序课题组提供。
1.2 方法
1.2.1 RNA的提取及cDNA的制备 按照北京艾德莱生物科技的RN38 EASYspin Plus植物RNA快速提取试剂盒说明书提取RNA,按照北京全式金的TransScript ΙΙ All-in -One First-Strand cDNA Synthesis SuperMix for qPCR(One-Step gDNA Removal) 说明书制备cDNA。
1.2.2GhDMT3的克隆 用Primer Premier 5软件设计GhDMT3引物(F:ATGGTTGACAATAATTCGGGTGG;R:TCAGATAATCATTGATTTTGTG),以cDNA为模板进行扩增,PCR程序为94℃ 5 min;94℃20 s,54℃ 20 s,72℃ 70s,34 个循环;72℃ 10 min,4℃保存。PCR产物用1%的琼脂糖凝胶电泳进行检测,回收、纯化,与T载连接,并转入E.coliDH5α感受态细胞,筛选阳性单克隆并测序,获得正确的t-GhDMT3序列。
1.2.3 构建pYL156:GhDMT3的VIGS载体 用EcoRⅠ和XmaⅠ双酶切PYL156,获得线性pYL156载体,以克隆载体t-GhDMT3为模板用引物in-VGhDMT3进行扩增,获得VIGS片段。用in-FuSion技术将GhDMT3的VIGS沉默片段插入到线性的PYL156载体上,转入大肠杆菌,挑取阳性单克隆测序,获得正确的单克隆,并用EcoRⅠ和XmaⅠ双酶切验证,成功构建pYL156:GhDMT3载体。
1.2.4 pYL156:GhDMT3的VIGS沉默及表达量检测 种植TM-1到两片子叶平展时,用一次性的医用注射器在叶片的背面,进行VIGS注射,注射面积在75%以上。然后置于25℃黑暗培养24 h,处理结束后,在适宜的温度(28℃ 14 h/25℃ 10 h)下保证幼苗正常生长。当出现白化后,对植株分别进行冷(4℃)和干旱(自然干旱)处理,当与对照出现表型差异时,测定GhDMT3的相对表达量。
2 结果
2.1 GhDMT3蛋白的理化性质及亲水性/疏水性分析
通过ExPASY网站的生物软件ProtParam程序对GhDMT3编码的蛋白进行组分分析,该蛋白质相对分子质量为71 107.02 kD,等电点为4.85,该基因编码的蛋白质分子式为C3151H4897N849O981S23,共计9 901个原子,编码640个氨基酸,其中65个带正电的氨基酸(Arg +Lys),96个带负电的氨基酸(Asp+Glu),不稳定系数为36.33,脂肪系数为81.81,总平均亲水性为-0.364,预测该蛋白为酸性蛋白,不含有赖氨酸和丝氨酸,色氨酸含量最低为1.6%,亮氨酸含量最高为10.2%。
2.2 GhDMT3蛋白质的亲疏水性分析

图1 GhDMT3蛋白的疏水性/亲水性检测
利用ProtScale网站对GhDMT3蛋白的亲疏水性进行预测,结果(图1)表明,在256位的S亲水性最强分值为-2.357,在517位的F疏水性最强分值为1.210,亲水性总平均值为-1.157,推测该基因的整个氨基酸序列中亲水性氨基酸比疏水性氨基酸多,所以该蛋白为亲水性蛋白。综上所述,该基因编码的蛋白具有一定的亲水能力但不稳定。
2.3 GhDMT3蛋白的跨膜分析
通过TMHMM网站对GhDMT3蛋白的跨膜结构域进行分析(图2),GhDMT3蛋白不存在跨膜结构域,属于非跨膜蛋白,与该蛋白的疏水性区域分析结果基本一致。利用SignalP-4.0网站对GhDMT3蛋白的信号肽预测结果为C值(剪切位点)为0.114,S值(信号肽)为0.109,Y值(综合剪切点)为0.105(图3)。GhDMT3蛋白并不是分泌型蛋白,不在细胞中发生迁移。

图2 GhDMT3蛋白的跨膜结构域分析

图3 GhDMT3蛋白的信号肽预测
2.4 GhDMT3蛋白的二级结构分析

图4 GhDMT3基因编码蛋白的二级结构
通过软件预测分析GhDMT3蛋白的二级结构。结果(图4)表明,无规则卷曲包含298个氨基酸残基,占46.56%,α螺旋包含266个氨基酸残基,占41.11%,延伸链包含67个氨基酸残基,占10.47%,β-转角包含33个氨基酸,占5.12%。
2.5 GhDMT3蛋白的三级结构分析
使用软件SWISS-MODEL预测GhDMT3蛋白的三维结构,GhDMT3蛋白三维结构以α螺旋为主(图5),符合GhDMT3蛋白的二级结构分析。

图5 GhDMT3蛋白的三级结构
2.6 构建GhDMT3的VIGS载体
利用RT-PCR技术扩增GhDMT3,转T载体,获得t-GhDMT3;以克隆载体t-GhDMT3为模板,对in-v-GhDMT3进行扩增,获得VIGS片段(图6-A)。用in-FuSion技术将GhDMT3的VIGS沉默片段插入到pYL156载体上,并用EcoRⅠ和XmaⅠ双酶切验证(图6-B),即成功构建pYL156:GhDMT3载体。
2.7 VIGS侵染后棉花的表型和GhDMT3的表达量分析
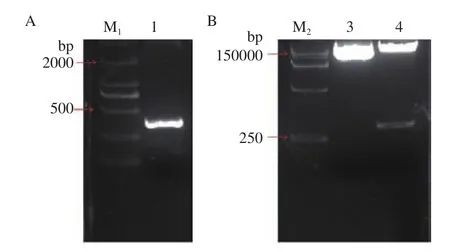
图6 VIGS载体pYL156:GhDMT3的构建与验证
VIGS侵染棉花植株15 d左右,阳性植株叶片白化明显,其他正常生长,用没有侵染的棉花和用pYL156侵染的棉花作对照,对沉默植株进行冷、干旱的胁迫处理。冷处理36 h后植株表型差异明显(图7-A),注射pYL156的植株与野生型的新生真叶枯萎卷曲,注射pYL156:GhDMT3的植株正常生长,表型变化不明显。pYL156侵染的棉花中在不同胁迫下表达量无显著变化,与对照相比,用pYL156:GhDMT3侵染过的棉花GhDMT3转录水平明显下降。根部下降最多;茎部次之;叶片下降最少(图7-B)。
自然干旱6 d后植株表型差异明显,注射pYL156的植株和野生型的子叶脱落,新生真叶发黄枯萎,严重失水,植株死亡,注射pYL156:GhDMT3的植株真叶没有枯萎失水现象(图8-A)。检测pYL156:GhDMT3侵染过的棉花中GhDMT3的相对表达量,由图可知pYL156侵染的棉花中在不同胁迫下表达量没有变化,用pYL156:GhDMT3侵染过的棉花中GhDMT3转录水平与对照相比叶片中下降最多;茎部次之;根部下降最少(图8-B)。
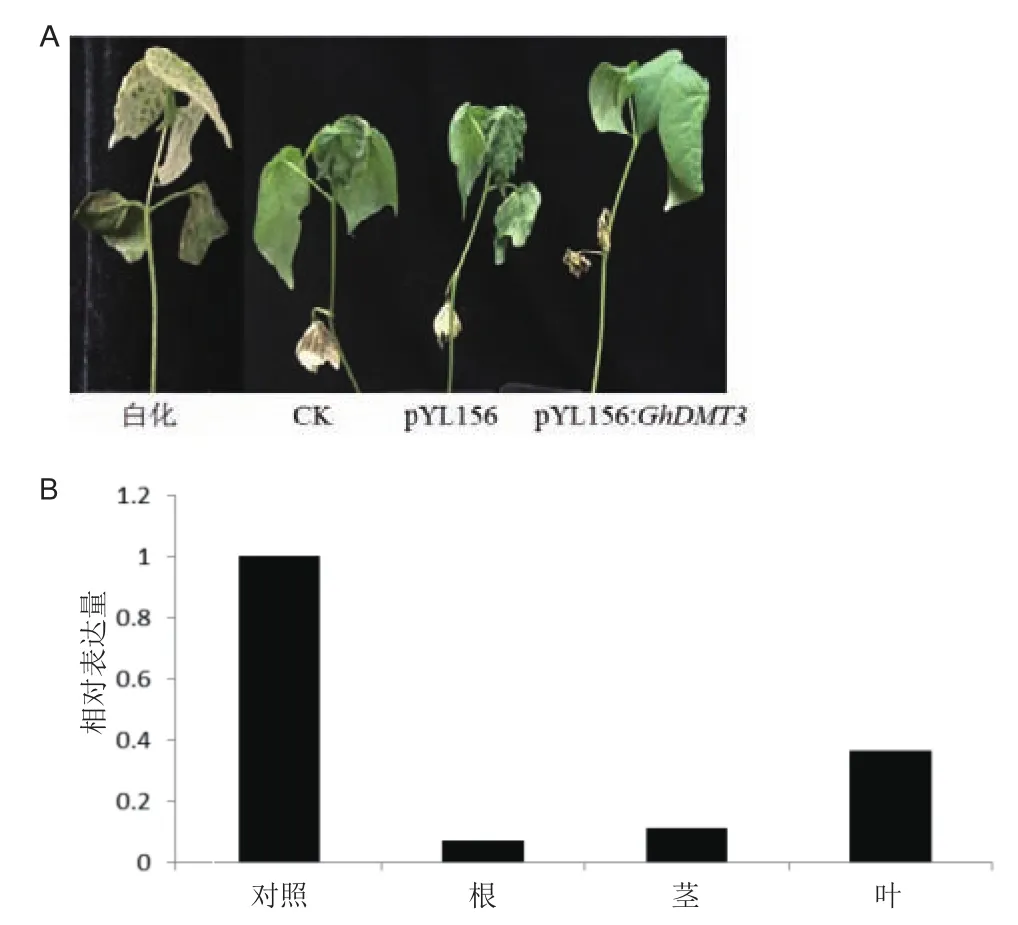
图7 VIGS侵染后的棉花表型和冷胁迫36 h的棉花表型(A);VIGS侵染成功冷胁迫处理后植株的相对表达量(B)

图8 VIGS侵染后的表型和干旱胁迫6 d的表型(A)及VIGS侵染成功干旱胁迫处理后植株的相对表达量(B)
3 讨论
DNA甲基转移酶是DNA甲基化过程中的关键酶,在拟南芥[10]、水稻[21]、玉米[22]、大豆[20]、葡萄[23]、番茄[24]及蓖麻[25]等植物中鉴定出 DNA 甲基转移酶。GhDMT3与蓖麻中的DRM家族基因编码蛋白一致,该家族基因编码蛋白为不稳定的亲水性蛋白,不具有跨膜结构域,二级结构以无规则卷曲、α螺旋为主为。通过分析GhDMT3三维结构与DNA甲基转移酶的典型结构类似,但是有一定的区别,具体原因需要后续实验探明。
大豆的DRM基因在非生物胁迫期间转录水平较高参与诱导DNA甲基化改变[20],当拟南芥drm1和drm2双突变时会造成所有已知模式的胞嘧啶从头甲基化均有缺失[10],DRM家族基因对于FWA和SUP的基因沉默是重要的,可以通过不同的机制使直接重复和反向重复发生甲基化[26]。通过沉默GhDMT3基因,证明该基因与抗逆性相关,为明确该基因的功能奠定基础,而该基因的具体功能需要进一步研究。
4 结论
成功构建了GhDMT3的VIGS沉默载体,获得转基因植株,在冷、干旱胁迫条件下,转基因植株抵抗力增强。
