基于DA受体cAMP-PKA信号通路探讨加味当归芍药散治疗HPRL大鼠的机制
2019-01-23赖珊珊
刘 琛 赖珊珊
高泌乳素血症(hyperprolactinemia,HPRL)是指血清泌乳素(prolactin,PRL)>25ng/mL,临床上青年女性多发,发病率为为0.4%[1-2]。西医常规服用溴隐亭,但其胃肠道不良反应甚至患者不能耐受。中医基于经络、脏象理论认为,该病多与肝脾密切相关,笔者在张仲景的疏肝健脾名方当归芍药散的基础上,经过多年实践,不断优化其配伍组成,形成加味当归芍药散这一自拟方,并实践于临床治疗HPRL患者,证实该自拟方具有明显的疗效及安全性。本研究在此基础上,尝试从经典的信号通路cAMP-PKA,探讨该自拟方治疗大鼠高泌乳素血症(HPRL)的作用机制。
1 实验材料
1.1 动 物 Specefic pathogen Free(SPF)级SD雌性健康发育成熟且未孕大鼠96只,体质量(214.13±31.35)g,福建省中医药研究院代购,合格证:2017001601331,动物实验使用许可证(SYXK[闽]2017-0016),动物居住场所:福建中医药研究院动物房,自由饮食、饮水,笼内温度维持在22~26℃,空气湿度维持在30~70%,安静舒适控制声音低于85分贝,通风换气8~12次/h,光照时间符合昼夜规律(7am~7pm)等正常的居住条件。
1.2 药 品 中药:加味当归芍药散(出自于张仲景《金匮要略》基础上予以加减经验方):当归、芍药各15g,川芎 9g,茯苓 12g,白术 15g,泽泻 9g,浙贝母12g,柴胡 9g,香附 12g,丹参 15g,炒麦芽 50g,神曲9g。煎煮方法:(1)浸泡:生药用凉水没过药物表面并浸泡30min;(2)第一遍煎药:生药连同浸泡水放入砂锅内,文火煎煮1h,倒出药液药渣留在砂锅内;(3)第二遍煎药:放入同量的凉水,继续文火煎熬1h并倒出药液,倒掉药渣;(4)浓缩药液:两次药液混合,大火煎煮,将药液熬煮为300%浓度药液(每1mL药液含生药3.0g),冷却后放置冰箱备用。甲磺酸溴隐亭片(批号 JX20000372,购于 NovarfismaS Farma SPA公司)研磨成粉末,加入生理盐水充分搅拌,制备成浓度为25%混悬液;盐酸甲氧氯普胺注射液(批号20044996,上海现代哈森药业有限公司)。
1.3 设 备 显微镜(OLYMPUS U-TOV.5XC)、图像分析系统(Image-pro plus6.0)、qPCR 仪(Applied Biosystems,SimpliAMP)、梯度 PCR 仪(ABI公司)、实时荧光定量PCR仪(Bio-Rad),洗板机、多功能酶标仪(Tecan)、低速冷冻离心机(Eppendorf)、紫外可见分光光度计(杭州欧米仪器有限公司)、枪头500μL、EP 管 2mL、PCR02mL(AXYGEN)、洗板机(Thermo)。
1.4 试 剂 免疫组化:一抗试剂盒:多巴胺D1受体(dopamine D1 receptor,DRD1)抗体(Abcam,批号ab20066);蛋白激酶 A(proteinkinase A,PKA)抗体(Abcam,批号 ab211265);多巴胺 D2受体(dopamine D2 receptor,DRD2)抗体(Ptgcn,批号 059103);二抗、DAB显色剂、PBS缓冲液由福建省中医药大学附属第二人民医院提供。酶联反应(Elisa):环磷酸腺苷(cyclic adenosinemono phosphatec,cAMP) 试剂 盒(BIOVA-LUE,批号K371-100);多巴胺(Dopamine receptor,DA)试剂(上海晶抗生物工程有限公司,批号JKEA00235);PRL试剂盒(福州迈新生物技术开发有限公司,批号 40422a)。PCR:Trizol、cDNA 一链合成试剂盒(可同时去除DNA污染)、PCR Mix(PCR聚合酶)、YBR Green荧光定量试剂盒、DNA makerⅡ均购自Vazyme;1mL枪头(无 RNA 酶)、200μL枪头(无RNA酶)、10μL枪头(无RNA酶)、1.5mLEp管(无RNA酶)均购自Kirgen公司;Gelred(替代EB的核酸染料)购自bio-ope公司;引物设计由invitrogen公司合成。
2 实验方法
2.1 分组与造模 依次将96只SD雌性大鼠称重、编号之后,运用随机数字表将大鼠进行随机分组,分别为加味当归芍药散高、中、低浓度组、空白组、模型组、阳性对照组,每组16只,并进行染色标记,分笼,普通饲料适应性喂养14天。除了空白组不予处理,其余五组进行造模[2]:经背部皮下注射盐酸甲氧氯普胺注射液,每天2次,于上午10点,下午5点,1次给药50mg/kg,连续5天。
2.2 给 药 造模成功后,经过体表面及药物剂量换算,除了空白组不予处理,模型组按照0.833mg·kg-1·d-1生理盐水灌胃。阳性组予以按 0.833mg·kg-1·d-1给药,相当于临床用药的10倍。高浓度组按照60.0g·kg-1·d-1给药相当于临床用药的20倍、中浓度组按照30.0g·kg-1·d-1给药相当于临床用药的10倍、低浓度组灌胃15.0g·kg-1·d-1给药相当于临床用药的5倍。灌胃时间30d,末次灌胃后,立即处死取材。
2.3 组织标本采集 (1)血液标本:末次给药后,立即麻醉,方式选择腹腔注射,药品采用10%水合氯醛,给药剂量为0.3mL/100g,进行全身麻醉后腹主动脉采血,室温下静置2~3h后,高速离心机10min~15min(2500~3000r/rain),收集上层血清。(2)下丘脑标本:采血后,老鼠立即处死断头,行“T”字形剪开皮肤后充分暴露头部,用眼科剪由下(枕骨大孔处)向上(人字缝),后向两边剖离颅骨,充分暴露脑组织,取出下丘脑,每组8只大鼠下丘脑迅速放入EP管以备PCR检测,另外8只大鼠下丘脑放入装有10%福尔马林溶液固定的标本盒中。
2.4 指标检测
2.4.1 免疫组化 采用SP法:常规石蜡包埋,切片、贴片,需要检查多巴胺D1受体(dopamine D1 receptor,DRD1)、D2 受 体 (dopamineD2receptor,DRD2)、蛋白激酶 A(proteinkinase A,PKA)三个指标,每个指标取3片,切片厚度5μm,烤片、脱蜡、脱水、孵育、PBS冲洗、滴加一抗、二抗、染色、苏木素复染,脱水干燥后即可封片。设立阴性对照,其中D1、D2阳性表现为细胞质膜呈棕黄色,PKA阳性表现为细胞核程棕黄色。运用Image-pro plus6.0分析软件,在显微镜下观察每张切片,随机选择5个视野测定平均光密度。
2.4.2 PCR (1)组织总RNA提取:取约100mg动物组织放于无RNA酶的1.5mL EP管内,组织研磨、分离;RNA沉淀、漂洗;测得RNA的OD260/OD280值是为2.0;(2)RNA逆转录:用HiScriptⅡ Q RT SuperMix for qPCR(+gDNA wiper)进行逆转录反应。基因组 DNA 去除:4X gDNA wiper Mix 4μL,Oligo(dT)(50μm)1μL,Total RNA 1μg,RNase Free dH2O加至16μL。反转录反应条件如下:反转录反应42℃30min,反转录酶失活反应 85℃ 5min;(3)聚合酶链式反应(PCR)检测引物特异性:PCR管依次在管中加入(20μL反应体系):2×rTaq PCR SuperMix10u,上游引物(10μm)0.8μL,下游引物(10μm)0.8μL,cDNA 模板 1μL,Dd,H2O 加 20μL,引物设计:D1受体上游引物5-GCGTCCATTCTGAACCTCTG-3;下游引物5-CGTCCTGCTCAACCTTGTG-3,长度258bp;D2受体上游引物5-GGTCTACTCCTCCATTGTCTCA-3;下游引物5-CATCCATTCTCCGCCTGTTC-3,长度245bp。扩增条件:设定温度94℃进行预变性5 min、变形30s,后将温度降至60℃退火 30s,上调温度至72℃延伸20s,重复操作30个循环后再延伸7min。反应完成后,将5μL扩增产物进行电泳检测。(4)荧光定量PCR反应:根据SYBR的荧光定量PCR步骤操作:AceQ qPCR SYBR Green Master Mix10μL,PCR Forward Primer(10uM)0.5μL,PCR Reverse Primer(10uM)0.5μL,Rox Reference DyeⅡ(50×)0.4μL,cDNA template1.0μL,ddH2O(灭菌蒸馏水)加至20μL。每个反应重复3次,设计实验组和阴性对照,配制反应液时先配制总的反应液,再各个分装。选择ABI7500PCR仪按以下程序进行定时定量PCR 反应。PCR 反应程序设置为:(1)94℃ 30s;(2)94℃ 5s;(3)60℃ 34s(2~3 步 40 个循环)反应结束后进行结果分析:用软件DataAssistTM v3.0 Software(ABI)用 2-△△Ct计算每个样本 DRD1、DRD2、PKA的mRNA相对表达量。
2.4.3 Elisa 将大鼠腹主动脉血液标本室温静置2h后,充分高速离心 10min~15min(2500~3000r/rain),分层,移液枪收取上层血浆,根据试剂盒说明进行操作。
2.5 统计学方法 应用SPSS18.0统计软件处理数据,计量数据均以平均数±标准差()表示,两两之间的数据比较采用单因素方差分析,P<0.05为差异有统计学意义。
3 实验结果
3.1 各组大鼠下丘脑PKA表达 PKA表达模型组最高,高浓度组最低;模型组PKA表达明显高于空白组、阳性组及各浓度组(P<0.01);各浓度组与空白组比较,中浓度PKA表达略低(P<0.05)、高浓度PKA表达明显偏低(P<0.01);与阳性组比较,高浓度组PKA表达明显偏低(P<0.01),中、低浓度两组PKA表达略低(P<0.05),与高浓度组比较,低浓度组表达增高(P<0.05)。见表 1。
3.2 各组大鼠下丘脑组织DRD1、DRD2表达 DRD1数量,空白组最高,模型组最低。空白组DRD1表达明显高于模型组及中、低浓度组(P<0.01)且略高于高浓度组(P<0.05);模型组DRD1表达明显低于阳性、高浓度组(P<0.01),且略低于中浓度组(P<0.05);阳性组DRD1明显高于低浓度组(P<0.01),略高于中浓度组(P<0.05);各浓度组中,低浓度组DRD1表达明显低于高浓度组(P<0.01)。DRD2数量,阳性组最高,模型组最低;空白组DRD2表达明显高于模型组、低浓度组(P<0.01);各组 DRD2数量,除了低浓度组数量略高于模型组(P<0.05),其余DRD2表达均明显高于模型组(P<0.01);阳性组DRD2表达明显高于低浓度组(P<0.01),略高于中浓度组(P<0.05);各浓度组中,低浓度组DRD2表达明显低于高浓度组(P<0.01)。见表 2。
表1 各组大鼠下丘脑组织PKA表达水平比较(

表1 各组大鼠下丘脑组织PKA表达水平比较(
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,△△P<0.01;与阳性组比较,▲P<0.05,▲▲P<0.01;与高浓度组比较,★P<0.05;PKA:蛋白激酶A;空白组不予处理;模型组采用0.833mg·kg-1·d-1生理盐水灌胃;阳性组采用 0.833mg·kg-1·d-1给药;高浓度组以 60.0g·kg-1·d-1给药;中浓度组以30.0g·kg-1·d-1给药;低浓度组以15.0g·kg-1·d-1给药
?
表2 各组大鼠下丘脑组织DRD1、DRD2表达水平比较(
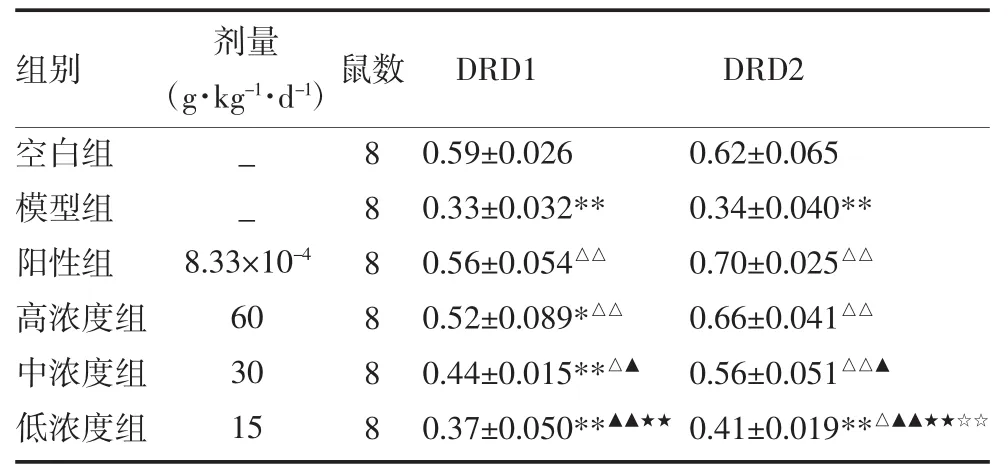
表2 各组大鼠下丘脑组织DRD1、DRD2表达水平比较(
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01;与阳性组比较,▲P<0.05,▲▲P<0.01;与高浓度组比较,★★P<0.01;与中浓度组比较,☆☆P<0.01;DRD1:多巴胺 D1 受体;DRD2:多巴胺 D2 受体;空白组不予处理;模型组采用0.833mg·kg-1·d-1生理盐水灌胃;阳性组采用 0.833mg·kg-1·d-1给药;高浓度组以 60.0g·kg-1·d-1给药;中浓度组以 30.0g·kg-1·d-1给药;低浓度组以 15.0g·kg-1·d-1给药
?
3.3 Elisa检测血清 cAMP、PRL、DA 血清 PRL水平,模型组最高,空白组最低;与模型组相比,阳性组、高浓度组和中浓度组大鼠PRL水平降低(P<0.05)且阳性组和高浓度组的PRL水平接近空白组,两组疗效相当,而低浓度组疗效与模型组相当。血清cAMP水平情况与之相似,模型组最高,空白组最低,与模型组相比,阳性组、高浓度组和中浓度组大鼠cAMP水平显著性降低(P<0.01)而阳性组和高浓度组cAMP水平接近空白组,且两组疗效相当。血清的DA检测中情况则与之相反,空白组水平最高,模型组水平最低;与模型组相比,阳性组、高浓度组和中浓度组大鼠DA水平升高(P<0.05),且阳性组和高浓度组DA水平与空白组接近,两组疗效相当。见表3。
表3 各组大鼠血清PRL、cAMP、DA水平比较(
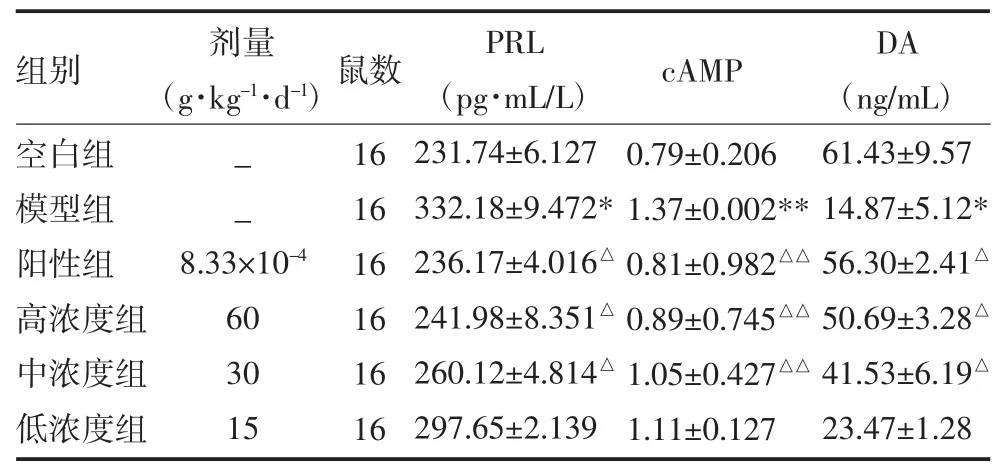
表3 各组大鼠血清PRL、cAMP、DA水平比较(
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01;PRL:泌乳素;cAMP:环磷酸腺苷;DA:多巴胺;空白组不予处理;模型组采用0.833mg·kg-1·d-1生理盐水灌胃;阳性组采用0.833mg·kg-1·d-1给药;高浓度组以 60.0g·kg-1·d-1给药;中浓度组以 30.0g·kg-1·d-1给药;低浓度组以 15.0g·kg-1·d-1给药
?
3.4 各组大鼠下丘脑DRD1mRNA、DRD2mRNA表达情况 DRD1mRNA表达情况空白组最高,模型组最低,与空白组比,模型组表达减少(P<0.05);各浓度组 DRD1mRNA 表达均无差异 (P>0.05)。DRD2 mRNA表达情况,空白组最高,低浓度组最低;与空白组比,模型组、中浓度组、低浓度组表达减少(P<0.05);与高浓度组相比,低浓度组表达明显减少(P<0.05),且阳性组与高浓度组表达量相当(P>0.05)。见表4。
表4 各组大鼠PCR D1RmRNA、D2RmRNA表达水平比较(

表4 各组大鼠PCR D1RmRNA、D2RmRNA表达水平比较(
注:与空白组比,*P<0.05,与模型组比,△P<0.05;DRD1 mRNA:多巴胺D1受体mRNA;DRD2:多巴胺D2受体mRNA;空白组不予处理;模型组采用 0.833mg·kg-1·d-1生理盐水灌胃;阳性组采用 0.833mg·kg-1·d-1给药;高浓度组以 60.0g·kg-1·d-1给药;中浓度组以 30.0g·kg-1·d-1给药;低浓度组以 15.0g·kg-1·d-1给药
?
4 讨论
高泌乳素血症根据患者临床表现归属于中医“乳衄”、“月经病”、“不孕症”等范畴[3]。在经络学说中,阳明经主支直行在缺盆处向下行至乳内;厥阴经迂回环绕并上行,过乳头与肺经相连[4]。经乳同源于脾胃冲任[5],均为气血所化生,气血则得于精微化生,精微布散则得于脾土;脾土升阳举清则得助于肝木畅达;同时经血排出有时、乳汁溢出有度则赖于肝气和,气血调,冲任充。若情志不畅,肝郁气结,疏泄无序,加之脾土受损,清阳不升,精微不布,血海空虚不盈,故无血可下,出现闭经;若久郁化火,怒火携气血上行,化生乳汁,出现溢乳;若肝木抑郁,气滞血壅,木旺乘土,脾为生痰之源,痰瘀互结,冲任受阻,则月经失调,出现不孕。可见责之肝脾,虚实夹杂。治疗上当以肝脾为核心,以疏肝理气、健脾助运为主,兼以益气养血,痰瘀并除为治则。
在《金匮要略》中,张仲景认为,凡属于肝病及脾、肝脾不调、肝木乘脾者,均可用疏肝健脾方之祖当归芍药散[6]。根据临床多年的辨证加减经验,笔者在当归芍药散的基础上形成了自拟方治疗肝郁脾虚之高泌乳素血症。全方中白芍味酸能敛阴,入肝脾经,为治肝之要药,能平肝,柔肝,养肝;当归辛行补血兼能活血,为妇科调经之要药;川芎入血分,性辛香而擅行血,与当归均为“血中之气药”;柴胡性辛,条达肝脏之气滞,清泻厥阴之郁热;丹参清血分之郁热,化离经之瘀血以助生新血;香附通达三焦,长于疏调肝之气机“气病之总司”;以上诸药补阴而不碍脾,活血而不伤正,气血调顺,血和养阴,气疏柔肝。兼以白术、茯苓入脾经而益中气,祛水湿而助运化,浙贝母、神曲祛痰湿清郁热,泽泻通利小便以除水湿,助脾之运化、肝之疏泄。重用消食药麦芽,归脾胃主化积回乳,归肝经主泻肝火而退乳消胀[7-8]。纵观全方,组方严谨,养肝血行肝气,健脾气助运化,痰瘀得除,血和气畅,木能疏土,土木相安,临床疗效确切。
临床实践中大多患者因出现月经稀少、推迟甚至闭经而就诊,而近年来高泌乳素血症因可造成女性不孕得到越来越受到关注,现代医学将其临床表现概括为闭经-泌乳综合征[9]。PRL是具有昼夜节律的蛋白类激素,在下丘脑释放的催乳素释放因子(PRF)和催乳素抑制因子(PIF)的调控中取得一个平衡以维持人体正常PRL水平[10]。DA为目前发现在PIF中降低PRL水平作用最强,通过垂体门脉毛细血管系统,作用于泌乳素细胞表面DA受体发挥作用,而DA受体归属于G蛋白偶联受体,分成D1、D2两类作用相反的受体,G蛋白分为激活型和抑制型调节(Gs和 Gi)[11-12]。在通路 cAMP-PKA 中,泌乳细胞上的DRD1与相应的细胞外信号结合后,通过Gs蛋白去激活腺苷酸环化酶(AC)使得ATP去磷酸化产生第二信使cAMP,产生细胞内效应,包含激活能进入细胞核中,磷酸化基因调控蛋白的PKA进而增强PRL基因的表达,而DRD2则通过Gi蛋白,与DRD1起相反的效应,使cAMP生成减少从而降低PRL水平,基于这一理论,高泌乳素血症的临床诊治中,可以从这一信号通路机制中入手,通过血脑屏障,作用靶点选择位于DRD2受体到达治疗的目的,如西药溴隐亭[13-14]。
本研究发现,空白组与溴隐亭组、高浓度组血清PRL、cAMP、DA水平相近,三组不同的给药浓度中,给药浓度越来越高,则PRL水平、cAMP含量越来越低,DA含量反之越来越高,不仅发现血清PRL分泌受到cAMP正向促进和DA反向抑制,并且空白组的PRL水平低于模型组(P<0.05),恰好反证实造模成功。各浓度组中下丘脑PKA表达与cAMP表达差异情况相似,随着浓度增高,cAMP、PKA表达减少,这与DRD2在这一信号通路中的作用相似。从PCR的检测结果来看,DRD1mRNA、DRD2 mRNA的表达,虽然都是空白组最高、模型组最低,但是各浓度组中DRD1mRNA的差异小,而在DRD2mRNA的表达中高浓度组明显高于模型组,且表达与阳性组相当;结合免疫组化结果分析,不难得知在各浓度组中,DRD2的表达明显于DRD1。综上所述,随着给药浓度的增加,DRD2表达也随之增加,DRD1表达影响可忽略,由此可见加味当归散治疗高泌乳素血症大鼠应该通过DRD2来发挥类似多巴胺的作用从而达到治疗效果。
