芳香化酶抑制剂对乳腺癌患者骨密度的影响
2019-01-22薛亭,万华
薛 亭, 万 华
(上海中医药大学附属曙光医院乳腺科, 上海 201203)
芳香化酶抑制剂(Aromatase Inhibitors,AIs)能特异性抑制人体外周组织芳香化酶活性,促进细胞发生凋亡,减少循环血中雌激素水平,降低乳腺癌患者的复发风险,提高患者的无病生存期及总生存率,是目前临床激素受体(Hormone Receptor,HR)阳性的绝经状态乳腺癌患者首选内分泌治疗药物[1]。近年来国内外临床试验证实,在绝经后乳腺癌患者中,AIs较他莫昔芬(Tamoxifen,TAM)取得了更优的临床疗效和耐受性[2-4],但其引起的骨丢失副作用也逐渐受到学者关注。本研究以骨密度为评价指标,探讨芳香化酶抑制剂对HR阳性、HR阴性的绝经后乳腺癌患者以及健康绝经后女性骨密度(Bone Mineral Density, BMD)的影响,现报道如下。
1 资料与方法
1.1一般资料收集2016年9月-2018年10月在上海中医药大学附属曙光医院乳腺科接受治疗的绝经后乳腺癌患者70例作为研究对象,其中HR阳性的40例患者为A组,HR阴性的30例患者作为B组,同时选取入院体检的健康绝经后女性30例对照为C组。A组平均年龄(58.28±5.06)岁,平均绝经时间(8.25±5.06) a,体质指数(Body mass index,BMI)24.45±3.27;B组平均年龄(59.01±5.31)岁,平均绝经时间(8.89±4.62)a,BMI 23.26±2.41;C组平均年龄(57.85±6.16)岁,平均绝经年龄(9.27±4.54) a,BMI24.13±2.79,3组一般资料差异无统计学意义(P>0.05)。
1.2纳入及排除标准A组纳入标准:(1)临床分期为Ⅰ~Ⅲ期的绝经后乳腺癌术后患者,HR阳性;(2)术后拟接受或已接受AIs治疗,服药时间在3个月以内。B组纳入标准:临床分期为Ⅰ~Ⅲ期的绝经后乳腺癌术后患者,HR阴性。C组纳入标准:在院体检排除乳腺癌。排除标准:(1)患有其他恶性肿瘤或影响骨代谢的相关性疾病;(2)骨密度检测诊断为骨质疏松症;(3)伴有严重心、脑、肾等疾病者。3组研究对象均需签订知情同意书。
1.3治疗方法A组患者每天服用AIs(阿那曲唑、来曲唑、依西美坦)1片,3组研究对象每天服用1片钙尔奇D,连续服药12个月。
1.4观察指标的测定对3组研究对象治疗前后BMD及骨质疏松发生率进行测定,BMD测定应用美国GE公司所生产的Lunar-Prodigy DXA骨密度仪,测量受试者仰卧前后位第1-4腰椎(L1-L4)、股骨颈、全髋的BMD,并对年龄、BMI等影响BMD的因素进行修正。根据世界卫生组织(WHO)对骨质疏松症的诊断标准[5]:骨密度值低于同性别同种族正常成人的骨峰值(T-core)≥2.5个标准差即为骨质疏松症,1~2.5个标准差之间为骨量减少,不足1个标准差属正常。

2 结果
2.13组研究对象治疗前后骨密度的比较3组研究对象治疗前L1-L4、股骨颈、全髋BMD比较,差异均无统计学意义(P>0.05)。A组治疗前后比较,L1-L4、股骨颈、全髋BMD降低,差异有统计学意义(P<0.05)。B、C组治疗前后组内BMD比较,差异无统计学意义(P>0.05)。治疗12个月后,与B、C组比较,A组L1-L4、股骨颈、全髋骨密度降低,差异有统计学意义(P>0.05);B、C组之间比较,差异无统计学意义(P>0.05),见表1。
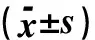
表1 A组、B组、C组研究对象治疗前及治疗后12个月L1-L4、股骨颈、全髋BMD比较
注:与本组治疗前比较,*P<0.05; 与A组同期比较,aP<0.05; 与B组同期比较,bP<0.05; 与C组同期比较,cP<0.05。
2.23组研究对象治疗前后骨状态构成比A组服用AIs12个月后骨质疏松发生率为12.50%,与治疗前比较,差异有统计学意义(P<0.05)。B、C组治疗12个月后,骨质疏松发生率与治疗前比较,差异无统计学意义(P>0.05)。治疗12个月后,与B、C组比较,A组骨质疏松发生率升高,差异有统计学意义(P<0.05),见表2。
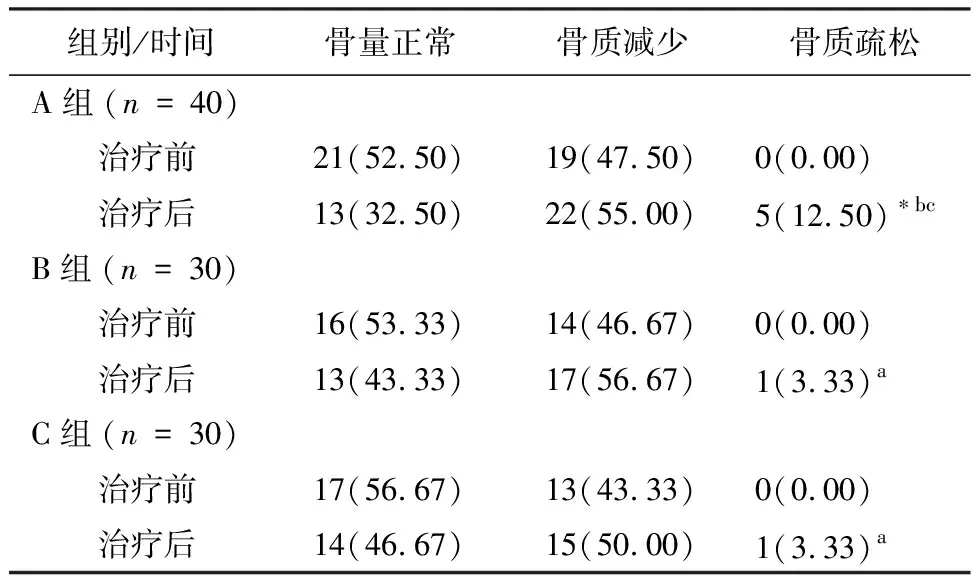
表2 3组研究对象治疗前及治疗后12个月骨状态情况(n/%)
注:与本组治疗前比较,*P<0.05;与A组同期比较,aP<0.05;与B组同期比较,bP<0.05; 与C组同期比较,cP<0.05。
3 讨论
乳腺癌是女性发病率最高的恶性肿瘤,占肿瘤发生率的29%,最新的Globocan统计数据显示,全球每年有超过167万女性被诊断出乳腺癌,其中52.9%发生在发展中国家[6]。随着我国经济发展、人民生活水平的提高和饮食习惯的改变,乳腺癌的发病率也呈逐年上升趋势,乳腺癌发病因素虽未明确,但已有临床研究表明家族遗传、长期服用外源性雌激素、过量饮酒等与罹患乳腺癌有关[7]。由于我国乳腺癌患者的发病年龄高峰较西方发达国家提前了10 a,年轻患者的比例更高,对社会带来的影响也更加严重。据上海市疾病预防控制中心2018年公布的数据显示:乳腺癌已成为上海市近10 a女性恶性肿瘤发病的首位,发病率为46.95/10万,其中60%~70%患者雌激素或孕激素受体阳性,三分之二的患者处于绝经后状态[8]。在临床医学的发展中,乳腺癌的治疗手段随着基因检测和病理学研究的进展,出现多元化[9-10]。术后放疗、化疗、内分泌治疗和分子靶向治疗的综合应用使得乳腺癌患者的存活期得到了明显延长,5 a生存率有了很大提高[11-12]。在乳腺癌的综合治疗中,内分泌治疗作为乳腺癌综合治疗的重要组成部分,已受到了广泛的重视。以美国国家癌症综合网(NCCN)指南、瑞士St1Gallen乳腺癌会议和国内北方乳腺癌沙龙为代表, 已达成乳腺癌内分泌治疗的专家共识,将第3代AIs用于激素受体阳性的绝经后乳腺癌患者是治疗,推荐用药时间为5~10年[13-14]。近年来国际上多个大规模临床观察试验(如ATAC、BIG、1-98、IES031、ITA、ARNO、MA-17等)已肯定了AIs(阿那曲唑、来曲唑、依西美坦)的疗效[15-19]。在乳腺癌患者中应用AIs可有效预防乳腺癌的复发及延长生存期,但其副作用也逐渐受到关注,其中最为显著的是导致患者骨代谢异常、骨量下降,从而引起全身关节酸痛,增加骨质疏松风险等[20]。有学者在研究中指出,应用AIs治疗的乳腺癌患者较正常绝经后女性易发生骨质疏松,从而影响患者生活质量及服药依从性[21]。芳香化酶属于细胞色素P450酶复合体,存在于卵巢、肝脏等组织中,可将雄激素的A环芳香化,促使雄烯二酮等雄激素转化为雌酮与雌二醇。绝经后妇女体内雌激素主要来源于外周脂肪组织与肾上腺的芳香化酶将雄激素转化为雌激素[22]。芳香化酶抑制剂能够经由抑制外周组织芳香化酶活性,促进细胞发生凋亡,达到降低循环血中雌激素水平的效果,提升绝经后乳腺癌患者的无病生存期。服用AIs的患者骨密度明显降低是因为芳香化酶对于骨有护作用,其主要源自于对破骨细胞生成的调节作用,经由护骨素等促进作用的发挥。而护骨素属于分泌型糖蛋白与缺乏跨膜结构域的TNF受体成员,具有抑制破骨细胞活性的作用。从这一点进行分析,AIs降低了绝经后女性体内的雌激素水平,进而影响到骨代谢,加速骨丢失,增加骨质疏松发生风险。综上所述,在绝经后乳腺癌患者的治疗中,应用AIs能够有效达到控制患者体内雌激素,提升患者的无病生存率,但会增加乳腺癌患者骨质疏松的发生风险。为此,在治疗期间,需要密切观察患者骨密度等相关指标的变化情况,做好骨质疏松的预防干预。
