Cd在小麦不同生育期器官及亚细胞中的分布
2019-01-21孙芳立苏忠亮郭庆增
孙芳立,苏忠亮,郭庆增
(1.青岛科技大学 环境科学与安全工程学院,山东 青岛 266042;2.青岛科技大学 化工学院,山东 青岛 266042)
随着我国经济的发展、公众环保意识的增强,粮食安全越来越受到人们的重视.其中,重金属对粮食作物的危害是粮食安全亟待解决的问题之一.据不完全统计,在20世纪90年代,我国遭受Cd污染的农田面积超过了1.3×104hm2,近些年Cd的污染状况还有进一步增强的趋势[1].Cd一旦对土壤造成污染,不仅对植物有严重的毒害作用,而且会进一步通过食物链最终危害人体健康[2].小麦是我国重要的粮食作物,在世界上也是主要的粮食作物之一.目前有关Cd对水稻污染的报道很多[3-5],但是Cd对小麦的污染机制研究相对较少.不同的重金属在不同的植物细胞内,其富集和分布是存在差异的,即使是同种重金属,在不同植物组织细胞的亚细胞结构中,其富集也存在很大差异.植物吸收重金属后,会对重金属在组织水平和亚细胞水平进行选择性分配.这种分配与植物的重金属防御机制密切相关[6-7].Cd是耕地土壤中受到广泛关注的重金属污染物之一,因此研究Cd在小麦亚细胞中的富集规律对于研究植物的重金属防御机制和食品安全具有重要的意义.
重金属在小麦不同器官中的富集规律是不同的[8-9],主要的富集器官是根.Cd在小麦的不同生育期,其富集规律也有很大的差异[10].在小麦的幼苗期,Cd在小麦根与茎叶中的富集浓度随着处理浓度的增加而增加[11],但是在其他的生育期重金属吸收Cd还需要能量的主动运输,因此Cd的富集浓度不再与处理浓度呈正相关[12].Cd在小麦的器官中富集后,会进一步毒害小麦的组织细胞,进而影响小麦的正常生长发育.植物为抵御重金属的毒害,自身具有一套抵御装置.例如,细胞壁会与Cd结合,限制Cd进一步进入细胞[13];虽然Cd在根细胞中的富集浓度增加,但是在茎叶中的富集浓度不一定会随之增加[14].
目前关于Cd在小麦不同器官中的富集规律已经有了一些报道[10,15-16],但是在亚细胞水平上关于Cd在小麦全生育期的研究却鲜有报道.小麦在世界上也是十分重要的粮食作物,但是目前研究重金属对植物的毒害实验,大都是采用培养液培养试验或者是盆栽试验[17],这种培养方法与小麦在田间的实际生长存在很大的差异.
小麦是毒性实验常用的标准物种之一,笔者采用田间小区试验,保证水肥、培养等条件与田间小麦一致,研究Cd在小麦全生育期中亚细胞中的富集规律,以便进一步探讨小麦对Cd的解毒机制.
1 材料与方法
1.1 实验设计
该研究在青岛市城阳京口村进行,以Cd为研究对象,参照土壤环境质量标准(GB15618-1995),重金属Cd设置5个梯度:对照(CK)、低剂量(L1)、中剂量(L2)、高剂量(L3)以及超高剂量(L4),其浓度梯度分别为0,1,3,5,8 mg·kg-1.Cd以一层过筛土一层CdSO4溶液形式喷洒于每个小区,并翻土混匀加入土壤中.小区土壤本底相关理化性质见表1.试验田共设置45相同的个小区,每个小区面积为6 m2,通过在小区之间增设PVC隔板或田埂进行隔离.小麦在2014年10月8日播种,每小区播种量110 g.分别在分蘖期、拔节-孕穗期、抽穗-扬花期、灌浆期对小麦进行采样并测定其不同亚细胞中Cd的含量,每个样品重复测试2次,最终结果取2次测量值的平均.

表1 田间小区土壤本底理化性质
1.2 材 料
实验供试材料为济麦22.实验用水均为去离子水,实验所涉及的一些常规化学试剂主要是:硝酸、高氯酸、盐酸、蔗糖、三异丙基乙磺酰、盐酸、二硫赤鲜糖醇,试剂规格为分析纯,均购自中国天津市巴斯夫化工有限公司.
主要仪器与设备:Hitachi超速冷冻离心机CR21GIII,日本日立公司;AA600型石墨炉原子吸收仪,美国PE公司;AA400型火焰原子吸收仪,美国PE公司;玻璃研钵、电加热板、通风橱.
1.3 方 法
植物样品前期处理[18]:每个试验田随机选择5个点进行样品采集,用自来水冲洗掉附着在小麦鲜样表面的浮土,再擦干水.然后分别剪下根和茎叶,剪碎后称量.
4 ℃冰浴研磨:剪碎后的小麦茎叶、根的鲜样各称取1.000 0 g,放入洗净、烘干后的玻璃研钵中,分次加入5mL预冷的提取液研磨成匀浆(提取液组成为:250 mmol·L-1蔗糖,50 mmol·L-1Tris-HCl缓冲溶液(pH=7.5)和1.0 mmol·L-1的二硫赤藓糖醇),然后将匀浆转移到50 mL的离心管中,再用15 mL同样的提取液多次洗涤研钵中的残留物,一并转移到离心管中.
4 ℃冷冻离心:参照文献[18-19]的方法将研磨成匀浆的小麦鲜样在4 ℃的条件下冰浴离心. 首先将匀浆在3 000 r·min-1下离心15 min,沉淀为含有细胞壁的残渣部分.再将上清液在15 000 r·min-1的条件下二次离心30 min,二次离心的上清液为细胞质溶液,二次离心残渣为小麦细胞器组分[19].
消化:参照文献[18-19]的方法向离心后的一次离心上清液、二次离心上清液和二次离心的残渣分别加入10 mL体积比为1∶9的HNO3-HClO4溶液,酸化反应一段时间后,将其转移到250 mL的锥形瓶中. 用5 mL体积比为1∶9的HNO3-HClO4溶液洗涤盛放二次离心残渣的离心管,而盛放两次离心上清液的离心管用去离子水洗涤,并将洗涤液一并转移到锥形瓶中. 在锥形瓶上放入漏斗进行冷却水回流,然后将锥形瓶放到电加热板开始加热. 加热采取逐步升温的方法,先将温度调到120 ℃加热30 min,随后升温到180 ℃加热30 min,然后再升温至220 ℃进行消化. 1 h后取下漏斗,加热到近干,再加入2 mL体积比为1∶3的H3PO4溶液,并用10~20 mL去离子水冲洗锥形瓶壁,将锥形瓶放到电加热板上加热10 min,取下,冷却至室温[19].
测定:根据文献[18]的方法将消化好的溶液转移,定容,用石墨炉原子吸收仪测定Cd含量.
在小麦的成熟期以及灌浆期,由于小麦叶片以及麦穗开始干枯发黄,难以研磨进行亚细胞分离,因此只测得地上部分干样数据进行总质量分析.
2 结果与分析
2.1 Cd在小麦不同生育期各亚细胞中的分布
在不同的生育期,Cd的富集规律也是不同的.除了拔节-孕穗期Cd的主要富集器官是叶之外,Cd在小麦不同时期的主要富集器官是根.在亚细胞水平,Cd的富集位点以富集量大小依次是细胞质溶液>细胞壁>细胞器,具体结果如图1所示.
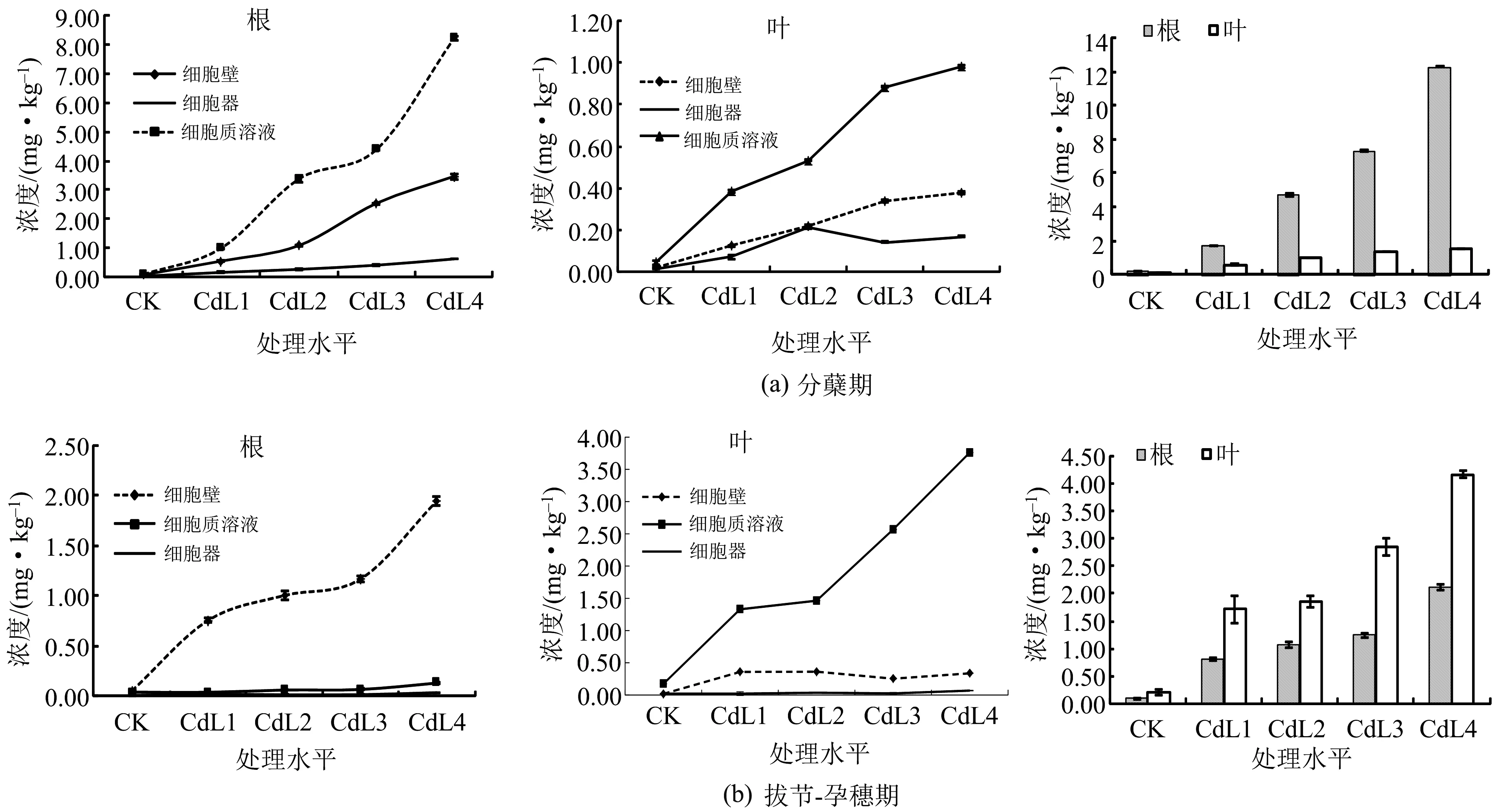
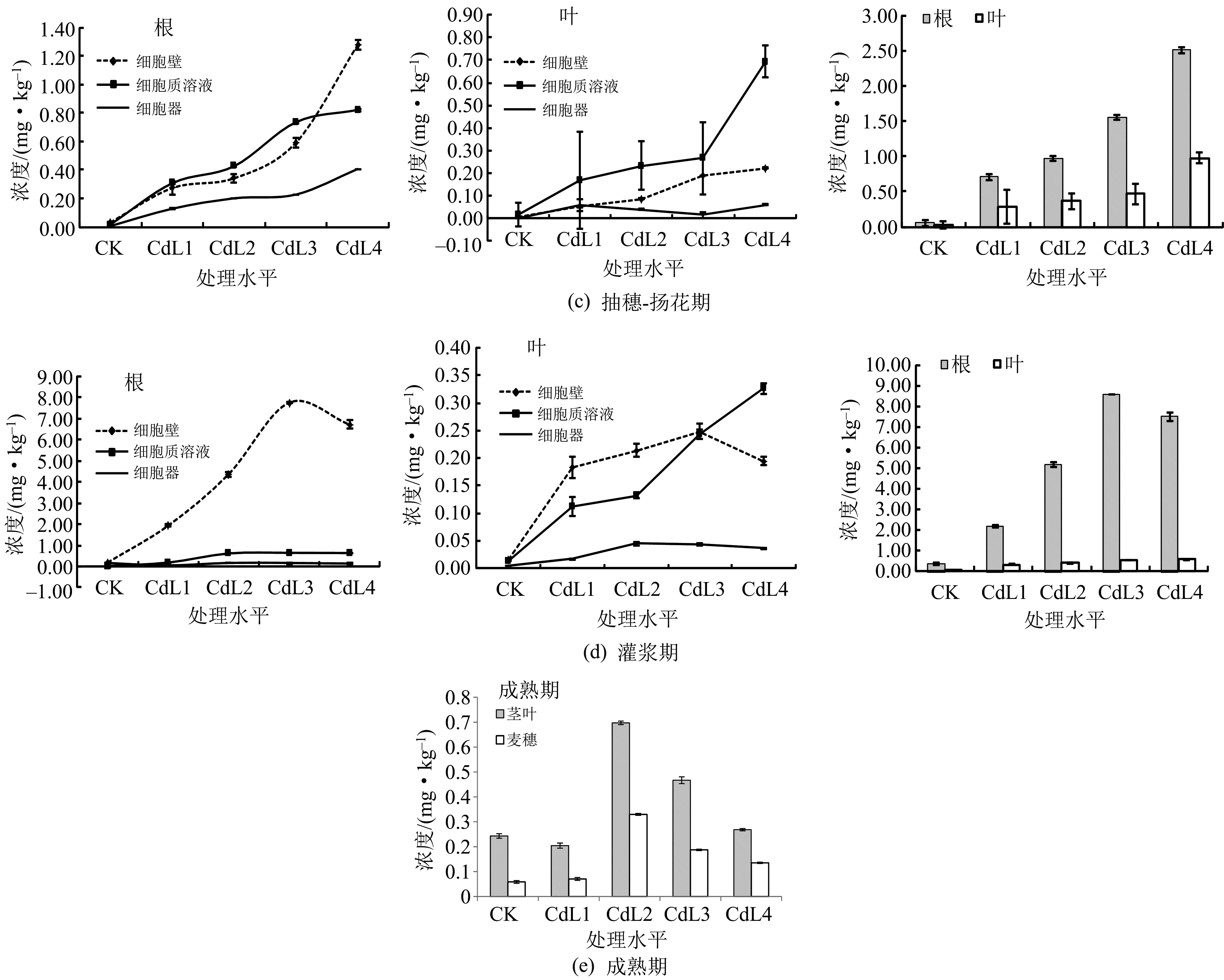
图1 小麦不同生育期不同器官中Cd的浓度分布
如图1所示,Cd在分蘖期、拔节-孕穗期、抽穗-扬花期小麦的根、茎叶细胞的各个亚细胞结构中的富集浓度是随着处理水平的增加而增加.总体来看,Cd是主要富集在细胞质溶液中,其次是细胞壁,而在细胞器中的富集浓度最少.这与杨卫东、宋晓慧等[20-21]的研究结果一致,也进一步诠释和体现了小麦对重金属Cd的防御机制.土壤中的重金属在进入细胞时首先与植物细胞细胞壁上的非原生质体结合.这是由于原生质体含有的大量的多糖分子或蛋白质分子具有大量活性基团(如:羧基、羟基、氨基).这些活性基团通过配位作用将Cd固定在细胞壁表面,阻止Cd进入细胞,达到减少重金属跨膜运输的目的从而降低重金属对细胞的毒害作用[15,22-23].但是当土壤中的重金属含量过多,细胞壁不足以固定这些重金属时,重金属就会进入细胞,此时细胞的第二种防御机制就开始发挥作用.植物为降低重金属的危害,高尔基体、内质网等细胞器即会分泌细胞膜类似物将进入细胞的重金属进行包裹固定,这一防御机制叫作区隔化作用[13].重金属的区隔化极大地阻止了重金属进入细胞器,防止重金属进一步危害维持细胞正常生理功能的细胞器的功能和结构.Cd在进入细胞之后,除了会进行区隔化,还会与细胞中的植物络合素以及金属硫蛋白中的巯基官能团结合,降低Cd的毒性[24].
如图1(a)所示,Cd在灌浆期主要的富集器官是根,在叶中的富集浓度相对较低.这是由于根是直接与土壤中重金属接触的器官,Cd首先在根部富集之后,经过根的截留作用,才会向地上部分转移.这也是植物对重金属的一种解毒机制的体现,将重金属固定在根部,防止其向地上部分转移,危害植物的其他重要器官[11].Cd在小麦根细胞的各个亚细胞结构中的富集浓度随着处理水平的增加呈现出先增加后减少的趋势.Cd在根细胞各亚细胞中的富集浓度高低为:细胞质溶液>细胞壁>细胞器.Cd在叶细胞中的富集浓度随着处理水平的增加一直呈现出增加的趋势,其在叶细胞中富集浓度依次为:细胞壁≈细胞质溶液>细胞器.Cd在根与茎叶这两种细胞器中不同的重金属分布也进一步证实了,在低浓度Cd胁迫下,细胞器的固定是细胞主要的解毒机制,随着Cd的浓度增加,细胞质溶液的区隔化作用更加显示出优势.
如图1(b)所示,Cd在拔节-孕穗期主要的富集器官是叶,在根中的富集浓度相对较低.这是由于在小麦的根细胞中Cd的富集浓度相对于分蘖期较低,而在叶细胞中的富集浓度比较高,这是由于在这一时期,重金属Cd更多地向地上部分进行了转移.分析其原因,可能是由于在拔节-孕穗期,小麦的地上部分进入迅速增长的阶段,物质的转运速率高于积累速率,Cd会随着其他物质一起向地上部分转移,所以Cd的富集部位也开始从地下部分转移到地上部分,主要的富集器官是叶.Cd在根细胞各亚细胞中的富集浓度依次为:细胞质溶液>细胞壁>细胞器.Cd在叶细胞中的富集浓度随着处理水平的增加一直呈现增加的趋势,其在叶细胞中富集浓度依次为:细胞壁≈细胞质溶液>细胞器.这一点与分蘖期小麦亚细胞对Cd的富集规律一致.
如图1(c)所示,Cd在抽穗-扬花期主要的富集器官是根.Cd在小麦根、叶细胞的细胞壁上的富集浓度是随着处理水平的增加而增加,在叶细胞质溶液中的富集浓度是持续增加,而在根、叶的其他亚细胞结构中则是先增加然后达到平衡.Cd在根、叶器官的各亚细胞中的富集规律呈现为:细胞质溶液>细胞壁>细胞器.
如图1(d)所示,Cd在灌浆期主要的富集器官是根.Cd在小麦根细胞的各个亚细胞结构中的富集浓度也是随着处理水平的增加呈现出先增加后降低的趋势,在处理水平为L3时富集浓度达到最大,说明在小麦灌浆期,L3处理水平是小麦所能承受的临界浓度.当处理浓度大于此浓度时,可能会对细胞造成不可逆的损伤,使小麦细胞对Cd的富集浓度反而下降;也可能会使细胞的吸收营养物质的机制受损,导致小麦根部吸收物质的浓度降低,从而Cd的富集浓度也随之降低.在根细胞各亚细胞中的富集特征是:细胞质溶液>细胞壁>细胞器.Cd在叶细胞中的富集浓度随着处理水平的增加而增加,其在叶细胞中的富集特征是细胞壁≈细胞质溶液>细胞器.
如图1(e)所示,Cd在成熟期的主要富集器官是根,且Cd在根以及叶中的富集规律均呈现出先增加后降低的趋势.Cd的富集浓度在处理水平为L2时达到最大,说明在成熟期,处理水平L2为小麦对Cd的承受临界浓度.
2.2 Cd在小麦全生育期根、叶细胞中的分布规律
在根细胞中,Cd在小麦中的富集浓度随着生长时间的延长呈现出先降低后增加的趋势,分蘖期和灌浆期的富集浓度要高于拔节-孕穗期和抽穗-扬花期;在叶细胞中,Cd在小麦亚细胞中的富集浓度呈现出先增加后降低的趋势,分蘖期和灌浆期的富集浓度则低于拔节-孕穗期和抽穗-扬花期.即使是在相同的浓度下,不同的生育期,Cd在根细胞以及叶细胞中的分布都是不同的.
图2为Cd在小麦全生育期根细胞和叶细胞中的分布规律.
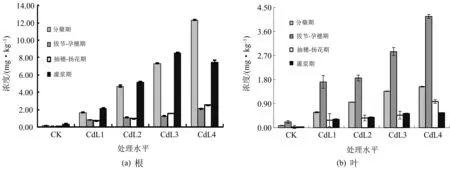
图2 不同生育期中Cd在小麦器官中的分布
如图2所示,随着小麦的生长发育,在每一处理水平下Cd在根细胞中的富集浓度出现先降低后增加的现象,而在叶细胞中的富集浓度则出现先增加后降低的现象.分析其原因,可能是在小麦的分蘖期,小麦生长发育还没有成熟,机体对重金属的防御机制还不完善.所以Cd在根细胞中的富集浓度要高于其他的生育期[10].小麦在拔节-孕穗期发育迅速,其生长速率要高于积累速率,所以Cd的总富集浓度出现下降趋势.另外,这一时期是小麦迅速长高的阶段,重金属离子会随着其他营养物质向地上部分转移,所以Cd在叶中的富集浓度要高于根,并且也高于其他几个时期[10].在抽穗-扬花期,小麦的生长速率要大于重金属的吸收速率,所以重金属在小麦根、叶中的富集浓度下降.在灌浆期,小麦开始趋于成熟,根开始出现老化现象,所以在这个时期小麦在根中的富集浓度开始上升[24].
3 结束语
除拔节-孕穗期,Cd在小麦中的主要富集器官是叶外,其他生长时期,Cd在小麦中的主要富集器官都是根.这是植物对重金属的一种解毒机制的体现,将重金属固定在根部,防止其向地上部分转移危害植物的其他重要器官.小麦是重要的粮食作物,根阻止Cd向地上部分的转移,保证了主要的食用部分籽粒中的富集浓度较低,对于食品安全是有利的.
在亚细胞水平,无论是哪个生育期,Cd在小麦中的主要富集部位是细胞质溶液,其次是细胞壁,而在细胞器中的富集浓度非常低.这说明细胞壁对重金属的络合以及细胞质溶液对Cd的区隔化可能是小麦解毒的主要机制.但是,要阐明重金属对小麦的毒害机制还需要进一步研究小麦超微结构以及相关酶系的变化.
在同一种处理水平下,不同的生育期,Cd在小麦中的富集规律是不同的,因此可以为进一步建立一种新的重金属监测机制提供相应的理论基础.
