花青素通过TLR4/NF-κB通路对脂多糖诱导的血管内皮损伤的保护作用
2019-01-21陈惠,胡勇
陈 惠,胡 勇
动脉粥样硬化(atherosclerosis,AS)是多种心脑血管疾病的主要病理基础,现已严重危害到人类的健康[1]。 大量基础和临床研究表明[2],动脉粥样硬化是一种慢性炎症性疾病,是血管壁对各种损伤的一种异常反应,具有经典炎症变性、渗出及增生的特点。炎症反应贯穿动脉粥样硬化发病的各个阶段,可能是多种致动脉粥样硬化因素致病机制的共同环节或通路。炎症机制不但与动脉粥样硬化的发生发展有关,而且与动脉粥样硬化的多种并发症的发生密切相关。动脉粥样硬化的炎症类型包括生物性炎症、免疫性炎症和化学性炎症。动脉粥样硬化发病初期主要表现为急性渗出性炎症,而在进展期主要表现出慢性增生性炎症的特点。炎症反应中涉及多种炎症细胞、炎性细胞因子、炎性介质、黏附分子、趋化因子、生长因子等。现已证明,多种抗动脉粥样硬化药物具有抗炎作用,抗感染治疗已成为防治动脉粥样硬化的一种新途径。
花青素是一种存在于植物性食物中的具有生物活性的化合物,存在于植物的叶、茎、花和果实中,具有多种药理作用。研究表明[3],花青素具有抗氧化、清除自由基、抗炎等作用,花青素其有效成分对内皮细胞有显著保护作用,从而防止和减轻相关疾病发生发展过程中的内皮功能障碍。该研究以脂多糖(LPS)诱导内皮细胞损伤作为模型,研究花青素对血管内皮细胞保护作用及相关机制。
1 材料与方法
1.1 试验药物 花青素,纯度≥98%,购自南京景竹生物科技有限公司。
1.2 细胞 人脐静脉内皮细胞 (HUVECs),购自南京凯基生物科技发展有限公司。
1.3 试剂 胎牛血清购自四季青公司、含0.25%EDTA的胰酶和高糖DMEM细胞培养购自美国Hyclone公司;MTT试剂盒购自北京solaibio公司;乳酸脱氢酶(LDH)、丙二醛(MDA)、超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)试剂盒购自南京建成生物公司;一氧化氮(NO)合酶联免疫吸附测定(ELISA)试剂盒购自上海研谨生物公司;IL-6、TNF-α (ELISA)试 剂 盒 (Beijing Cheng Lin Biological Technology);二氢乙锭( DHE,美国 AAT Bioquest公司);抗体TLR4,NF-κB购自沈阳万类生物科技公司;HRP标记II抗购自美国Earthox公司;β-actin购自美国SAB公司;ECL化学发光试剂购自沈阳万类生物科技公司。
1.4 仪器 TC2323型二氧化碳孵箱 (美国SheldonManufacturing公司),XD-101型倒置显微镜(日本Olympus公司),79-1型磁力加热搅拌器 (江苏金坛中大仪器厂),Leica DM1000型荧光显微镜(德国Leica公司),BS-124S型电子天平(德国赛多利斯天平有限公司),DNM-9602G型酶标分析仪(北京普朗新技术有限公司),流式细胞仪(美国伯乐),电泳仪、化学发光成像仪(Bio-Rad公司)。
1.5 方 法
1.5.1 细胞培养及分组 复苏HUVECs,培养在高糖DMEM培养基(含10%胎牛血清和1%抗生素),在37℃、5%CO2条件下培养,待细胞达到80%左右的融合度时,用0.25%胰蛋白酶消化并传代,取对数生长期细胞用于实验。实验分组:空白对照组(只给予培养基);模型组(培养基中加入1000 ng/ml脂多糖孵育24 h);花青素组 [培养基中分别先加入100,50,25(μg/ml)浓度的花青素孵育 12 h,再加入1000 ng/ml脂多糖孵育24 h]。
1.5.2 MTT法检测细胞活力 取对数生长期的HUVECs,0.25%胰蛋白酶消化,以 1×105个/ml为接种密度、每孔100 μl接种于96孔培养板中。按1.5.1的分组及给药方法培养后,倾去培养液,每孔加入新鲜培养液 90 μl,MTT 10 μl(5 g/L),继续培养4 h;然后弃上清,每孔加入100 μl DMSO,摇床震摇15 min,在酶标仪492 nm波长处测定吸光度值。根据每组细胞的OD值计算细胞活力。
1.5.3 DHE荧光探针检测HUVECs中ROS的变化获取对数生长期的HUVECs并以1×105个/孔容量接种于6孔板中。分组及给药同1.5.1,作用24 h后,弃去上清,用PBS洗3次,加入10 μmol/L的DHE,37℃孵育30 min,在荧光显微镜下观察。使用Imge-pro plus 6软件进一步分析生产结果。结果以相对荧光强度的单位表示。
1.5.4 ELISA法检测一氧化氮(NO)、TNF-α和IL-6的含量 收集各组细胞上清液,采用酶联免疫吸附(ELISA)法检测细胞上清液一氧化氮(NO)、TNF-α和IL-6的含量,将试剂盒置于室温平衡30 min,按照ELISA试剂盒说明进行操作,完毕后全自动酶标仪在450 nm读取A,绘制标准曲线,根据各标本A算出相应的浓度。
1.5.5 HUVECs抗氧化指标测定 收集各组细胞培养液上清,利用比色法按照试剂盒说明方法分别检测各组细胞中LDH、MDA、SOD、GSH-PX含量变化。
1.5.6 免疫印迹法测定蛋白表达 按照实验设计处理完各组细胞后,弃去上清,收集各组细胞,加入200 μl蛋白裂解液(含 1%PMSF),冰上反复吹打,4℃,12 000 g离心15 min,取上清,通过BCA法进行蛋白定量。制备12%分离胶,5%浓缩胶,SDSPAGE电泳,上样量为40 μg/20 μl。半干转转移至PVDF膜上。3%BSA 室温封闭 1.5 h。TLR4,NF-κB一抗(1∶1000),4 ℃孵育过夜,TBST 洗膜 3 遍,辣根过氧化物酶标记的二抗(1∶5000)室温孵育1.5 h,再次TBST洗膜3遍,ECL化学发光显影拍照,凝胶成像仪检测。
1.5.7 统计学分析 所有数据采用SPSS 17.0进行统计分析,计量资料采用(±s)表示。在方差齐性条件下多组间比较采用单因(One-wayANOVA)分析,多组间的两两比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 花青素对脂多糖(LPS)作用后HUVECs活力的影响 MTT检测发现,与空白对照组相比,模型组(脂多糖损伤组)活力显著降低(P<0.01);与模型组(脂多糖损伤组)相比,花青素组细胞活力随浓度梯度增高逐渐上升(P<0.01)。花青素浓度从 100 μg/ml至150 μmol/L对细胞活力无明显影响。实验结果说明花青素可以增强HUVECs的活力(表1)。
表1 花青素对细胞活力的影响(n=5,±s)

表1 花青素对细胞活力的影响(n=5,±s)
注:与脂多糖损伤组比较,*P<0.05,#P<0.01。
分组 细胞活力(%)空白组(对照组)99.5±5.6#脂多糖损伤组(模型组)51.3±3.1花青素组(25 μg/ml)63.4±3.8*花青素组(50 μg/ml)76.9±4.6#花青素组(100 μg/ml)88.5±5.1#花青素组(150 μg/ml)88.2±5.2
2.2 花青素对脂多糖(LPS)作用后HUVECs ROS的影响 DHE荧光探针检测显示,模型组(脂多糖损伤组)HUVECs产生大量ROS,明显高于空白对照组(P<0.01)。 而花青素组 ROS 含量逐渐降低(P<0.01)。实验表明,花青素可以在脂多糖(LPS)作用后减少HUVECs中ROS的产生(表2)。
2.3 花青素对脂多糖(LPS)作用后HUVECs功能因子和炎性因子的影响 ELISA方法检测花青素对脂多糖(LPS)作用后HUVECs培养上清液中NO、TNF-α和IL-6含量变化(表3)。检测发现,与对照组相比,模型组 (脂多糖损伤组)HUVECs上清中NO含量显著下降,TNF-α和IL-6含量显著上升(P<0.01);而不同浓度花青素组细胞上清液中NO含量随浓度梯度逐渐上升,TNF-α和IL-6含量逐渐下降,呈现一定的浓度依赖性保护作用(P<0.01)。
表2 花青素对细胞ROS的影响(n=5,±s)

表2 花青素对细胞ROS的影响(n=5,±s)
注:与脂多糖损伤组比较,*P<0.05,#P<0.01。
分组 ROS(MFI)空白组(对照组)52.6±6.7#脂多糖损伤组(模型组)223.8±29.4花青素组(25 μg/ml)165.3±24.1*花青素组(50 μg/ml)101.5±13.4#花青素组(100 μg/ml)74.7±5.8#
表3 花青素对细胞功能因子和炎性因子的影响(n=5,±s)

表3 花青素对细胞功能因子和炎性因子的影响(n=5,±s)
注:与脂多糖损伤组比较,*P<0.05,#P<0.01。
分组 NO(μmol/L) TNF-α(pg/ml) IL-6(pg/ml)空白组(对照组)87.5±8.3# 143.4±22.3# 53.5±13.7#脂多糖损伤组(模型组)35.3±14.6 377.9±25.4 164.1±23.2花青素组(25 μg/ml)51.7±13.2* 338.6±31.5* 143.7±20.5*花青素组(50 μg/ml)62.3±7.1# 272.8±37.1# 104.3±16.1#花青素组(100 μg/ml)75.2±12.1# 196.1±19.8# 71.2±9.7#
2.4 花青素对脂多糖 (LPS)作用后HUVECs LDH、MDA、SOD和GSH-PX的影响 经检测发现(表4),与空白对照组相比,脂多糖损伤组LDH、MDA含量显著增加,SOD、GSH-PX活性显著下降(P<0.01);当不同浓度花青素作用于脂多糖氧化损伤后的HUVECs时,各组LDH、MDA含量逐渐下降,SOD、GSH-PX 活性逐渐上升(P<0.01)。
2.5 花青素对脂多糖(LPS)作用后TLR4,NF-κB蛋白表达的影响 Western blot分析显示,模型组HUVECs细胞中 TLR4,NF-κB蛋白的表达明显高于空白对照组,而不同浓度的花青素组中以上2种蛋白表达逐渐降低(P<0.01,表 5)。 因此,花青素对内皮细胞保护作用与TLR4/NF-κB通路密切相关。
3 讨 论
脂多糖是革兰阴性杆菌细胞壁的主要成分,通过脂多糖结合蛋白(LBP)运送后,与各类细胞质膜上的CD14结合,CD14与LPS-LBP复合体结合后,通过Toll样受体4(TLR4)激活NF-κB信号通路。信号级联反应致使炎症细胞因子如IL-6和TNF-α的释放[4]。
表4 花青素对细胞LDH、MDA、SOD和GSH-PX的影响(n=5,±s)

表4 花青素对细胞LDH、MDA、SOD和GSH-PX的影响(n=5,±s)
注:与脂多糖损伤组比较,*P<0.05,#P<0.01。
分组 LDH(U/L)MDA(nmol/mg)SOD(U/mg)GSH-PX(U/mg)空白组(对照组)233.5±44.7# 2.14±0.23# 35.8±2.7# 126.8±18.4#脂多糖损伤组(模型组)914.6±123.9 4.43±0.29 14.3±1.6 60.7±13.1花青素组(25 μg/ml)731.8±145.1* 3.65±0.48* 19.8±3.1* 82.4±16.7*花青素组(50 μg/ml)583.2±162.3# 2.82±0.22# 24.7±4.5# 104.9±13.9#花青素组(100 μg/ml)314.5±208.5# 2.41±0.25# 30.4±1.9# 60.4±14.6#
表5 花青素对细胞TLR4,NF-κB蛋白表达的影响(n=5,±s)
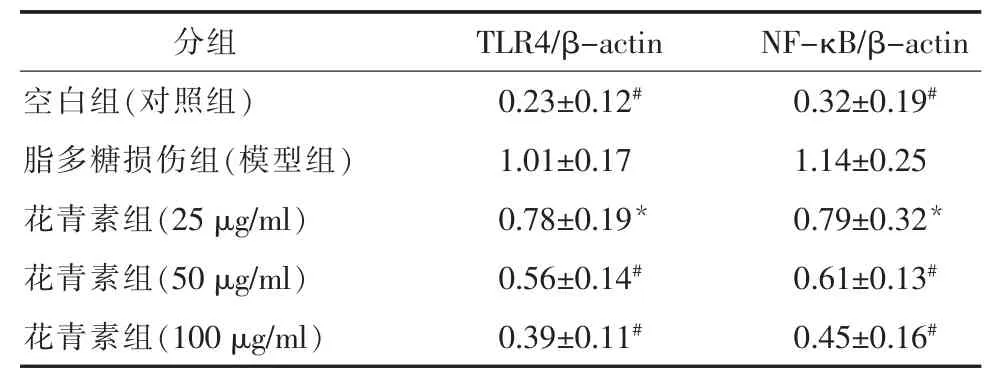
表5 花青素对细胞TLR4,NF-κB蛋白表达的影响(n=5,±s)
注:与脂多糖损伤组比较,*P<0.05,#P<0.01。
分组 TLR4/β-actin NF-κB/β-actin空白组(对照组)0.23±0.12# 0.32±0.19#脂多糖损伤组(模型组)1.01±0.17 1.14±0.25花青素组(25 μg/ml)0.78±0.19* 0.79±0.32*花青素组(50 μg/ml)0.56±0.14# 0.61±0.13#花青素组(100 μg/ml)0.39±0.11# 0.45±0.16#
炎症部位的血管内皮细胞既是炎症过程的参与者,也是炎症过程的调节者[5]。长期或者反复的暴露于心血管危险因素,将会导致内源性抗炎系统内皮细胞的损伤。最终内皮不仅丧失功能,而且也会失去其完整性,进一步的衰老而脱落至循环系统。因此,修复损伤的内皮细胞,对改善血管的功能起着至关重要的作用[6]。
ROS 是指 O-2、脂多糖(LPS)等活性氧簇,大量ROS能够促进氧化应激诱导内皮细胞损伤及凋亡[7]。该实验中,脂多糖(LPS)能够诱导HUVECs产生过量ROS,直接影响细胞存活和功能;而花青素组能明显降低ROS的产生发挥保护内皮细胞作用。许多实验研究和临床研究表明,氧化应激与动脉粥样硬化高危因素(如高血压,高脂血症,糖尿病,吸烟等)引起的内皮细胞异常密切相关[8]。 LDH,MDA,SOD和GSH-PX可以反映HUVECs的抗氧化能力。氧化损伤后细胞膜的完整性可以通过LDH释放量来反映。同时,作为脂质过氧化的最终产物,MDA可以反映人体氧自由基的代谢和自由基攻击细胞的损伤程度。该实验中,模型组LDH和MDA升高,而不同浓度的花青素组LDH和MDA含量逐渐下降。证明花青素可以维持HUVECs细胞的完整性,减少氧化损伤。SOD和GSH-PX作为抗氧化酶能够拮抗氧化应激引起的细胞损伤,修复受损细胞,其活性可以反映机体的抗氧化能力。该实验中,模型组SOD和GSH-PX活性下降,而花青素组HUVECs的SOD和GSH-PX活性显著增加,说明花青素有助于恢复模型组的抗氧化能力血管内皮细胞。该实验中,模型组HUVECs活力明显下降,而花青素组能明显提升了HUVECs活力。炎症因子IL-6,TNF-α在动脉粥样硬化起始环节起着重要作用[1,9],该实验中模型组IL-6,TNF-α含量明显上升,而花青素组明显降低了IL-6,TNF-α含量,说明花青素具有明显抗炎作用而发挥对内皮细胞的保护。NO是血管内皮细胞释放的重要舒血管物质,能够直接反映内皮细胞分泌功能的强弱[10]。该实验中模型组NO含量明显下降,提示内皮细胞分泌功能减弱,而花青素组明显增加了NO含量,提示花青素恢复了脂多糖(LPS)损伤HUVEC正常分泌功能。
综上所述,脂多糖(LPS)可导致HUVECs损伤,而花青素对内皮细胞具有直接保护作用,减少ROS导致的氧化应激和炎症反应,恢复HUVECs正常分泌功能,且部分可能通过抑制TLR4/NF-κB信号通路发挥作用。深入研究内皮细胞炎症与动脉粥样硬化病理过程的关系及其具体分子机制,将有助于理解和完善动脉粥样硬化的发病机制,将内皮细胞炎症作为治疗靶点,干预炎症的信号途径,为研发新药物和基因治疗提供理论基础。
