茎瘤芥饼粕中硫苷的酶解条件优化
2019-01-19张燕张欣欣
张燕 张欣欣

摘要:用硫脲比色法、紫外分光光度法测定茎瘤芥饼粕中异硫氰酸酯的生成量,并以此为评价指标,设计单因素试验和正交试验,研究茎瘤芥(俗称榨菜)饼粕中的硫苷在外源黑芥子酶催化作用下生成异硫氰酸酯的影响因素,从而确定硫苷酶解的最佳条件。单因素试验探究不同料液比(1 g ∶ 10 mL、1 g ∶ 15 mL、1 g ∶ 20 mL、1 g ∶ 25 mL、1 g ∶ 30 mL)、酶解时间(0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0 h)、温度(30、40、50、60、70、80 ℃)及pH值(2、3、4、5、6、7、8、9)对异硫氰酸酯生成量的影响。根据单因素试验的结果,选取对饼粕中异硫氰酸酯生成量影响较为显著的料液比、酶解温度、时间及pH值进行正交试验设计,对硫苷的酶解条件进行优化。正交试验结果表明,硫苷酶解的最适条件如下:酶解时间为1.0 h、反应温度为60 ℃、反应体系pH值为6、料液比为1 g ∶ 15 mL,在该条件下,异硫氰酸酯的生成量达到最大值,为1.485 mg/g。通过研究,确定了茎瘤芥饼粕中硫苷酶解的最佳条件,从而为人类研发出更具有经济价值和功能价值的产品提供了数据参考,提高了茎瘤芥的综合利用效率。
关键词:茎瘤芥;硫苷;异硫氰酸酯;酶解条件
中图分类号: S188+.3 文献标志码: A 文章编号:1002-1302(2019)22-0238-05
硫代葡萄糖苷(简称硫苷)是十字花科蔬菜中一类重要的含硫次级代谢产物。近年来的研究表明,十字花科植物对癌症有一定的疗效,并且发现这种抗癌物质是硫苷的降解产物或其相关的衍生物,其中最主要的是异硫氰酸酯(ITC)。异硫氰酸酯可以形成辛辣的风味,如芥菜的特殊辛辣味与烯丙基异硫氰酸盐有关[1]。同时研究表明,硫苷的降解产物异硫氰酸酯还可以抑制细菌的生长,其原因主要是异硫氰酸酯可以使细菌的细胞膜通透性改变[2]。由于异硫氰酸酯具有多种生物学活性,因此若能将其成功地应用于医学上癌症的治疗以及食品的加工和贮藏,将对人类具有积极的影响。目前,全世界死于癌症的人数不断增加,癌症已经成为全世界科学家重点攻克的对象,而异硫氰酸酯具有抗癌的生物活性,这对人类攻克癌症、延长寿命找到了1个可行的切入点。同时,在食品的加工上,异硫氰酸酯可以形成辛辣的风味,使食品的味道更加鲜美。在贮藏上,异硫氰酸酯的抑菌作用,使食品的保质期延长,贮藏的时间更久。这些都对人类的生活产生了巨大的经济效益。茎瘤芥(俗称榨菜)是属于十字花科的芸薹属植物,研究发现,硫苷在芸薹属植物中的含量是最丰富的,因而根据区域特色作物来探究硫苷的酶解条件并进行优化,将更有利于地方经济的发展,并可为药物的开发提供数据参考。
1 硫苷及其降解产物的研究现状
硫苷在植物细胞中主要以离子的形式存在,尚毅等总结了硫代葡萄糖苷的研究进展,结果显示,硫苷的结构由3个部分构成:硫代糖苷键、磺酸根和侧链基团[3]。目前已经发现,在植物中含有120多种硫苷[4],这些硫苷在结构组成上存在的差异主要是由于侧链R基团的不同。根据侧链R基团结构的不同,可以把硫苷分为以下3大类:含有直链或支链烷基的脂肪族硫苷、含有苯环的芳香族硫苷以及含有吲哚环的吲哚族硫苷。其中异亮氨酸、甲硫氨酸主要构成脂肪族硫苷的侧链,酪氨酸、苯丙氨酸主要构成芳香族硫苷的侧链,而色氨酸构成吲哚族硫苷的侧链[5]。程坤等研究发现,硫苷在十字花科植物中的种类与含量占显著优势,其含有硫苷的种类占目前已经发现的120多种硫苷的绝大部分,而在植物的其他科、属中只发现含有1种或其中几种硫苷,所含硫苷种类的数量远不及十字花科植物的多[6]。硫苷广泛分布在植物的根、茎、叶和种子等部位,但是在种子中硫苷的含量是最高的[7]。王科研究发现,在十字花科植物的种子中含有的硫苷量可高达植物干质量的10%;而在其他部位中,硫苷的含量仅占植物干质量的1%左右[8]。硫苷的种类及其相应的组分含量在不同植物中具有显著的差异,当植物处于不同的地理环境或在不同的生物阶段中,就算是同一种植物的不同品种,各品种间所含有的硫苷种类和组分含量各不相同[9]。例如,在西兰花中的硫苷主要是4-甲基亚磺酰酸基丁基硫苷、3-烯丁基硫苷和3-吲哚甲基硫苷;而在白菜中的硫苷则以2-烯丙基硫苷、3-吲哚甲基硫苷为主[10]。修丽丽等对西兰花的嫩芽进行检测发现,4-甲基亚磺酰酸基丁基硫苷的含量是植株成熟时的100倍[11]。硫苷在黑芥子酶的催化作用下会发生相应的酶解反应,黑芥子酶是水解硫苷的专一酶,它是一种二聚体蛋白质,其相对分子质量在59~75 ku[12]之间。在植物细胞中,硫苷并不是独立存在的,而是以硫苷-黑芥子酶这种体系的形式存在的[13]。在植物未受到损伤的状态下,细胞中的硫苷、黑芥子酶是相互分隔开的,它们之间有1道天然的屏障。硫苷存在于植物细胞的液泡中[14],液泡具有1层生物膜,这层液泡膜将形成硫苷与黑芥子酶之间的生物屏障。在正常情况下,硫苷与黑芥子酶并不会互相接触而发生酶解反应,只有当植物细胞受到损伤或破坏时,硫苷與黑芥子酶之间的液泡膜屏障被破坏,才会相互聚集到一起,从而在酶的作用下发生催化反应,产生一系列的代谢产物,例如,生成1个糖苷配基以及1分子葡萄糖[15]。其中糖苷配基非常不稳定,会自发排列重新组合生成不同的降解产物。得到的降解产物不仅与硫苷的结构组成有关,而且与反应条件有关。当反应体系的pH值为中性时,糖苷配基会通过重新排列生成较稳定的,并且具有生物活性的异硫氰酸酯;当反应体系的pH值为酸性时,糖苷配基发生脱硫反应,从而得到腈类化合物;当反应体系的pH值为碱性时,糖苷配基将重新排列生成硫代氰酸盐[16]。近年关于硫苷降解产物的研究发现,其产物具有多种医用价值和药用价值,尤其是硫苷的酶解产物异硫氰酸酯具有抗癌作用。申树芳等的研究表明,异硫氰酸酯的抗癌机制主要是异硫氰酸酯可以使谷胱甘肽转硫酶、UDP(尿苷二磷酸)-葡萄糖醛酸转移酶的活性提高[17]。UDP-葡萄糖醛酸可与药物或者与含有羟基、羧基、氨基、硫基等的有害化学物质结合,生成可溶于水的化合物,并随着尿液排出,使机体中对基因损伤的化学物质减少,因此降低了基因的突变率。鲍英慧对油菜籽饼粕中异硫氰酸酯的测定方法[18],为本研究中异硫氰酸酯的测定提供了参考。
2 本研究的创新点
本研究的试验材料是茎瘤芥杂交种涪杂2号的种子,涪杂2号是重庆市涪陵区的特色作物,该地区拥有丰富的榨菜资源和天然的地理条件。目前,大部分研究者对西兰花、油菜、芥菜中硫苷及硫苷酶的研究较多,同时选取的材料大多是植物的根、茎、叶等组织,对种子中硫苷的酶解条件优化研究较少。
3 材料与方法
3.1 材料
本研究所用材料为由涪陵茎瘤芥(榨菜)研究所研制的茎瘤芥杂交种涪杂2号的种子。
3.2 试剂
主要试剂为丙酮、柠檬酸、磷酸氢二钠、80%氨乙醇(量取20 mL氨水与80 mL无水乙醇后充分混匀)。pH值为7.0的磷酸盐-柠檬酸缓冲溶液。二氯甲烷、氨水、无水乙醇,购自重庆真真化工有限公司。
3.3 主要仪器与设备
JJ-2B型电动高速捣碎机,江苏省金坛市荣华仪器制造有限公司;QL-901涡旋混合器,江苏省海门市麒麟医用仪器厂;CS101-2EBN电热鼓风干燥箱,重庆市恒达仪器厂;离心机,湖南凯达科學仪器有限公司;恒温水浴锅,江苏荣华仪器制造有限公司;紫外分光光度计,上海美谱达仪器有限公司。
3.4 试验方法
3.4.1 茎瘤芥籽饼粕的提取 将涪杂2号种子(48 h内的发芽率必须大于85%,且保存期不超过1年)粉碎后,称取适量榨菜籽饼粕,过60目筛,留下筛出的部分,并在50 ℃电热鼓风干燥箱中干燥,干燥后存放于干燥器中,备用。
3.4.2 黑芥子酶的粗制酶粉提取 按文献[19]描述的方法提取黑芥子酶的粗制酶粉。(1)将涪杂2号种子(48 h内的发芽率必须大于85%,且保存期不超过1年)经电动高速捣碎机粉碎,粉碎得越细越好,可以经过多次粉碎。(2)称取100 g粉碎过的榨菜籽,每次用30 mL丙酮进行脱脂处理,一共进行10次脱脂处理,共耗用300 mL丙酮。(3)用滤纸过滤,留取过滤在烧杯中的脱脂榨菜籽粉,在电热鼓风干燥箱中干燥。干燥过后,用400 mL蒸馏水分2次来提取脱脂粉中的黑芥子酶。(4)再进行离心,取上层混悬液体,在混悬液中加入 400 mL 丙酮将黑芥子酶沉淀出来,然后将上清液弃去,留下沉淀。之后再用丙酮洗涤沉淀,共洗涤5次。(5)将洗涤好的沉淀进行离心,弃去上清液,留下层的沉淀物,将沉淀物在电热鼓风干燥箱内进行干燥,待干燥过后,将其研磨成粉末,装入密封的干燥瓶中,保存在4 ℃冰箱中备用。
3.4.3 硫苷酶解生成异硫氰酸酯含量的测定 准确称取 0.200 g 榨菜籽饼粕于试管中,向试管中加入40 mg粗黑芥子酶、2.0 mL pH值为7.0的缓冲液。将试管放在涡旋混合器上,使试管中的反应物充分混合。将反应物放在不同的酶解条件下,酶促反应2 h。待酶解过后向试管中加入2.5 mL二氯甲烷,再用涡旋混合器进行充分混匀,混匀后将试管放在室温下振荡,频率为40 kHz,时间为1 h。之后再用涡旋混合器将试管中的水相、有机相、样品进行充分混合,将混匀后的样液装入待离心的试管中,在离心机中于4 000 r/min离心 20 min。取具塞试管,向试管中加入6 mL 80%氨已醇。用移液枪取离心管下层的有机相样液50 μL,将其加入盛装80%氨已醇的试管中,盖上塞子。用涡旋混合器将试管中的液体混合均匀,再将试管放入50 ℃水浴锅中,加热0.5 h,取出试管,待其冷却至室温。最后用紫外分光光度计测定其吸光度(波长为245 nm)。每个试样需要平行测定3次,求出其算术平均值。
3.5 单因素酶解条件的确定
准确称取0.200 g榨菜籽饼粕,向其中加入40 mg外源黑芥子酶。研究不同料液比(1 g ∶ 10 mL、1 g ∶ 15 mL、1 g ∶ 20 mL、1 g ∶ 25 mL、1 g ∶ 30 mL)、时间(0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0 h)、温度(30、40、50、60、70、80 ℃)、pH值(2、3、4、5、6、7、8、9)对异硫氰酸酯生成量的影响。
3.6 正交设计试验的确定
茎瘤芥饼粕中的硫苷会在黑芥子酶的作用下降解生成异硫氰酸酯。根据单因素试验结果,选择对异硫氰酸酯生成量相对影响较高的3个水平进行正交试验设计(表1),以此来对茎瘤芥饼粕中硫苷的酶解条件进行优化。
3.7 异硫氰酸酯含量的计算公式
本试验用李培武等的测定油菜饼粕中异硫氰酸酯的硫脲比色法[20]来计算异硫氰酸酯的含量,相关公式如下:
c=D245 nm-D235 nm+D255 nm2×28.55。
式中:c为异硫氰酸酯的含量。
4 结果与分析
4.1 单因素试验的结果与分析
4.1.1 不同料液比对异硫氰酸酯生成量的影响 由图1可以看出,料液比对异硫氰酸酯生成量的影响趋势如下:随着料液比增加,异硫氰酸酯的生成量先增加,当异硫氰酸酯的生成量达到最大值时,此时的料液比为1 g ∶ 15 mL,在添加外源黑芥子酶的条件下,测得异硫氰酸酯的生成量为0.83 mg/g;随着料液比的不断提高,异硫氰酸酯的生成量降低并逐渐趋于平稳,料液比为1 g ∶ 25 mL、1 g ∶ 30 mL时的异硫氰酸酯生成量分别为0.66、0.64 mg/g。由于硫苷的生物降解需要水分子的参与,当料液比较低时,硫苷在磷酸盐-柠檬酸缓冲液中溶解的量较少,导致硫苷酶解生成异硫氰酸酯的量也很小。之后,随着料液比的增加,硫苷在缓冲液中的溶解量达到最大值,于是硫苷降解生成异硫氰酸酯的量最高。最后,由于反应体系中添加的黑芥子酶量有限,随着料液比的提高,异硫氰酸酯的生成量并不会随之提高,逐渐趋向于平稳。
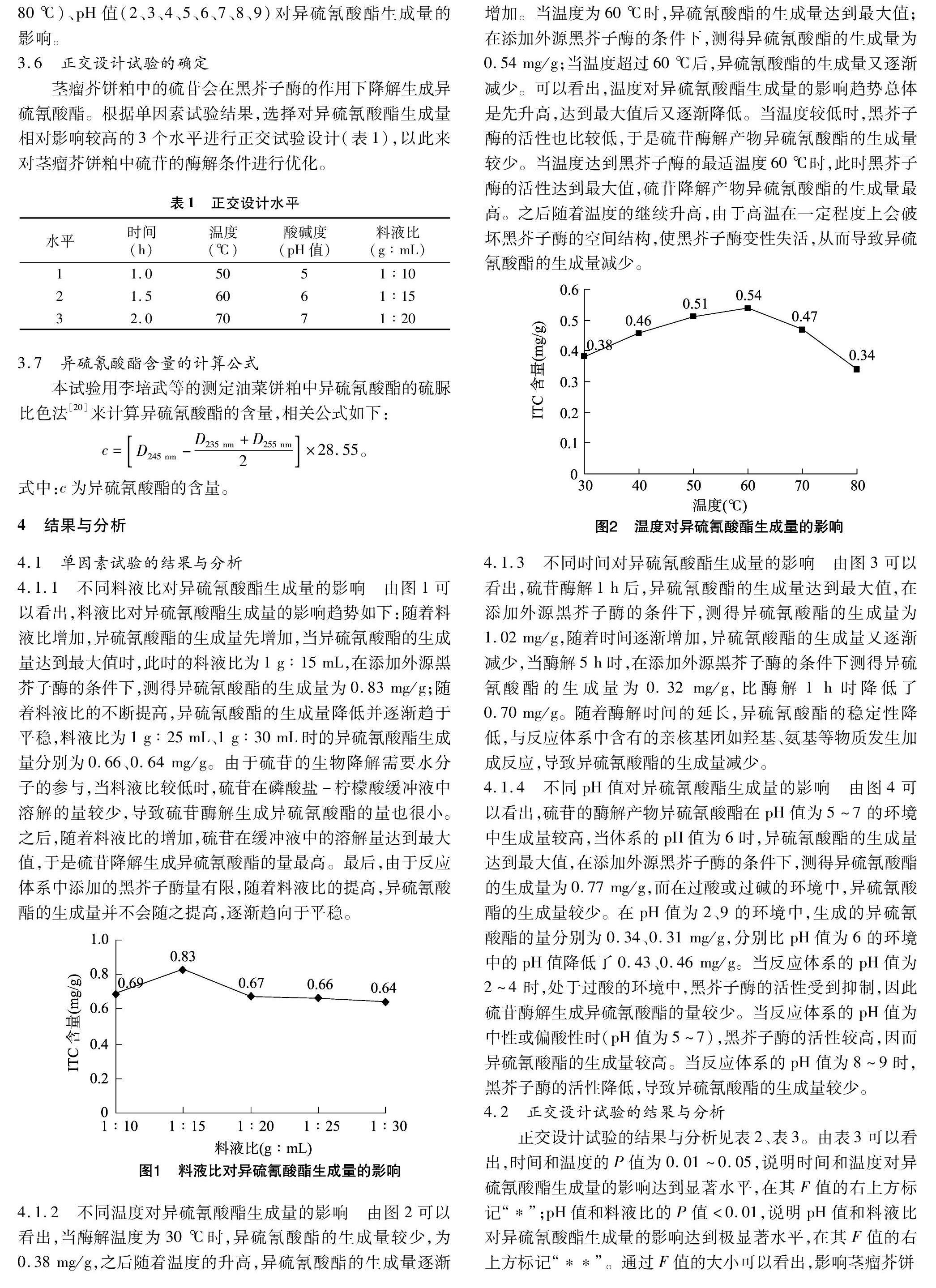
4.1.2 不同温度对异硫氰酸酯生成量的影响 由图2可以看出,当酶解温度为30 ℃时,异硫氰酸酯的生成量较少,为0.38 mg/g,之后随着温度的升高,异硫氰酸酯的生成量逐渐增加。当温度为60 ℃时,异硫氰酸酯的生成量达到最大值;在添加外源黑芥子酶的条件下,测得异硫氰酸酯的生成量为0.54 mg/g;当温度超过60 ℃后,异硫氰酸酯的生成量又逐渐减少。可以看出,温度对异硫氰酸酯生成量的影响趋势总体是先升高,达到最大值后又逐渐降低。当温度较低时,黑芥子酶的活性也比较低,于是硫苷酶解产物异硫氰酸酯的生成量较少。当温度达到黑芥子酶的最适温度60 ℃时,此时黑芥子酶的活性达到最大值,硫苷降解产物异硫氰酸酯的生成量最高。之后随着温度的继续升高,由于高温在一定程度上会破坏黑芥子酶的空间结构,使黑芥子酶变性失活,从而导致异硫氰酸酯的生成量减少。
4.1.3 不同时间对异硫氰酸酯生成量的影响 由图3可以看出,硫苷酶解1 h后,异硫氰酸酯的生成量达到最大值,在添加外源黑芥子酶的条件下,测得异硫氰酸酯的生成量为 1.02 mg/g,随着时间逐渐增加,异硫氰酸酯的生成量又逐渐减少,当酶解5 h时,在添加外源黑芥子酶的条件下测得异硫氰酸酯的生成量为0.32 mg/g,比酶解1 h时降低了 0.70 mg/g。随着酶解时间的延长,异硫氰酸酯的稳定性降低,与反应体系中含有的亲核基团如羟基、氨基等物质发生加成反应,导致异硫氰酸酯的生成量减少。
4.1.4 不同pH值对异硫氰酸酯生成量的影响 由图4可以看出,硫苷的酶解产物异硫氰酸酯在pH值为5~7的环境中生成量较高,当体系的pH值为6时,异硫氰酸酯的生成量达到最大值,在添加外源黑芥子酶的条件下,测得异硫氰酸酯的生成量为0.77 mg/g,而在过酸或过碱的环境中,异硫氰酸酯的生成量较少。在pH值为2、9的环境中,生成的异硫氰酸酯的量分別为0.34、0.31 mg/g,分别比pH值为6的环境中的pH值降低了0.43、0.46 mg/g。当反应体系的pH值为 2~4 时,处于过酸的环境中,黑芥子酶的活性受到抑制,因此硫苷酶解生成异硫氰酸酯的量较少。当反应体系的pH值为中性或偏酸性时(pH值为5~7),黑芥子酶的活性较高,因而异硫氰酸酯的生成量较高。当反应体系的pH值为8~9时,黑芥子酶的活性降低,导致异硫氰酸酯的生成量较少。
4.2 正交设计试验的结果与分析
正交设计试验的结果与分析见表2、表3。由表3可以看出,时间和温度的P值为0.01~0.05,说明时间和温度对异硫氰酸酯生成量的影响达到显著水平,在其F值的右上方标记“*”;pH值和料液比的P值<0.01,说明pH值和料液比对异硫氰酸酯生成量的影响达到极显著水平,在其F值的右上方标记“**”。通过F值的大小可以看出,影响茎瘤芥饼粕中硫苷酶解的因素主次排序是料液比(D)>pH值(C)>时间(A)>温度(B)。由表2可以看出,A1B2C3D2为硫苷酶解的最佳组合,但是在正交设计组合中并没有这一组合。在单因素试验中,异硫氰酸酯的生成量在C2条件下(pH值为6)比C3条件下(pH值为7)的高。因此结合单因素及正交设计试验的结果,得出A1B2C2D2这一组合为硫苷酶解的最佳组合。进一步得出茎瘤芥饼粕中硫苷的最佳酶解条件如下:时间为1 h,温度为60 ℃,pH值为6,料液比为1 g ∶ 15 mL。在添加外源黑芥子酶的条件下,测得异硫氰酸酯的生成量为1.485 mg/g。
5 讨论
茎瘤芥饼粕中硫苷的生物降解主要依靠黑芥子酶,同时适当的缓冲液会使黑芥子酶在缓冲液中的活性提高。张蕾等研究者在提取西兰花籽中的黑芥子酶时,得出在Tris-HCl缓冲液中,黑芥子酶的活性比在蒸馏水和其他缓冲液中的都高,其次是在磷酸盐-柠檬酸缓冲液中的活性,但是在蒸馏水中黑芥子酶活性是最低的[21]。该研究结果对本试验选取适当的缓冲液奠定了基础。赵振东在海南芥子中硫苷及其酶解产物的提取分离与鉴定中,发现Tris中含有的氨基会与硫苷的酶解产物异硫氰酸酯发生相应的加成反应[22]。这对本试验最终测定异硫氰酸酯的生成量有影响,于是本研究选取磷酸盐-柠檬酸缓冲液作为研究的缓冲液。刘哲等对萝卜硫苷合成和调节相关基因的研究表明,硫代葡萄糖苷属于阴离子亲水性类物质,因此硫苷发生生物降解需要在有水分子的环境中[23]。丁艳等在油菜籽饼粕中硫苷的酶解条件优化及降解产物分析中发现,料液比对异硫氰酸酯生成量影响的总体趋势如下:先升高,当料液比为1 g ∶ 15 mL时,异硫氰酸酯的生成量达到最大值,之后下降,最后趋向于平稳[13],这与本研究结果基本相符合。刘月萍在黑芥子酶提取分离、性质及固定化的研究中发现,使硫苷发生降解的专一黑芥子酶,其对温度的稳定性可以达到65 ℃[24]。在本研究中,当温度为60 ℃时,黑芥子酶的活性最高,本研究中黑芥子酶的最适温度在其稳定的区间内。张清峰在辣根中生物活性成分——异硫氰酸酯的研究中发现,当温度偏高时,异硫氰酸酯的稳定性会降低,同时会与溶液中存在的OH-发生反应,导致实际测得的异硫氰酸酯量减少[25]。在本研究中,当温度为 80 ℃ 时,异硫氰酸酯的实际量显著较低,与张清峰的研究结论基本相符。在酶解时间方面,随着酶解时间延长,异硫氰酸酯的稳定性下降,反应体系中含有的亲核基团如氨基、羟基等物质发生加成反应,导致异硫氰酸酯的生成量减少,这与丁艳等得出的时间对异硫氰酸酯的影响规律[13]基本相符。在硫苷酶解的最适pH值方面,本研究得出的结论和其他学者的研究结论有一定的差异。苏光耀等在西兰花籽中硫代葡萄糖苷酶解条件的研究中发现,当反应体系的pH值为4.0时,在西兰花籽中硫苷酶解生成异硫氰酸酯的量是最高的[26]。陈红霞在辣根中异硫氰酸酯的制备和活性研究中发现,当反应体系的pH值为7.0时,在辣根中硫苷酶解生成异硫氰酸酯的量达到最大值[27]。在本研究中得出茎瘤芥饼粕中硫苷酶解的最佳pH值为6,此时生成的异硫氰酸酯的量最高。分析其主要原因,是研究的材料不同,本研究的材料是重庆市涪陵区的特色区域作物茎瘤芥杂交种的涪杂2号,同时是以涪杂2号的种子为原料。研究发现,材料取自不同的植物,甚至植物的不同组织部位时,黑芥子酶的活性都存在一定差异。因此本研究与其他学者的研究得出的最适pH值有所不同是符合植物生理规律的。但是本研究得出,茎瘤芥饼粕中硫苷酶解的最适pH值为6,与郭强晖在西兰花芽苗异硫氰酸酯富集与调控技术中研究发现的黑芥子酶的活性在pH值为5~8的区间内较高这一总体规律是基本相符的[28]。
6 结论
本研究得出茎瘤芥饼粕中硫苷的最佳酶解条件如下:时间为1 h,温度为 60 ℃,pH值为6,料液比为1 g ∶ 15 mL。在添加外源黑芥子酶的条件下,测得异硫氰酸酯的生成量为1.485 mg/g。本研究确定了茎瘤芥饼粕中硫苷的最佳酶解条件,为研发出更具有经济价值和功能价值的产品提供了数据参考,提高了茎瘤芥的综合利用效率。
参考文献:
[1]肖华志. 食用辛辣风味物质异硫氰酸烯丙酯(AITC)的研究[D]. 北京:中国农业大学,2004:10-100.
[2]陈兰英,毕明芳,余 倩,等. 异硫氰酸酯的分析方法[J]. 化学世界,2014,55(5):307-310.
[3]尚 毅,田建华,李殿荣. 硫代葡萄糖苷的研究进展[C]//食物与能源安全战略中的中国油料——中国作物学会油料作物专业委员会第五届学术年会论文集. 上海,2004:668-679.
[4]翟志亭. 氨基酸对甘蓝硫代葡萄糖苷组分及含量的影响[D]. 南京:南京农业大学,2008:6-76.
[5]梁 浩,李瑞敏,袁其朋. 天然活性异硫氰酸酯类化合物的研究进展[J]. 北京化工大学学报(自然科学版),2015,42(2):1-12.
[6]程 坤,杨丽梅,方智远,等. 十字花科植物中主要硫代葡萄糖苷合成与调节基因的研究进展[J]. 中国蔬菜,2010,1(12):1-6.
[7]周政子. 萝卜籽中硫代葡萄糖苷的提取纯化及其降解产物的抑菌特性研究[D]. 杭州:浙江工商大学,2013:3-79.
[8]王 科. 基于低速逆流色谱法的萝卜籽中硫代葡萄糖苷的制各分离[D]. 杭州:浙江工商大学,2008:3-76.
[9]邱海荣. 不同品种青花菜和花椰菜硫代葡萄糖苷含量的测定及比较[D]. 南京:南京农业大学,2008:7-64.
[10]李 鲜,陈昆松,张明方,等. 十字花科植物中硫代葡萄糖苷的研究进展[J]. 园艺学报,2006,33(3):675-679.
[11]修丽丽,钮昆亮. 十字花科植物中的硫代葡萄糖苷及其降解产物[J]. 浙江科技学院学报,2004,16(3):187-189,211.
[12]朱 磊. 十字花科植物种子黑芥子酶酶学性质研究[D]. 北京:北京化工大学,2011:6-87.
[13]丁 艳,李丽倩,曹 蓉,等. 油菜籽饼粕中硫苷的酶解条件优化及降解产物分析[J]. 中国农业科学,2014,47(2):383-393.
[14]阮 颖,周朴华,刘春林. 植物硫代葡萄糖苷-黑芥子酶底物酶系统[J]. 湖南农业大学学报(自然科学版),2007,33(1):18-23,78.
[15]劉 楠. 黑胡萝卜色素的提取纯化及其结构分析[D]. 天津:天津科技大学,2007:4-74.
[16]李 雷,邹 翔,季宇彬. 十字花科植物中异硫氰酸盐的性质及活性研究[J]. 哈尔滨商业大学学报(自然科学版),2007,23(4):385-389,399.
[17]申树芳,张英锋,马子川. 西兰花中硫代葡萄糖苷的抗癌药理[J]. 化学教学,2009,2(7):64-65.
[18]鲍英慧. 比色法测定菜籽饼粕中异硫氰酸酯[J]. 中国饲料,1999(24):13.
[19]汪 儆,雷祖玉,冯学勤,等. 饲料中异硫氰酸酯的测定方法:GB 13087—1991[S]. 北京:中国标准出版社,1991.
[20]李培武,张 文,丁小霞,等. 油菜饼粕中异硫氰酸酯的测定硫脲比色法:NY/T 1596—2008[S]. 2008.
[21]张 蕾,庞秋颖,王 洋. 黑芥子酶提取及活性测定方法的改进[J]. 东北师大学报(自然科学版),2011,43(1):118-121.
[22]赵振东. 海南芥子中硫苷及其酶解产物的提取分离与鉴定[D]. 海口:海南大学,2013:4-77.
[23]刘 哲,张秋萍,苏小俊,等. 萝卜硫苷合成和调节相关基因研究进展[J]. 江苏农业科学,2015,43(6):168-170.
[24]刘月萍. 黑芥子酶提取分离、性质及固定化研究[D]. 杭州:浙江工商大学,2007:3-74.
[25]张清峰. 辣根中生物活性成分——异硫氰酸酯的研究[D]. 天津:天津商业大学,2007:4-97.
[26]苏光耀,沈莲清,王向阳,等. 西兰花籽中硫代葡萄糖苷酶解条件的研究[J]. 中国粮油学报,2008,23(2):178-182.
[27]陈虹霞. 辣根中异硫氰酸酯的制备和活性研究[D]. 北京:中国林业科学研究院,2009:5-106.
[28]郭强晖. 西兰花芽苗异硫氰酸酯富集与调控技术研究[D]. 南京:南京农业大学,2014:7-77.
