银杏林土壤放线菌分离鉴定及对植物病原菌的拮抗作用研究
2019-01-19高嫚妮潘忠成高波杨宏勃陈豪翁婧李蒲民
高嫚妮 潘忠成 高波 杨宏勃 陈豪 翁婧 李蒲民

摘 要:
从银杏树林土壤中分离放线菌,并用生长速率法测得其对植物病原菌具有拮抗活性,且抑制率达到80.00%以上。杯碟法测量结果表明菌株MKLFXJ-I发酵液对9种植物病原菌均具有抑菌活性。通过菌种培养形态、细胞形态、生理生化特征和16S rRNA基因序列分析,初步鉴定菌株MKLFXJ-I为链霉菌Streptomyces sp.。
关键词:
放线菌;拮抗作用;生长速率法;鉴定
中图分类号:S-3
文献标识码:A
DOI:10.19754/j.nyyjs.20191230003
化学农药制剂长期大量使用促使植物病原菌产生抗药性的问题已越来越严重,同时化学药剂会给生态平衡带来严重的不良影响,因此开发高效、低毒、绿色的生物农药产品迫在眉睫。近几年来,利用微生物资源开发生物药剂防治病害成为当今研究的热点[1],放线菌因分布广泛、种类多样,可产生结构丰富的具有抗菌活性的物质,且易降解,环境相容性好,使其在微生物农药开发中占据首要位置[2]。放线菌用于植物病害的防治已有很多报道[3,4],其中以链霉菌的研究最为广泛和深入,也最具有生防利用价值。Umezawa H[5]等从日本奈良县春日神社境内发现的春日链霉菌,经研究其代谢产物,开发出了春雷霉素,广泛应用于水稻稻瘟病、黄瓜枯萎病、大白菜黑腐病等多种病害的防治。后来,沈寅初[6]从江西土良地区也分离到了1株春雷霉素产生菌,命名为小金色链霉菌。中国医学科学院医药生物技术研究所从海南地区土壤中分离到1株链霉菌,后续由中国农业科学院微生物防治研究所将其开发成一种生物农药-中生菌素,通过多年田间试验表明,该抗生素对水稻白叶枯病、大白菜软腐病、苹果轮纹病和苹果早期落叶病等具有良好的防治效果[7,8]。本研究针对从银杏林土壤中分离得到的放线菌MKLFXJ-I,测定了该菌对植物病原菌拮抗活性及其代谢物的抗菌活性,并对其进行鉴定,以期能获得结构新颖、活性显著的先导化合物,为开发新型生物农药奠定基础。
1 材料
植物病原:苹果轮纹病菌、苹果斑点落叶病菌、苹果褐斑病菌、小麦赤霉病菌、稻瘟病、烟草赤星病菌、苹果腐烂病菌、水稻白叶枯病菌及柑橘溃疡病菌,由贵州凯里学院黔东南民族药综合利用工程中心提供。
2 方法
2.1 菌种的分离与纯化
从银杏林取适量土样,将其自然风干,过60目筛。再采用稀释法,在高氏一号培养基上对菌種进行划线培养,分离,纯化。最后从培养基上挑取单菌落接种到斜面培养基,28℃培养3d,置于冰箱4℃保存。
2.2 放线菌拮抗活性测试
在NA培养基上活化柑橘溃疡病菌和水稻白叶枯病菌,用蒸馏水将其配制成浓度约为106个/mL的细菌菌悬液,分别取100μL加入融化的NA培养基中,混匀,倒皿,制成含菌平皿。在PDA培养基上活化菌株,用打孔器取带有单菌落的菌饼,将菌饼带菌丝的一面贴在制好的含病原细菌的培养基表面。每个处理设3个重复,置于28℃培养2d,用十字交叉法测量抑菌圈直径。
在PDA培养基上活化植物病原真菌(苹果轮纹病菌、苹果斑点落叶病菌、苹果褐斑病菌、小麦赤霉病菌、稻瘟病、烟草赤星病菌、苹果腐烂病菌),分别将病原真菌制成浓度约为106个/mL的孢子悬液,再分别取100μL孢子悬液与融化的PDA混匀,倒皿。菌饼处理如上,于30℃培养5d,用十字交叉法测量抑菌圈直径。
2.3 放线菌液体培养及发酵滤液抑菌活性测定
将菌株MKLFXJ-I接种在PDA斜面培养基上培养7d,用无菌蒸馏水洗下孢子悬液,接种到发酵培养基(葡萄糖20g,玉米粉10g,黄豆粉20g,酵母膏1g,(NH4)2SO4 3g,K2HPO4 0.20g,MgSO4 0.25g,NaCl 3.00g,FeSO4 0.01g,CaCO3 5.00g,蒸馏水1L, pH7.0~7.2),28℃,180rpm/min振荡培养5 d,4000rpm/min离心,收集上清液。
采用生长速率法[9] 测试发酵液对真菌活性,把1mL发酵液(经0.22 μm微孔滤膜)与9mL融化的PDA培养基混匀,倒皿,制成含药平皿。用打孔器分别取病原真菌菌块,反面接种在含药平皿上,每个处理设3次重复,30℃培养5d,用十字交叉法测量供试菌菌落直径,计算抑制率。
抑制率(%)=[(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)]×100
采用杯碟法[10]对菌株MKLFXJ-I发酵液对柑橘溃疡病菌和水稻白叶枯病菌的抑菌活性。将其用蒸馏水其配制成浓度约为106个/mL的细菌菌悬液,分别取100μL加入融化的NA培养基中,混匀,倒皿,制成含菌平皿。在含菌平皿上等距放置牛津杯,牛津杯内加入250μL发酵液,每个处理各设3个重复。30℃培养20~48h,采用十字交叉法测量抑菌圈直径。
2.4 放线菌MKLFXJ-I菌株鉴定
2.4.1 形态观察与培养特征
采用插片法[11],将菌株接种在高氏一号培养基上,30℃培养5~7d,参考阎逊初[12]所用的方法,进行光学显微镜20倍下观察菌株基内菌丝、气生菌丝和孢子丝的形态特征。参照《链霉菌鉴定手册》[13],观察菌株MKLFXJ-I在8种不同培养基上的生长特性。
2.4.2 生理生化特征检测
参考文献[12]的方法,对菌株的生理生化特征进行测定,具体分析菌株MKLFXJ-I对不同碳源和不同氮源利用、对硝酸盐的还原、对牛奶的影响以及是否产酪氨基酸酶和淀粉酶等。
2.4.3 16S rRNA基因序列分析
2.4.3.1 DNA提取
用DNA试剂盒提取菌株MKLFXJ-I的DNA。具体包括:菌株在高氏一号培养基上培养3d,收集菌丝;向菌体沉淀中加入200μL缓冲液GA,振荡至菌体彻底悬浮;向管中加入20μL蛋白酶K溶液,混匀;加入220μL缓冲液GB,振荡15s,70℃放置10min,溶液变的清亮,简短离心以除去管盖内壁的水珠;加220μL无水乙醇,充分振荡混匀15s,此时出现絮状沉淀,简短离心以除去管盖内壁的水珠;将上一步所得溶液和絮状沉淀加入一个吸附柱CB3中(吸附柱放入收集管中),12000rpm离心30s,倒掉废液,将吸附柱放入收集管中;向吸附柱CB3中加入500μL缓冲液GD,12000rpm离心30s,倒掉废液,将吸附柱放入收集管中;向吸附柱CB3中加入600μL漂洗液PW,12000rpm离心30s,倒掉废液,将吸附柱放入收集管中;将吸附柱CB3放入收集管中,12000rpm离心2min,倒掉废液,将吸附柱CB3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液;将吸附柱CB3放入干净的离心管中,向吸附膜的中间部位悬空滴加60μL洗脱缓冲液TE,室温放置数分钟,12000rpm离心2 min,将溶液收集到离心管中(-20 ℃冰箱保存)。
2.4.3.2 聚合酶链式反应(PCR)扩增反应
采用细菌16S通用引物[14]进行16S rDNA PCR扩增,扩增条件见表1。
PCR反应流程为:95℃预变性3min后,进行30个循环,每一个循环包括95℃变性30s,55℃退火30s,72℃延伸30s,循环结束后72℃延伸10min,以保证获得全长产物。
2.4.3.3 琼脂糖凝胶的制备
配浓度为1%的胶(30mL 1×TBE缓冲液,0.3g琼脂糖),加热至琼脂糖溶化,混匀;
在制胶槽上放上制胶板,调整水平插上样品梳子;
把琼脂糖溶液倒入胶板中,加入3 μL的4s-Green核酸染料溶液,充分混匀,注意避免气泡产生;
在凝胶完全凝固后,拔下梳子。
2.4.3.4 DNA样品检测
将凝胶放入电泳槽中,电泳缓冲液要没过凝胶;
取样品5μL,加入样品槽中;
连接电泳仪的正负极,用120V的稳定电压进行电泳,计时20min;
将凝胶置于凝胶成像系统中扫描,观察DNA条带,并拍摄照片;
将目的条带胶回收,样品由中科院微生物研究所测序。
2.4.3.5 系统发育树的构建
先将测得的16S rDNA序列与GenBank数据库中的序列进行BLAST相似性分析,再从GenBank中获得和实验菌株序列相似的种属的16S rDNA序列22株,构建系统发育树。
3 结果与分析
3.1 放线菌分离
采用划线法从银杏林土壤中分离得到1株放线菌,公司将其命名为MKLFXJ-I。
3.2 菌株皿内拮抗活性
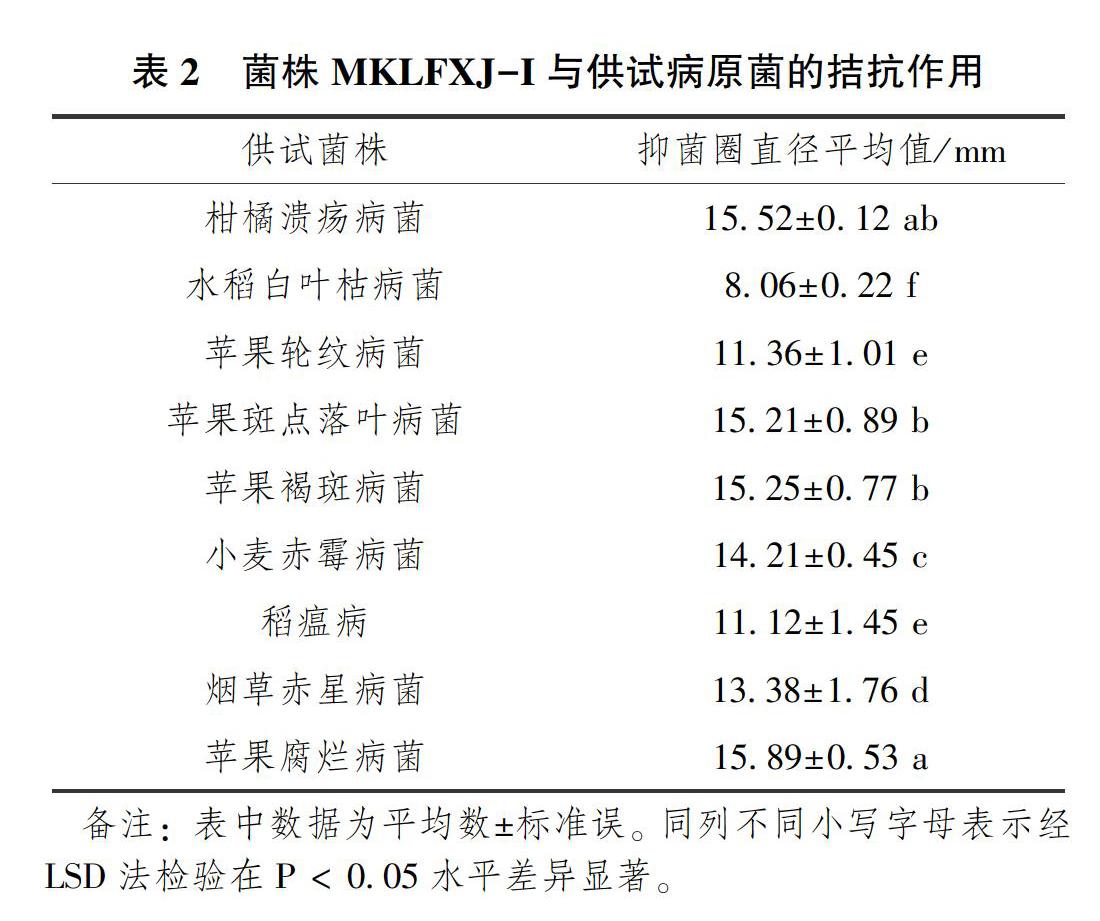
由表2可知,菌株MKLFXJ-I对9种供试病原菌生长均具有不同程度的抑制作用,其中对柑橘溃疡病菌和水稻白叶枯病菌的抑制圈直径分别为15.52±0.12mm和8.06±0.22mm;对苹果轮纹病菌、苹果斑点落叶病菌、苹果褐斑病菌、小麦赤霉病菌、稻瘟病、烟草赤星病菌、苹果腐烂病菌的抑菌透明圈均在10cm以上。
3.3 菌株发酵液抑菌活性测试
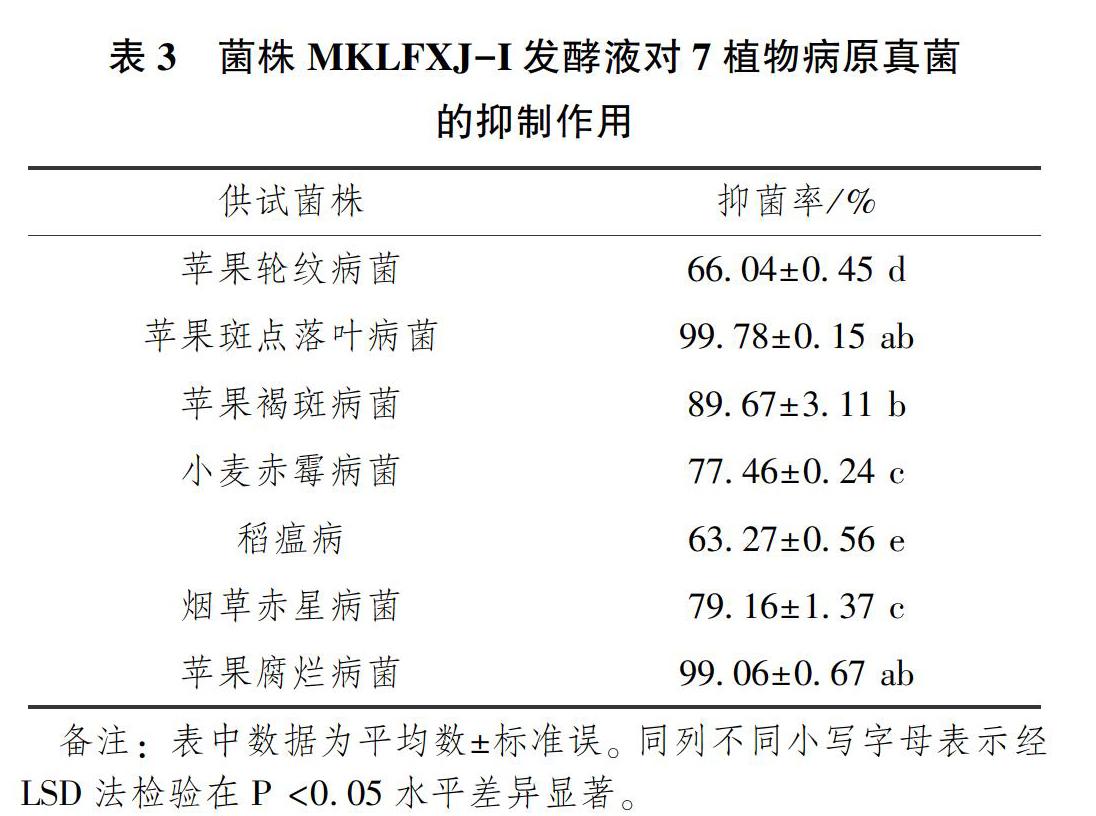
由表3可知,菌株发酵原液对7种供试植物病原真菌菌丝生长具有不同程度的抑制作用,对苹果腐烂病菌和苹果斑点落叶病菌的抑制率达到了98%以上,对其它病原菌的抑制率均大于60%;由表4可知对柑橘溃疡病菌和水稻白叶枯病菌均具有抑制作用,抑菌圈直径平均值分别为35.23±1.34mm和22.45±0.98mm。
3.4 形态特征
菌株MKLFXJ-I在高氏一号培养基上,培养7d,气生菌丝为白色;基内菌丝为豆汁黄色;孢子丝直、柔曲、钩状、螺旋形;孢子柱形、椭圆形。
3.5 培养特征
结果见表5,菌株在8中不同培养基上均不产可溶性色素,气生菌丝白色或无色,基内菌丝浅黄、白色、棕黄或棕色。
3.6 生理生化特征
结果见表6,菌株MKLFXJ-I能利用葡萄糖、甘露糖、甘露醇、乳糖、山梨糖、山梨醇、麦芽糖、鼠李糖、海藻糖、果糖、木糖、核糖、糖原、阿拉伯糖、水杨苷、苦杏仁苷、赤藓醇、肌醇、甘油、纤维二糖、柠檬酸钠、琥珀酸钠等碳源,不能利用半乳糖、蔗糖、蜜二糖、松三糖、菊糖、棉籽糖、苹果酸鈉、葡萄糖酸钠等碳源;能利用赖氨酸、苏氨酸、脯氨酸和丙氨酸。不能还原硝酸盐,可使牛奶冻化,但不凝冻,能产生淀粉酶水解淀粉,产酪氨基酸酶。
3.7 16S rDNA基因序列测定结果
将测得的16S rDNA序列在NCBI中在线BLAST比对分析,结果显示菌株属于连霉属放线菌,再从GenBank中获得和实验菌株序列相似的种属的16S rDNA序列22株,构建系统发育树,见图1。因该菌株与链霉属下面的种16S rDNA序列相似性均较低,因此无法鉴定到种(图1)。
4 讨论
本研究对银杏林土壤中的放线菌进行分离,并对其进行了皿内拮抗试验,结果发现该菌株对柑橘溃疡病菌和水稻白叶枯病菌以及7种植物病原真菌均具有较强的拮抗活性,表明菌株在培养基上可产拮抗活性物质。
发酵原液的生物活性测试结果表明,菌株MKLFXJ-I的发酵产物对供试植物病原真菌和细菌均有一定程度的抑制作用。其中对苹果斑点落叶病菌、苹果轮纹病菌和苹果腐烂病菌的抑制作用明显,在农药的开发和利用方面具有一定的开发潜力。因此,下一步重点研究将针对该菌株发酵产物中活性组分的分离、纯化和鉴定。
通过对菌株的形态、培养特征和生理生化特性及分子生物学的研究,初步鉴定该菌株为链霉菌。因为BLAST进行基因序列比对分析,打分相似性最高的为97%,从进化树分析看,与距离该菌株比较近的菌株打分低,因此无法鉴定到种,由此表明该菌株可能是1个新菌种,因此还有待于采用其它生理生化和分子生物学手段进一步进行分析。
参考文献
[1] Sharma N, Sharma S. Control of foliar diseases of mustard by Bacillus from reclaimedsoil[J]. Microbiological Research, 2008, 163(04): 408-413.
[2]张丽, 纪明山, 谷祖敏, 田宏哲, 李修伟, 李兴海. 印楝内生放线菌鉴定及对稻瘟病菌拮抗作用研究[J].中国生物防治学报, 2014, 30(04): 534-539.
[3]Okami Y, Hotta K. Search and Discovery of NewAntibiotics[M]. Actinomycetes in Biotechnology. 1988:33-67.
[4]胡燕梅, 杨龙. 利用微生物防治植物病害的研究进展[J]. 中国生物防治, 2006, 22(Sl): 190-193.
[5]Umezawa H, Hamada M, Suhara Y, Hashimoto T, Ikekawa T. Kasugamycin, a new antibiotic[J]. Antimicrob Agents Chemother (Berhesda), 1965(5): 753-757.
[6]沈寅初. 国内外农用抗生素研究和发展概况[J]. 抗生素, 1981(02): 57-64,48.
[7]谢德龄, 倪楚芳, 朱昌雄, 黄克慧, 孔都. 中生菌素(农抗751)防治白菜软腐病的效果试验初报[J]. 生物防治通报, 1990(02): 74-77.
[8]赵白鸽, 孔健, 申效诚, 王文夕, 程红梅. 苹果轮纹烂果病生物防治研究初报[J]. 华北农学报, 1993, 12(04): 67-70.
[9]潘金菊, 于婷, 尚玉珂, 慕卫, 刘峰. 生防菌BMP-11对瓜果腐霉病菌的抑制活性及其鉴定[J]. 植物保护学报, 2008, 35(4): 311-316.
[10]马海丹, 周文明, 吴绍东. 拮抗放线菌M_(18)的分离鉴定及杀菌活性研究[J]. 西北农业学报, 2007, 16(05): 291-294.
[11]Park, D. H., Kim, J. S., Kwon, S. W., Wilson, C., Yu, Y. M., Hur, J. H., Lim, C. k. Streptomyces luridiscabiei sp. nov., Streptomyces puniciscabiei sp. nov.and Streptomyces niveiscabiei sp. nov. which cause potato common scab disease in Korea[J]. Intemational Journal Systematic and Evolutionary Microbiology, 2003(06): 2049-2054.
[12]閻逊初. 细菌和放线菌的鉴定[M].北京: 科学出版社, 1958.
[13]中国科学院微生物研究所放线菌分类组.链霉菌鉴定手册[M].北京: 科学出版社, 1975.
[14]Silvia G Acinas, Francisco Rodriguez-Valera, Carlos Pedrós-Alió. Spatial and temporal variation in marine bacterioplankton diversity as shown by RFLP fingerprinting of PCR amplified 16SrDNA[J]. FEMS Microbiology Ecology, 1997, 24(01): 27-40.
作者简介:
高嫚妮(1988-),女,硕士。研究方向:应用微生物及生物医药;
潘忠成(1974-),男,博士。研究方向:应用微生物及生物医药。
