地衣芽孢杆菌对非酒精性脂肪肝病的干预作用及对肠黏膜通透性的影响
2019-01-19宋献美吴晓东石科许波
宋献美 吴晓东 石科 许波
1河南医学高等专科学校微生物与免疫教研室(郑州451191);2郑州大学附属儿童医院(郑州儿童医院)病理科(郑州450018)
随着生活水平的提高,非酒精性脂肪性肝病 (non-alcoholic fatty liver disease,NAFLD)已成为威胁人类健康的重要疾病。流行病学数据显示,NAFLD的发病率不断上升且呈现低龄化的趋势[1],且其中10%~15% 的NAFLD 患者最终发展为肝硬化甚至肝癌[2]。因此,有效的预防及治疗NAFLD 具有重要的意义。微生态学研究发现肠道菌群可通过“肠-肝循环”干预肝病的发生、发展,有望成为治疗NAFLD 的新手段[3]。目前常用的益生菌大部分必须低温冷藏保存,而地衣芽孢杆菌耐热,常温保存即可,并以芽孢形式通过高酸胃环境,到达肠道后萌发成活菌发挥作用[4]。临床研究表明地衣芽孢杆菌治疗NAFLD 疗效确切,但其作用机制不明。本研究通过NAFLD 大鼠模型,观察地衣芽孢杆菌对大鼠肝功能、血脂、肝组织病理学及小肠中紧密连接蛋白表达的影响,探讨地衣芽孢杆菌治疗NAFLD 的作用及机制,为临床提供依据。
1 材料与方法
1.1 材料 地衣芽孢杆菌(青岛东海药业有限公司);丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、二胺氧化酶(DAO)、总胆固醇(TC)、三酰甘油(TG)试剂盒(南京建成生物工程研究所);显色基质鲎试剂盒(厦门鲎试剂生物科技股份有限公司);肿瘤坏死因子-α(TNF-α)ELISA 试剂盒(北京索莱宝科技有限公司);紧密连接蛋白(Occludin)、闭锁小带蛋白-1(ZO-1)多克隆抗体(武汉三鹰生物技术有限公司);高脂饲料(83.25% 基础饲料+10% 猪油+1.5%胆固醇+5%蔗糖+0.2%脱氧胆酸钠+0. 05%丙硫氧嘧啶,江苏省协同医药生物工程有限公司)。
1.2 方法
1.2.1 模型制备与分组给药 40 只雄性Wistar 大鼠适应性喂养1周后,按体质量随机分为4组:正常(Con)对照组、模型对照(Mod)组、地衣芽孢杆菌低(BLL,2.5 × 107CFU∕kg)、高剂量(BLH,5.0 × 107CFU∕kg)组,每组10 只大鼠。分组后Con组给予普通饲料喂养,Mod组、BLL、BLH组用高脂饲料喂养建立NAFLD 模型[5]。从第8 周开始灌胃相应药物,正常组和模型组灌胃蒸馏水,每天1 次,连续5周。
1.2.2 生化指标测定 末次给药后禁食12 h,腹腔注射10%水合氯醛麻醉大鼠,腹主动脉取血,离心分离血清,按照试剂盒说明检测血清中ALT、AST、TC 和TG 的水平。
1.2.3 肝脏组织病理检测 取血后分离大鼠肝脏,在肝右叶离边缘1 cm 处横切取肝组织经中性甲醛固定,石蜡包埋后切片,常规HE 染色,于显微镜下观察肝组织病理学形态。
1.2.4 血清中ETX、DAO 和肝脏中TNF-α 检测采用比色法按照试剂盒说明书检测血清中DAO 的活性;采用鲎试剂法检测血清中ETX的含量;取150 mg 肝组织加450 μL 生理盐水制备肝匀浆,取匀浆液用ELISA 法检测TNF-α的含量。
1.2.5 免疫组织化学检测小肠中Occludin、ZO-1的表达 分离大鼠小肠组织,中性甲醛固定,脱水、包埋,切片,二甲苯脱蜡后乙醇水化,抗原修复后分别滴加Occludin、ZO-1 一抗(1:500),SABC 法孵育二抗,DAB 显色后复染,显微镜下观察,细胞胞浆染成棕黄色为阳性细胞。每张切片随机取3 个视野,用Image-Pro Plus 6.0 图像分析软件分析Occludin、ZO-1 免疫反应阳性的平均光密度值。
1.3 统计学方法 采用SPSS 17.0 软件进行统计分析,数据以均数±标准差表示,多组比较采用单因素方差分析,组间比较用LSD 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 生化指标结果 与Con组比较,模型组大鼠血清中各项指标水平明显升高(P<0.05)。与Mod组比较,BLLL、BLH组大鼠血清ALT、AST 活性明显降低,TC、TG 含量明显减少(P<0.05),且地衣芽孢杆菌实验组大鼠血清中生化指标水平随着地衣芽孢杆菌剂量的增加而减少。见表1。
表1 大鼠血清中ALT、AST、TC 和TG 的水平Tab.1 The contents of ALT,AST,TC and TG in serum(n=10) ±s
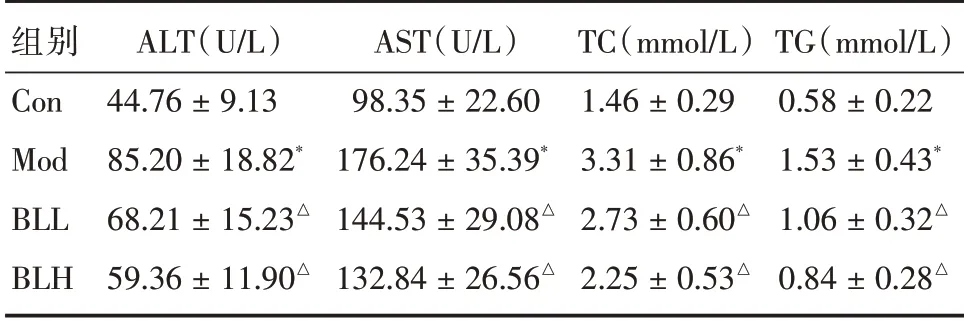
表1 大鼠血清中ALT、AST、TC 和TG 的水平Tab.1 The contents of ALT,AST,TC and TG in serum(n=10) ±s
注:与对照组比较,*P <0.05;与模型组比较,△P <0.05
组别Con Mod BLL BLH ALT(U∕L)44.76±9.13 85.20±18.82*68.21±15.23△59.36±11.90△AST(U∕L)98.35±22.60 176.24±35.39*144.53±29.08△132.84±26.56△TC(mmol∕L)1.46±0.29 3.31±0.86*2.73±0.60△2.25±0.53△TG(mmol∕L)0.58±0.22 1.53±0.43*1.06±0.32△0.84±0.28△
2.2 肝组织病理学 HE 染色显示,Con组大鼠肝小叶结构完整清晰,可见呈放射状排列的肝索,肝细胞排列整齐,体积正常,界限清楚,无脂肪变性;Mod组大鼠肝小叶结构紊乱,小叶内肝细胞肿胀,呈中大泡性脂肪变性,内有大小不等的脂滴,小叶内可见肝细胞点状坏死,汇管区及小叶内炎症细胞浸润;BLL、BLH组大鼠肝细胞肿胀程度减轻,细胞内脂滴数量减少,可见少量炎症细胞浸润,肝索结构明显改善。见图1。
2.3 血清中ETX、DAO 和肝中TNF-α 的水平与Con组比较,模型组大鼠血清中各项指标水平明显升高,肝组织中TNF-α 含量增加(P<0.05)。与Mod组比较,BLL、BLH组大鼠血清ETX、DAO 水平明显降低,肝组织中TNF-α 含量明显减少(P<0.05)。见表2。
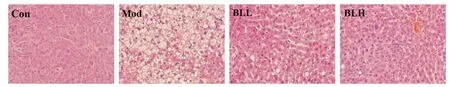
图1 各组大鼠的肝组织病理(HE,×200)Fig.1 Pathomorphology of liver tissues in NAFLD rats(HE staining,×200)
表2 大鼠血清中ETX、DAO 和肝中TNF-α 的含量Tab.2 The contents of ETX、DAO in serum and TNF-α in liver(n=10) ±s
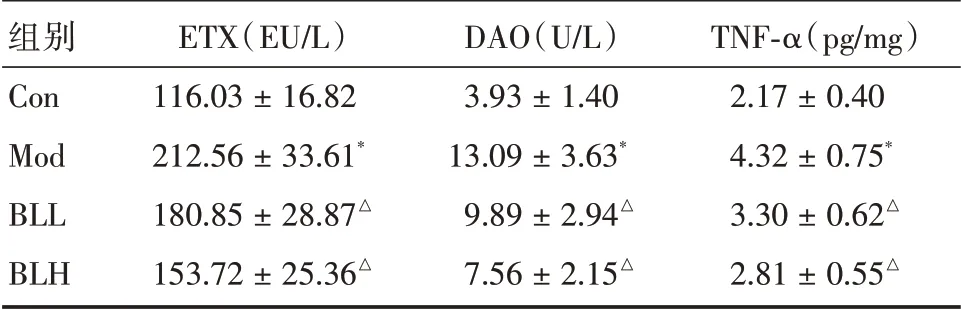
表2 大鼠血清中ETX、DAO 和肝中TNF-α 的含量Tab.2 The contents of ETX、DAO in serum and TNF-α in liver(n=10) ±s
注:与对照组比较,*P <0.05;与模型组比较,△P <0.05
组别Con Mod BLL BLH ETX(EU∕L)116.03±16.82 212.56±33.61*180.85±28.87△153.72±25.36△DAO(U∕L)3.93±1.40 13.09±3.63*9.89±2.94△7.56±2.15△TNF-α(pg∕mg)2.17±0.40 4.32±0.75*3.30±0.62△2.81±0.55△
2.4 各组大鼠小肠Occludin、ZO-1 蛋白表达Con组、Mod组、BLL组和BLH组大鼠小肠组织中Occludin的表达平均光密度分别为0.196 3±0.027 6、0.163 8±0.019 2、0.180 4±0.023 9、0.189 6±0.025 1;Zo-1 的表达平均光密度分别为0.215 6±0.026 8、0.177 5±0.019 1、0.198 9±0.021 1、0.206 2±0.023 7。Mod组大鼠Occludin、ZO-1 蛋白表达较Con组明显减少(P<0.05),与Mod组比较,BLL组大鼠ZO-1 表达明显增加,BLH组大鼠Occludin、ZO-1 蛋白均显著增加(P<0.05)。见图2、3。
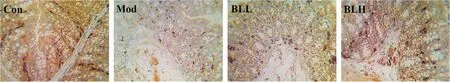
图2 各组大鼠的小肠组织中Occludin 的表达(×200)Fig.2 The expression of Occludin in small intestine of NAFLD rats(×200)
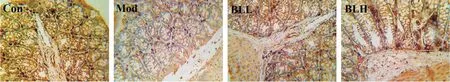
图3 各组大鼠的小肠组织中Zo-1 的表达(×200)Fig.3 The expression of Zo-1 in small intestine of NAFLD rats(×200)
3 讨论
随着人们生活方式和饮食结构的改变,NAFLD发病率呈逐年上升趋势。NAFLD 可能与高脂饮食、胰岛素抵抗及遗传易感性密切相关,过多的脂肪在肝脏堆积,而肝细胞一方面从血液中摄取脂肪酸合成TG,另一方面是以极低密度脂蛋白的形式将TG 转运出肝细胞。不论任何步骤发生异常都会引起肝细胞脂肪合成能力增加和(或)转运入血能力降低,从而导致肝内脂质沉积、肝细胞脂肪变性,肝细胞出现炎症坏死,导致NAFLD 的发生[6]。本研究采用高脂饮食诱导动物模型,结果显示高脂饲料喂养大鼠肝组织小叶结构紊乱,肝细胞肿胀,出现脂肪变性,可见肝细胞点状坏死,血清TC和TG 水平明显升高,表明大鼠脂质代谢紊乱,NAFLD 疾病模型建立成功。
肠道菌群失调可能是NAFLD 发生的关键环节,NAFLD 患者肠存在肠道菌群失调的现象[7]。肠道中革兰阴性菌增加,内源性乙醇生成增多,内源性乙醇诱导致炎性细胞因子的分泌,激活巨噬细胞进而引起肠道屏障功能受损,肠黏膜通透性增加[8]。大量内毒素易位经门脉系统进入肝脏,激活肝脏Kupffer 细胞,释放TNF-α等炎性介质,引发炎症瀑布反应,对肝细胞形成“二次打击”,损伤肝细胞,影响其代谢、分泌功能,引起胆汁分泌障碍。胆汁分泌异常会影响脂肪的正常代谢,脂肪异常堆积导致肝细胞脂肪变性,最终形成NAFLD[9]。因此,调节肠道菌群平衡可改善肝功能,阻止NAFLD 的发生[10]。地衣芽孢杆菌可以造成肠道环境低氧状态,支持肠道内优势菌群生长(如双歧杆菌、乳杆菌、拟杆菌、消化链球菌等),同时低氧环境会抑制好氧致病菌,进而调节肠道菌群的平衡。本研究发现NAFLD 大鼠血清中内毒素水平和肝匀浆中TNF-α含量明显高于正常大鼠,地衣芽孢杆菌干预后,NAFLD 大鼠血清中ALT、AST 活性和TC、TG 水平降低,肝组织中TNF-α含量减少,肝组织病理学损伤明显改善,表明地衣芽孢杆菌对非酒精性脂肪肝病具有保护作用。
肠黏膜的通透性可反映肠道屏障功能。DAO是存在于肠黏膜上层绒毛细胞胞浆中的内酶,肠黏膜损伤后DAO 释放进入血液,导致血液中DAO活性增高。通过检测血清中DAO 活性可间接反映肠道的屏障功能变化[11]。肠道屏障功能是主要由肠道黏膜的机械屏障、免疫屏障、化学屏障和生物屏障组成,最重要的是机械屏障。机械屏障由上皮细胞及细胞间紧密连接构成,紧密连接决定了肠黏膜通透性[12]。组成紧密连接的蛋白众多,其中最重要的是Occludin、Zo-1,Occludin 与胞浆中其他蛋白形成紧密连接的基本结构,调控细胞的跨上皮电阻和膜转运功能[13],Zo-1 则是连接Occludin 与胞内骨架的关键分子,对肠上皮起稳定作用[14]。紧密连接蛋白的破坏会导致肠黏膜通透性增高,使内毒素、细菌等从肠腔移位进入血液。本研究发现NAFLD 大鼠血清中DAO 活性升高,说明NAFLD 大鼠肠黏膜通透性增加,肠道屏障受损。地衣芽孢杆菌干预后,血清中DAO 活性降低,肠道中紧密连接Occludin、Zo-1 表达增加,表明地衣芽孢杆菌可通过调节紧密连接的表达改善肠黏膜的通透性,保护肠道屏障。
综上所述,地衣芽孢杆菌可增加肠道紧密连接蛋白的表达,改善肠黏膜的通透性,减少内毒素的肠渗漏,缓解肝脏脂肪变性,保护NAFLD 肝脏功能。本研究的创新之处为基于肠道菌群失调可能是NAFLD发生的关键环节,通过地衣芽孢杆菌纠正肠道菌群紊乱,保护肠道屏障功能,从而对NAFLD产生改善作用。由于受条件限制,本研究未观察地衣芽孢杆菌对NAFLD 大鼠肠道菌群改变的影响,因此,需要通过更深入的试验来解决上述问题,为地衣芽孢杆菌治疗NAFLD 提供更充分的依据。
