高糖诱导H9c2 心肌细胞TRAP1 的表达变化及意义
2019-01-19钟祯李万根张霄旦
钟祯 李万根 张霄旦
广州医科大学附属第二医院内分泌科(广州510260)
糖尿病心肌病(diabetic cardiomyopathy,DCM)是常见的糖尿病心血管并发症之一,是一种独立于高血压、冠心病的特异性心脏疾病,1972年被RUBLER 等[1]首次发现并报道。DCM 增加糖尿病患者心力衰竭的风险,是糖尿病患者死亡的主要原因之一[2]。DCM的发生、发展是多因素的,但高血糖环境下心肌细胞线粒体电子传递链产生超氧化物(reactive oxygen species,ROS)引起的氧化应激被认为是导致DCM 的共同途径[3]。ROS 可以诱导线粒体通透性转运孔的开放,释放出细胞色素C等活性物质,影响线粒体膜内外电荷分布,降低线粒体膜电位,导致线粒体功能障碍。肿瘤坏死因子相关受体蛋白1(tumor necrosis factor receptorassociated protein 1,TRAP1)是一种定位于线粒体的热休克蛋白90(heat shock protein 90,HSP90)家族成员,具有抗氧化活性,在某些应激或病理条件下线粒体稳态维持中起重要作用[4]。TRAP1 可通过抑制ROS 的产生减轻氧化应激从而保护细胞,减少细胞凋亡。目前对于TRAP1 的研究主要集中在肿瘤领域,被认为是线粒体功能的关键调控因子,有助于肿瘤细胞逃避死亡损伤[5-6]。目前TRAP1 在DCM 的研究尚未见报道,相关机制尚不明确。
本研究通过检测高糖环境下心肌细胞线粒体功能改变、心肌细胞活性变化以及高糖作用下心肌细胞TRAP1 表达。首次探讨了DCM 发生发展过程中TRAP1 的表达变化及作用,为寻找新的治疗靶点提供理论基础。
1 材料与方法
1.1 材料及试剂 大鼠心肌细胞株H9c2 购自中科院上海细胞保藏库;低糖DMEM 培养基、胎牛血清购于美国GIBCO 公司;D-Glucose、D-Mannitol 购于Sigma 公司;PrimeScriptTMRT Master Mix 转染试剂购于美国Takara 公司;Applied BiosystemsTMPowerUpTMSYBRTMGreen Mix、Trizol 购于美国Invitrogen公司;兔抗大鼠TRAP1 多克隆抗体购于美国Abcam 公司;HRP 标记的羊抗兔二抗购于美国Genecopoeia 公 司;CellTiter 96®AQueous One Solution Assay(MTS)购于美国Promega 公司;线粒体膜电位检测试剂盒(JC-1)购于碧云天。
1.2 H9c2 细胞的培养及分组 大鼠心肌H9c2 细胞用含10%胎牛血清和1%双抗的低糖DMEM 培养基,置于37 ℃、5%CO2的细胞培养箱中培养,细胞密度达到70%~80%时1∶3 传代,生长对数期细胞用于实验。实验分为3组:正常糖对照组(C):含5.5 mmol∕L 葡 萄 糖 的DMEM 培 养 基 处 理 细 胞48 h;高糖组(G):含33.0 mmol∕L 葡萄糖的DMEM培养基处理细胞48 h;高渗组(M):含5.5 mmol∕L葡 萄 糖+27.5 mmol∕L 甘 露醇 的DMEM 培 养 基处 理细胞48 h。
1.3 Western blot H9c2 细胞以1.5×105个∕孔的密度接种于六孔板中,培养12 h 贴壁,予不同葡萄糖浓度或甘露醇处理48 h 后,各组细胞加预冷的PBS 洗两遍,加入蛋白裂解液,冰浴10 min 后将细胞从孔板中刮取下来,超声破碎细胞后离心,取上清,采用BCA 法进行蛋白定量。加入5×Loading Buffer 后煮沸10 min,经10% SDS-PAGE 凝胶电泳分离后,转移至PVDF 膜上。5%脱脂奶粉室温封闭2 h,加入相应抗体4 ℃过夜。一抗工作浓度为TRAP1(1∶1 000),加入辣根过氧化物酶(HRP)标记的二抗,室温孵育1 h,加入发光液后放入化学发光成像分析仪中曝光。Image J 分析软件分析各条带灰度值,以检测蛋白条带灰度值与内参GAPDH的灰度值比值表示目的蛋白表达情况。
1.4 qRT-PCR H9c2 细胞以1.5 × 105个∕孔的密度接种于六孔板中,培养12 h 贴壁,予不同葡萄糖浓度或甘露醇处理48 h 后,每孔加入1 mL Trizol提取总RNA,用酶标仪测定RNA 样本纯度及浓度,按照逆转录试剂盒说明书操作,将总RNA 逆转录成cDNA,反应体系30 μL。以逆转录所得cDNA 为模板,每个样本设置3 个目的基因及3 个内参基因平行试验,应用LightCycler®480 进行实时PCR 荧光定量检测。目的基因mRNA 表达水平以2-ΔΔCT相对定量方法进行分析。引物:TRAP1-F:5′-CTCAGTTGCTACAGCCCACA-3′;TRAP1-R:5′-CTGCTATCATGGCGTTCTCA-3′;GAPDH-F:5-AGGTGAAGGTCGGAGTCAAC-3′;GAPDH-R:5-CGCTCCTGGAAGATGGTGAT-3′。
1.5 MTS 检测细胞活性 H9c2 细胞以5 000 个∕孔接种于96 孔板,按各组细胞处理方法处理相应时间后,更换完全培养基100 μL ∕孔,每孔加入MTS 检测试剂20 μL,轻轻摇匀,37 ℃孵育2 h,多功能酶标仪于490 nm 波长检测各孔吸光度。
1.6 细胞内ROS 检测 以2′,7′-二氢二氯荧光黄双乙酸盐(2′,7′-dichlorodihydrofluorescein diacetate,DCFH-DA)为荧光探针检测,严格按照试剂说明书操作,荧光倒置显微镜下观察绿色荧光强度,以绿色荧光强度反映细胞内ROS 水平,拍摄荧光图。Image J 分析软件对各组荧光图进行荧光半定量,以IntDen∕Area 的值表示细胞平均荧光强度。
1.7 线粒体膜电位测定 运用JC-1 荧光染色检测心肌细胞线粒体膜电位变化,严格按照说明书操作,荧光倒置显微镜下观察红色荧光强度,以红色荧光强度反映细胞内线粒体膜电位水平拍摄荧光图。Image J 分析软件对各组荧光图进行荧光半定量,以IntDen∕Area 的值表示细胞平均荧光强度。
1.8 统计学方法 采用SPSS 16.0 统计软件进行统计分析,计量资料采用均数±标准差表示,两组间比较采用两独立样本t检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 高糖环境下H9c2 细胞低表达TRAP1 高糖组TRAP1 蛋白表达量较正常糖对照组及高渗组均减少(P<0.05),而高渗组与正常对照组相比,TRAP1 蛋白表达量差异无统计学意义。见图1。高糖组TRAP1 mRNA 表达水平较正常糖对照组及高渗组均下降(P<0.05),高渗组与正常糖对照组之间差异无统计学意义。见图2。
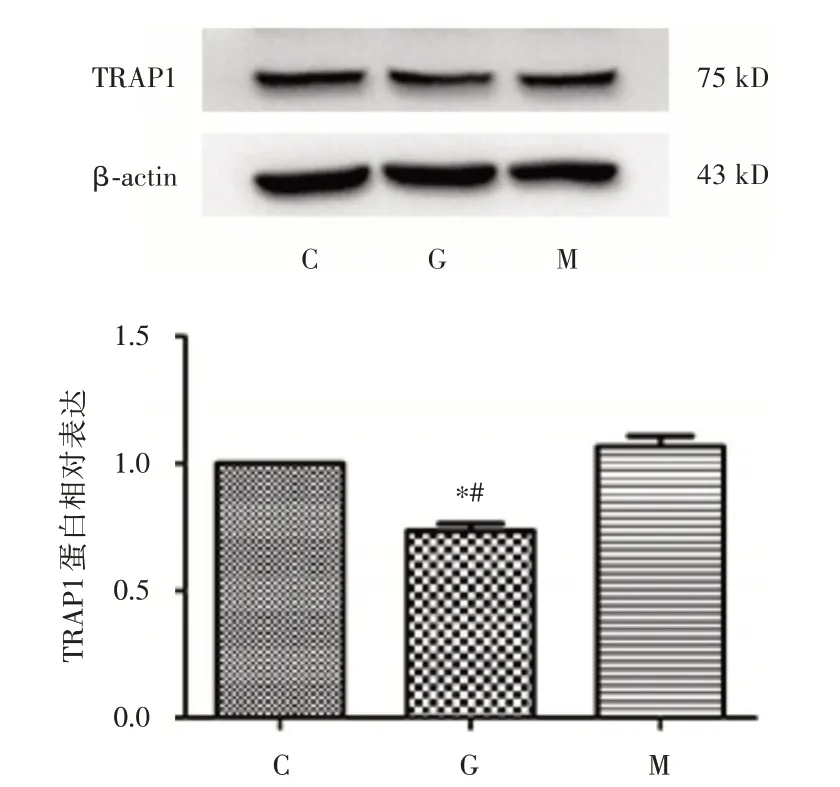
图1 高糖环境下H9c2 细胞TRAP1 蛋白表达情况Fig.1 Detection of protein expression of TRAP1 in H9c2 cells under hyperglycemia via Western blotting assays
2.2 高糖环境下H9c2 活性下降 高糖组心肌细胞活性低于对照组(P<0.05),高渗组与正常糖对照组细胞活性差异无统计学意义。见图3。
2.3 高糖环境下H9c2 生成ROS 增多 高糖组绿色荧光强度较正常糖对照组及高渗组高(P<0.05),而高渗组绿色荧光强度与正常糖对照组差异无统计学意义。见图4、5。
2.4 高糖环境下H9c2 细胞线粒体膜电位下降高糖组红色荧光强度较正常糖对照组及高渗组高(P<0.05),而高渗组红色荧光强度与正常糖对照组差异无统计学意义。见图6、7。
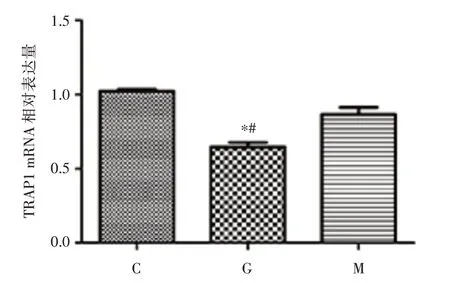
图2 高糖环境下H9c2 细胞TRAP1 mRNA 表达情况Fig.2 Detection of mRNA expression of TRAP1 in H9c2 cells under hyperglycemia via RT-PCR
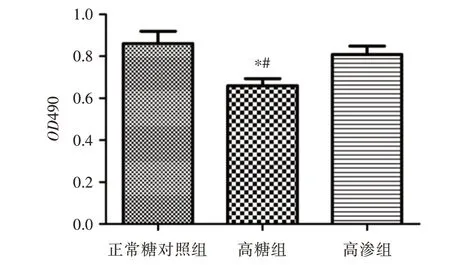
图3 高糖环境下H9c2 细胞活性统计分析图Fig.3 Detection of activity of H9c2 cells under hyperglycemia via MTS

图4 各组细胞加载DCFH-DA 荧光探针后显色,荧光倒置显微镜拍摄荧光图Fig.4 Detection of of H9c2 cells under hyperglycemia via DCFH-DC
3 讨论
糖尿病心血管并发症是糖尿病患者致死的主要原因,DCM 早期阶段表现为舒张功能障碍,后期表现为独立于血脂异常、高血压和冠状动脉疾病的心力衰竭。胰岛素抵抗、高胰岛素血症和高血糖是DCM 发展的独立危险因素[7]。DCM 的发病机制主要包括全身代谢紊乱、肾素-血管紧张素-醛固酮系统的异常激活、氧化应激、炎症和功能失调性免疫调节等[8]。这些异常共同促进心脏纤维化,由无症状的心脏舒张功能障碍进展为心室顺应性下降、收缩功能障碍,导致临床心力衰竭。其中,氧化应激被认为是DCM 发生发展的始动因素。DCM 时氧化应激增强,ROS 生成增加,过氧化氢增加,同时过氧化氢酶活性下降[9]。高血糖及波动的血糖水平可诱发急性的氧化应激,细胞内氧化应激-抗氧化应激平衡失调,ROS 和活性氮生成过多和清除不足,过量ROS 在细胞内蓄积,可以诱导线粒体通透性转运孔的开放,释放出细胞色素C 等活性物质,影响线粒体膜内外电荷的分布,使线粒体膜电位降低,引起细胞功能障碍及细胞凋亡[10-11]。

图5 各组绿色荧光图荧光半定量统计分析图Fig.5 Green fluorescence semi-quantitative statistical analysis
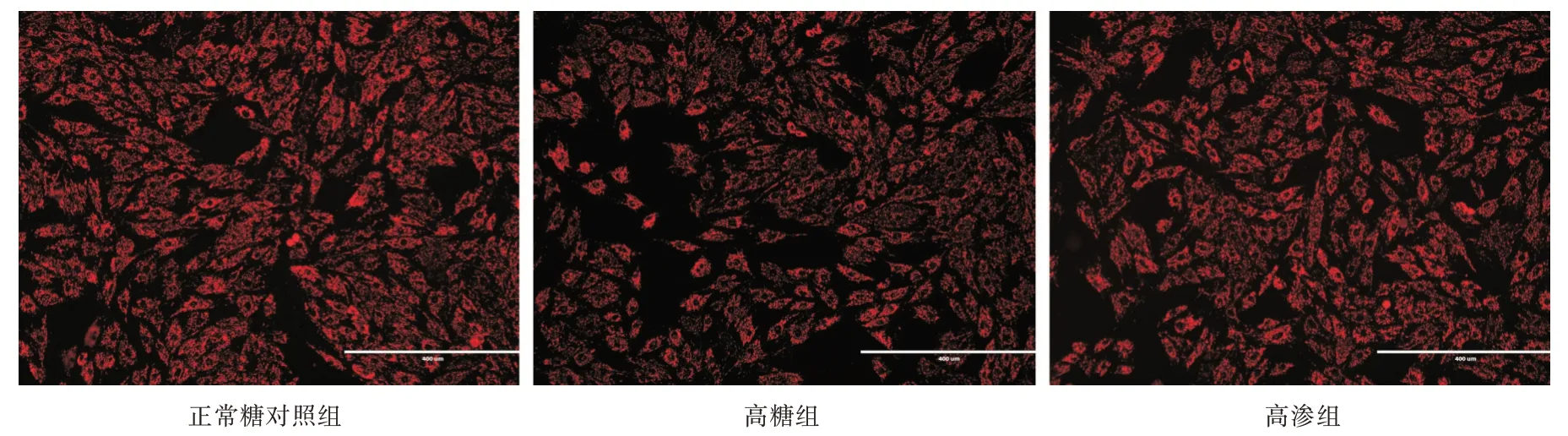
图6 各组细胞加载JC-1 荧光探针后显色,荧光倒置显微镜拍摄荧光图Fig.6 Detection of mitochondrial membrane potential of H9c2 cells under hyperglycemia via DCFH-DC

图7 各组红色荧光图荧光半定量统计分析图Fig.7 Red fluorescence semi-quantitative statistical analysis
TRAP1 最早是通过酵母的双杂交筛选鉴定,作为与肿瘤坏死因子受体(tumor necrosis factor receptor 1,TNFR1)的胞内结构域结合的新蛋白质被发现。与此同时,另一次的筛选发现TRAP1 和HSP90 蛋白家族成员之间具有34%的序列同一性和60%同源性,证明其是HSP90 家族的新成员,具有热休克蛋白家族的一般性质,参与细胞蛋白修饰等生理过程[12]。TIAN 等[13]研究发现,敲低体外食管癌细胞系ECA109 和EC9706 中的TRAP1 表达可诱导ROS 和线粒体去极化的增加,使得细胞周期阻滞于G2∕M期,抑制细胞增殖,重新表达TRAP1可恢复细胞增殖和细胞凋亡。IM 等[14]用铁螯合剂去铁胺处理正常人肝细胞系Chang 细胞,观察到细胞TRAP1 表达减少,同时ROS 的产生增加。过表达TRAP1 可减弱去铁胺的作用,减少了ROS 的产生。这些结果表明,TRAP1 可通过减少ROS 产生而在保护线粒体免受破坏性刺激中起作用。
TRAP1 对心肌细胞也存在保护作用。近年来研究发现,TRAP1 可通过阻断TAK∕P38、JNK 和AKT 等信号通路来减轻由压力负荷引起的心肌肥大和心肌纤维化[15]。低氧环境可诱导心肌细胞中TRAP1 的表达增加,且TRAP1 蛋白可通过调节线粒体通透性转换孔的开放对缺氧心肌细胞起到保护作用[16]。VOLOBOUEVA 等[17]用不含葡萄糖的培养基培养原代星形胶质细胞,发现细胞的TRAP1 表达量增高,同时TRAP1 的过表达可减少葡萄糖糖剥夺的星形胶质细胞中ROS 的产生和维持细胞线粒体膜电位。本研究利用高糖处理H9c2 细胞,观察到高糖环境下细胞中TRAP1 的表达量较正常糖对照组及高渗组均下降,高渗对照组排除了高糖环境下渗透压升高的影响,提示高糖毒性可引起心肌细胞TRAP1 表达下降。同时,笔者观察到高糖环境下ROS 表达量较正常糖环境下和高渗透压环境下均有所增加。对细胞线粒体功能及细胞损伤的检测显示高糖环境下细胞线粒体膜电位降低,线粒体功能受损,细胞活性下降。提示高糖毒性可通过增加ROS 的产生,影响线粒体功能,进而影响心肌细胞活性,造成心肌损伤。而TRAP1 表达的下降可增加细胞内ROS 含量,从而影响细胞线粒体功能,可能与高糖环境下ROS所致的线粒体功能受损所致的心肌损伤密切相关。
综上所述,高糖环境下心肌细胞中TRAP1 蛋白表达的下降,参与到ROS 增加介导的心肌线粒体功能改变所致的糖尿病心肌病变中,但其中具体机制通路尚未明确,下一步需完善相关研究,为DCM 治疗新方法提供理论依据。
