清肝益肾袪风复方干预高血压肠道屏障功能失调的效应机制研究*
2019-01-18熊敏琪唐晓婷崔金刚丁李立强唐新淼王培伟
熊敏琪,唐晓婷,崔金刚,丁李立强,唐新淼,王培伟,陈 瑜**,张 腾**
(1. 上海中医药大学附属岳阳中西医结合医院 上海 200437;2. 上海市中医药研究院中西医结合临床研究所 上海 200437)
高血压是冠心病发病和死亡的主要危险因素,也是脑卒中的高危因素,占世界范围内主要死亡疾病谱的主导地位。近年来围绕高血压发病和防治的研究不断呈现新的成果,肠道屏障及其功能等研究为诸多复杂性疾病发生机制的认识产生了巨大影响,也为高血压发生机制和防治研究开启了新的窗口。研究表明,肠道屏障稳态变化与心血管疾病的转归有着密切关联性[1],且本课题组前期研究表明清肝益肾祛风复方具有显著的降压效果[2],因此本实验旨在探索清肝益肾祛风复方的降压效应是否与调节肠道屏障功能相关,为其临床推广应用提供可靠的实验依据。
1 材料与方法
1.1 实验动物
1.2 药物与试剂
WKY 大鼠18 只,SHR 大鼠54 只,雄性,4 周龄,SPF级,购自北京维通利华实验动物技术有限公司,动物合格证号:SCXK(京)2012-0001。
QYQ 购于上海康桥中药饮片有限公司。坎地沙坦酯片(8 mg):国药准字J20150085,日本武田药品工业株式会社。异硫氰酸荧光素标记葡聚糖(FITCdextran,FD4)购自美国Sigma 公司。逆转录试剂盒购于宝生物工程有限公司。
1.3 主要仪器
实时荧光定量PCR 系统:Roche 公司;冰冻切片机:Leica 公司;正置显微镜:Leica 公司;荧光分光光度计:Bio-Tek公司。
1.4 动物分组及给药
所有实验动物用普通饲料适应性喂养1 周后,将SHR 大鼠随机分为模型组、清肝益肾袪风复方组(QYQ)、坎地沙坦酯片组(Can),以同周龄WKY 雄性大鼠为正常对照组,每组18只。QYQ 组(川芎15 g、柴胡15 g、黄连6 g、羌活15 g、防风15 g、夏枯草30 g、川牛膝15 g、黄精15 g、石决明20 g、炒黄芩15 g、桑寄生15 g、益母草30 g)各药材采用中药常规煎煮法,按照人体剂量6.3 倍换算后浓缩灌胃;坎地沙坦酯片用pH值为6.4的磷酸盐缓冲液(PBS)溶解,按照人体剂量换算以1 mg·kg-1的剂量灌胃,给药体积2 mL,每日1 次;空白对照组和模型组给予等体积饮用水。每组大鼠在4周龄时开始灌胃,取6只持续给药至8周龄,6只持续给药至12周龄,6只持续给药至20周龄。
1.5 肠道渗透性检测
将12 周龄和20 周龄的实验动物禁食12 h,次日给各组大鼠称重,将FITC-dextran 溶解于PBS 中,用44 mg/100 g 的浓度给大鼠灌胃,4 小时后眼眶内眦静脉采血,分离血清,4℃避光保存,用荧光分光光度计(激发波长485 nm、发射波长528 nm)测量血清吸光度值。
1.6 动物处理及组织形态学检测
实验动物分别于8 周龄、12 周龄及20 周龄时取材,小心将远端回肠和近端结肠取出,分别纵向剖开,一分为二,一份放入4%多聚甲醛固定,石蜡包埋,进行H&E 染色和Masson's trichrome 染色观察病理形态学的改变,利用Image Pro Plus 6.0软件进行定量分析;一份液氮速冻,用于总RNA抽提。
1.7 基因表达检测
将液氮速冻的回肠和结肠组织进行RNA 抽提,随后用PCR 定量测试仪进行逆转录,再用RT-PCR 法检测各基因的表达,以GAPDH 为内参。引物序列见表1。

表1 引物列表
1.8 统计学方法
采用SPSS 18.0统计软件分析。实验数据以均数±标准差表示,若符合正态分布和方差齐性,多组比较采用单因素方差(One-way ANOVA)分析,两两比较采用SNK 检验,对有序分类资料进行Ridit 分析。P<0.05为差异有统计学意义。
2 结果
2.1 清肝益肾袪风复方显著降低20 周龄SHR 大鼠肠道渗透性
如图1 所示,12 周龄时,与WKY 组相比,模型组SHR 大鼠血清FITC-dextran 浓度显著升高(P<0.05)。与SHR 模型组相比,Can 组与QYQ 治疗组大鼠血清FITC-dextran浓度有降低趋势,但无统计学差异。
20周龄时,与WKY 组相比,模型组SHR 大鼠血清FITC-dextran 浓度显著升高(P<0.05);与模型组SHR大鼠相比,Can 组大鼠血清FITC-dextran 浓度无明显差异;QYQ 治疗组血清FITC-dextran 浓度显著降低(P<0.05)。QYQ 治疗组与Can 组相比,血清FITCdextran浓度显著降低(P<0.05)。
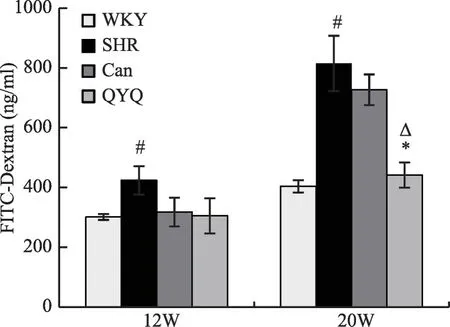
图1 QYQ显著降低20周龄SHR大鼠肠道渗透性
2.2 清肝益肾袪风复方显著改善SHR 大鼠回肠及结肠病理损伤
根据回肠及结肠损伤受累面积、损伤程度等,分别标记-、±、++、+++、++++,其中-代表无明显损伤,++++为存在极重度损伤。
如图2 所示,8 周龄WKY 组,SHR 模型组,Can 组及QYQ 治疗组回肠结构完整,未见明显病理性改变。12 周龄WKY 组回肠结构完整,SHR 模型组回肠壁绒毛坏死,Can组回肠壁粘膜表面局部糜烂,QYQ治疗组未见明显异常。与WKY 组比较,SHR 模型组回肠组织病理损伤评分高于WKY 组,无统计学差异;与SHR模型组比较,Can 组及QYQ 治疗组回肠组织病理损伤评分低于SHR 模型组,无统计学差异(表2A)。20 周龄回肠,WKY组回肠结构完整,未见明显病理性改变,SHR 模型组回肠壁局部粘膜上皮坏死脱落糜烂形成,Can 组回肠粘膜较大面积浅溃疡形成,粘膜层显著充血水肿、炎细胞浸润,QYQ 治疗组偶见微小粘膜表面糜烂。与WKY 组比较,SHR 模型组回肠组织病理损伤评分高于WKY 组(P<0.05);与SHR 模型组比较,Can 组与QYQ 治疗组回肠组织病理损伤评分均显著降低(P<0.05)(表2B)。
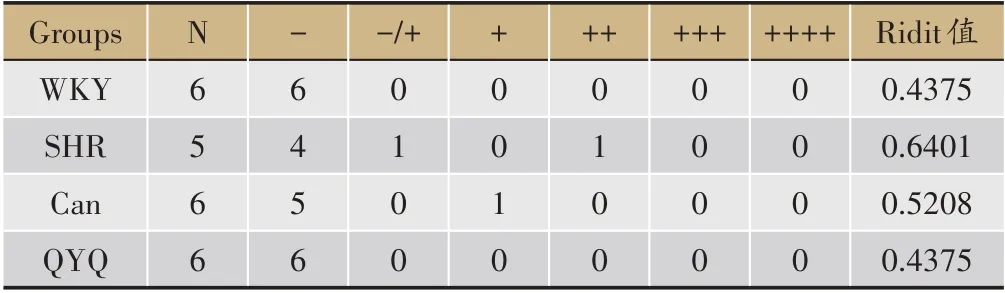
表2 A 12周龄各组大鼠回肠损伤评分
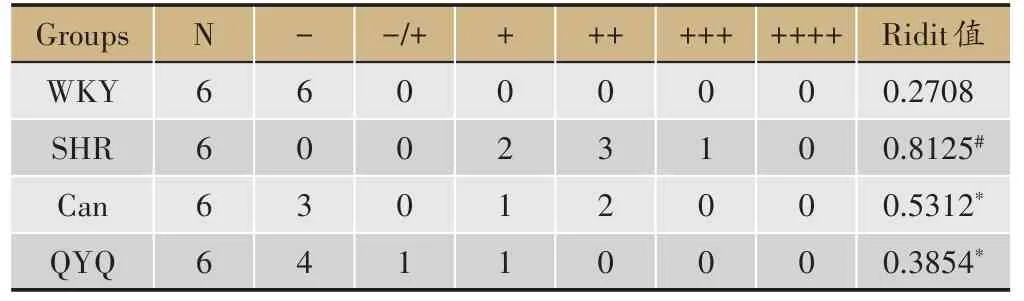
表2B 20周龄各组大鼠回肠损伤评分
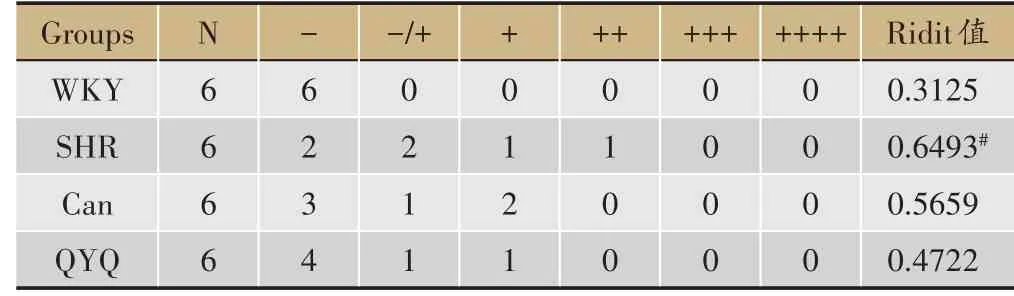
表2 C 12周龄各组大鼠结肠损伤评分
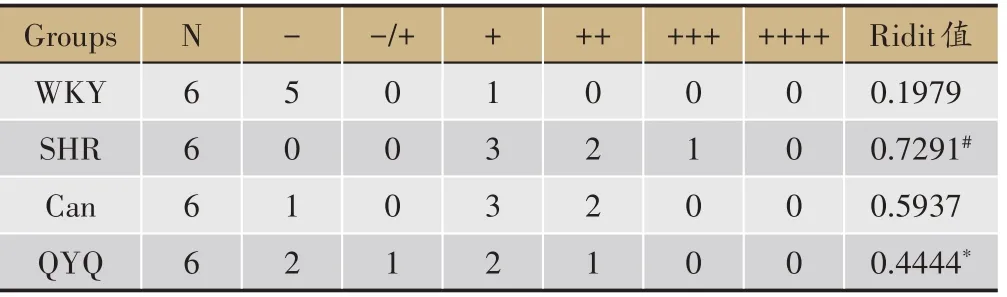
表2D 20周龄各组大鼠结肠损伤评分
8 周龄结肠WKY 组,SHR 模型组,Can 组及QYQ治疗组结肠结构完整,未见明显病理性改变;12 周龄结肠,WKY 组结肠结构完整,SHR 模型组结肠壁粘膜层表面糜烂,Can 组结肠壁粘膜层及粘膜下层轻度水肿,QYQ 治疗组结肠结构完整;与WKY 组比较,SHR模型组结肠组织病理损伤评分显著高于WKY 组(P<0.05),与SHR 模型组比较,Can 组及QYQ 组结肠组织病理损伤评分无明显差异(表2C)。20 周龄结肠,WKY 组结肠结构完整,未见明显病理性改变,SHR 模型组结肠壁粘膜表面糜烂,渗出坏死组织覆盖,Can组结肠壁多发粘膜表面糜烂、充血水肿,QYQ 结肠壁小溃疡形成,溃疡周边上皮细胞和纤维组织增生修复。与WKY 组比较,SHR 模型组结肠组织病理损伤评分显著升高(P<0.05),与SHR 模型组比较,QYQ 治疗组结肠组织病理损伤评分显著降低(P<0.05),SHR 模型组与Can组比较无明显差异(表2D)。
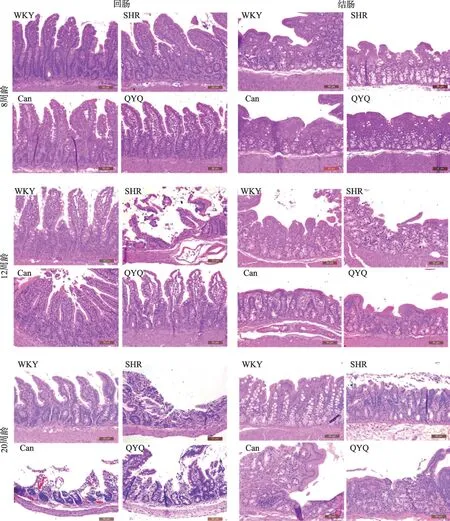
图2 不同周龄大鼠回肠、结肠H&E染色(×200)
2.3 清肝益肾袪风复方显著抑制20 周龄SHR 大鼠回肠及结肠组织纤维化形成
与8 周龄、12 周龄及20 周龄WKY 大鼠回肠和结肠组织纤维化相对面积比较,SHR 模型组纤维化相对面积显著升高,有统计学差异(P<0.05)。在8周龄及12 周龄,与SHR 模型组相比,Can 组及QYQ 治疗组回肠及结肠纤维化相对面积无明显差异;20 周龄,与SHR 模型组纤维化相对面积比较,QYQ 治疗组回肠及结肠纤维化面积显著降低,有统计学差异(P<0.05),且QYQ 治疗组结肠纤维化面积显著低于Can 组,有统计学差异(P<0.05)(图3)。
2.4 清肝益肾袪风复方显著升高20 周龄SHR 大鼠回肠、结肠紧密连接蛋白表达
如图4A 所示,与WKY 组相比,8 周龄SHR 模型组大鼠回肠紧密连接蛋白Cgn,Ocln mRNA 表达无明显差异;与SHR模型组比较,Can组回肠Cgn,Tjp1 mRNA表达无差异,Ocln mRNA 表达水平显著降低(P<0.05);与SHR 模型组及Can 组比较,QYQ 治疗组回肠Cgn mRNA 表达显著升高(P<0.05),Tjp1 mRNA 表达无明显差异;与SHR 模型组比较QYQ 治疗组回肠Ocln mRNA 表达无明显差异,与Can 组比较表达水平显著升高(P<0.05)。
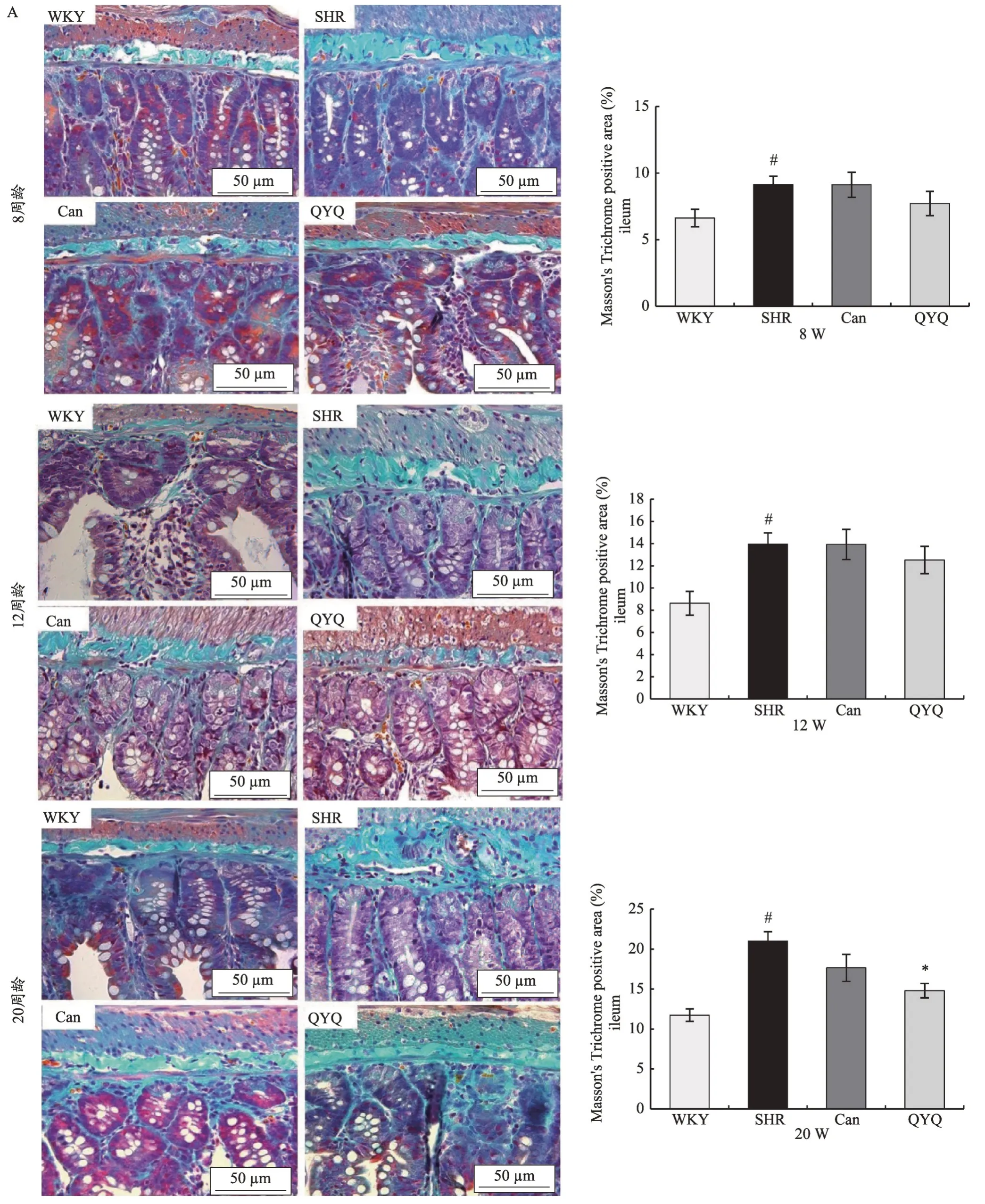
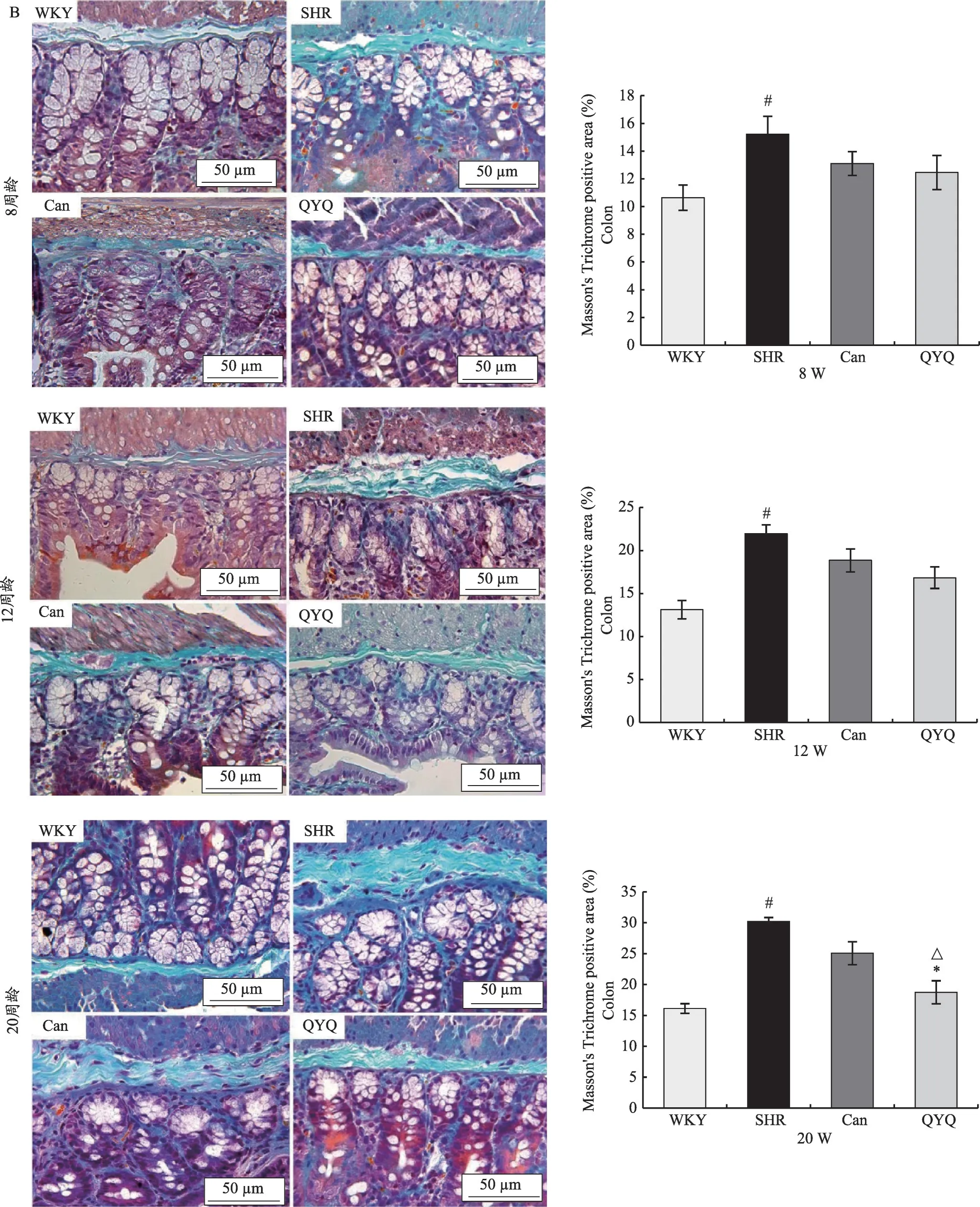
图3 不同周龄大鼠肠道Masson's trichrome染色(×400)

图4 不同周龄大鼠肠道紧密连接蛋白mRNA表达
如图4B 所示,与WKY 组相比,20 周龄时SHR 模型组大鼠回肠紧密连接蛋白Cgn,Ocln 和Tjp1 mRNA表达显著降低(P<0.05);与SHR 模型组相比,Can 组大鼠回肠紧密连接蛋白Cgn,Ocln mRNA 表达无差异,Tjp1 mRNA 表达显著升高(P<0.05);与SHR 模型组及Can 组比较,QYQ 治疗组回肠紧密连接蛋白Cgn,Ocln mRNA 表达显著升高(P<0.05),Tjp1 mRNA表达与模型组比显著升高(P<0.05)。
如图4C 所示,与WKY 组相比,8 周龄SHR 模型组大鼠近端结肠紧密连接蛋白Cgn,Ocln mRNA 表达显著降低(P<0.05);与SHR 模型组比较,Can 组大鼠近端结肠紧密连接蛋白Cgn,Ocln 及Tjp1 mRNA 表达无差异;与SHR 模型组及Can 组比较,QYQ 治疗组近端结肠紧密连接蛋白Cgn,Ocln 及Tjp1 mRNA 表达无差异。
如图4D 所示,与WKY 组相比,20 周龄时SHR 模型组大鼠近端结肠紧密连接蛋白Cgn,Ocln 和Tjp1 mRNA 显著降低(P<0.05);与SHR 模型组相比,Can组大鼠近端结肠紧密连接蛋白Cgn,Ocln mRNA 表达无差异,Tjp1 mRNA 表达显著降低(P<0.05);与SHR模型组及Can 组比较,QYQ 治疗组近端结肠紧密连接蛋白Cgn,Ocln及Tjp1 mRNA表达显著升高(P<0.05)。
3 讨论
肠道是人体最大的免疫器官,肠粘膜上皮由单层细胞组成,对维持肠道稳态起着至关重要的作用,既作为物理屏障,又作为免疫防御屏障[3]。肠道屏障功能受损与许多疾病状态有关,包括肠道和全身。由于屏障功能障碍引起的肠通透性增加可能导致微生物移位[4]。可能引起各种疾病的低度炎症[5]。
FITC-dextran 是反映肠道对大分子物质渗透性的指标,用来评估肠上皮组织的紧密连接损伤。本课题组通过检测血清FITC-dextran 浓度发现,相比WKY 组大鼠,SHR 模型组大鼠肠道渗透性显著升高,QYQ 具有显著干预高血压相关肠道渗透性的改变。同时本课题组研究发现与20 周龄WKY 组相比,SHR 模型组回肠结肠粘膜表面糜烂明显,组织病理损伤评分显著升高及纤维化相对面积显著升高(P<0.05)。而QYQ治疗组回肠结肠组织病理损伤评分显著降低(P<0.05),肠道炎症情况显著改善,同时20周龄QYQ 治疗组回肠及结肠纤维化面积与SHR 模型组比较显著降低(P<0.05),提示QYQ 对高血压相关回肠及结肠组织损伤具有显著的干预效应。
紧密连接(Tight junctions,TJS)是上皮细胞和内皮细胞发挥生理功能的基本结构[6]。肠道上皮细胞通过紧密连接等结构形成屏障,维持人体健康[7]。在正常肠上皮组织中,扣带蛋白(Cingulin,Cgn)和闭合蛋白(Occludin,Ocln)等紧密连接蛋白构成紧密连接,对维持上皮结构和功能的完整及细胞的生长,代谢起重要作用[8]。紧密连接相关蛋白表达的改变,紧密连接中断,是肠黏膜屏障损伤和肠渗透性增加的一个关键因素[9],调节上皮紧密连接蛋白可加强上皮屏障功能的恢复[7,10]。
肠道物理屏障由肠上皮细胞及细胞间的连接组成,以Cgn、Ocln 及 紧密 连 接 蛋 白1(Tight junction protein1,Tjp1)为代表的紧密连接蛋白是肠道物理屏障的重要组成部分,肠屏障功能破坏,其结果将导致肠道内的细菌及毒素入血,加重全身炎症反应。通过调节紧密蛋白的表达和定位来调节上皮细胞的屏障功能是治疗一些疾病的一个潜在的新靶点[11]。
本课题组分析了不同周龄大鼠及药物干预后肠紧密连接蛋白mRNA 的表达变化。结果发现,相比WKY 大鼠,20 周龄SHR 模型组大鼠的回肠及结肠的相关紧密连接蛋白mRNA 表达显著降低,本研究结果与文献报道一致[12]。经QYQ 治疗可以显著增加20 周龄SHR 大鼠肠紧密连接蛋白Cgn、Ocln 及Tjp1 mRNA表达水平。
综上所述,清肝益肾祛风复方对高血压相关肠道屏障功能失调的干预效应可能与其调节肠道紧密连接蛋白的表达水平有关。
