基于PEG-PLGA和CMCS载体制备白藜芦醇纳米粒在结肠癌治疗中的应用*
2019-01-18王耀文张雪琼马静静汤明秀李佳明
王耀文,张雪琼,马静静,汤明秀,李佳明,邱 彤**
(1. 武汉理工大学化学化工与生命科学学院 武汉 430070;2. 武汉大学人民医院胃肠科 武汉 430060;3. 武汉理工大学生物医学材料与工程中心 武汉 430070)
结直肠癌(CRC)作为消化系统最常见的恶性肿瘤之一,已成为世界上第二大癌症相关死亡原因[1,2]。目前,化疗是结直肠癌最常见的治疗方法之一,奥沙利铂联合5-氟尿嘧啶/亚叶酸钙(5-FU/LV)作为晚期CRC 的标准一线化疗药物,已广泛应用于结肠癌临床治疗[3,4]。然而,长期使用化疗药物会引起一系列的副作用,如耐药性、神经毒性、骨髓抑制和肝毒性等[5]。因此,一些低毒高效的天然化合物逐渐成为结肠癌治疗的研究热点[6]。白藜芦醇(RES)是从葡萄、浆果、花生和红酒中提取的一种天然多酚化合物,由于其抗氧化、抗衰老、抗肿瘤活性以及心血管和神经保护作用,近年来引起了人们的广泛关注[7-9]。已有研究证明RES 预防结肠癌发生的能力与抑制肿瘤细胞周期和诱导结肠癌细胞死亡有关[10,11]。Jeong 等研究者发现RES 可通过分子靶点TCF4 诱导结直肠癌细胞凋亡[12]。DeMoulin 表明RES 可通过调整拓扑异构酶II 诱导结肠癌细胞DNA 损伤[13]。然而,由于RES 的溶解性差、生物利用度低、代谢快、光敏性差等缺点,其在体内外都难以发挥良好的生物活性[14]。纳米给药系统(NDDs)在提高亲脂性药物生物利用度方面具有巨大的潜力[15-17]。越来越多的载体被广泛地应用于控释或靶向给药系统,包括可溶性聚合物、脂质体、微球和纳米粒子(NPs)。NPs 可以携带药物在其内部或附着在其表面,从而实现被动或主动靶向给药。NPs 通过增强渗透和滞留(EPR)效应在肿瘤部位有效累积,延长药物在体内的半衰期[18]。聚乙丙交酯聚乙二醇共聚物(PEG-PLGA)共聚物作为药物载体,可保护药物的降解,并实现药物的缓释[19-21]。同时,羧甲基壳聚糖(CMCS))以其优异的水溶性、良好的生物相容性、生物降解性和低免疫原性等优点,也被广泛应用于纳米粒子的研究中[22-24]。
目前,RES 纳米粒在结肠癌治疗中的研究相对较少,本研究采用纳米沉淀法和乳化交联法分别制备了RES-PEG-PLGA NPs 和RES-CMCS NPs 纳米粒子[25,26],并进行了一系列表征。
1 材料与方法
1.1 试药和仪器
白藜芦醇(上海阿拉丁试剂有限公司),羧甲基壳聚糖(CMCS)(M=1×104,DD=85%,青岛弘海生物技术有限公司);聚乙丙交酯聚乙二醇共聚物(PEGPLGA)(济南岱罡生物工程有限公司);尼罗红(源叶生物技术科技有限公司);人结肠腺癌细胞(SW480 细胞)(上海赛百慷生物技术股份有限公司);CCK-8 试剂盒、4',6-二脒基-2-苯基吲哚(DAPI)、Leibovitz's L-15 培养基、胎牛血清(FBS)、青霉素(100 IU·mL-1)、链霉素(100 IU·mL-1)和胰蛋白酶(上海碧云天生物技术有限公司)。
紫外分光光度计UV-2600(香港岛津有限公司);Zetasizer 纳米粒度分析仪Nano-ZS90(Malvern);冷冻干燥机FD-1A-50(北京博医康实验仪器有限公司);恒温震荡箱KDC-ZS90(力康发展有限公司);酶标仪Multiskan GO-1510(Thermo-Scientific);细胞培养箱HF90(力康发展有限公司);激光共聚焦显微镜LabRAM HR800(Horiba Jobin Yvon)
1.2 纳米粒的制备
1.2.1 RES-PEG-PLGA NPs 和RES-CMCS NPs的制备
采用纳米沉淀法制备RES-PEG-PLGA NPs。将40 mg PEG-PLGA 和5 mg RES 溶解在300 μL 丙酮中,室温搅拌下,将丙酮溶液缓慢滴加到4 mL 去离子水中,得到乳状胶体悬浮液,在室温下搅拌过夜,待丙酮完全挥发。将反应液以5 000 rpm 转速,离心30 min,除去大颗粒。最后,在16 000 rpm 转速,4℃条件下离心1 h,沉淀用去离子水洗涤3 次。将沉淀层重悬,冷冻干燥,供进一步使用。
采用乳化交联法制备RES-CMCS NPs。用0.3%吐温溶液配2 mg·mL-1CMCS 溶液,过滤去除溶液中的杂质。将5 mg RES溶解在0.2 mL三氯甲烷中,缓慢滴入10 mL CMCS 溶液中,超声乳化10 min,得到初乳。磁力搅拌下将适量0.5 wt%CaCl2溶液逐滴滴加至乳液中,35℃温度条件下,磁力搅拌过夜至三氯甲烷完全挥发。在转速6 000 rpm,离心30 min,去除大颗粒和未包封的RES。最后,将纳米粒悬浮液在4℃,16 000 rpm条件下离心1 h。沉淀用去离子水洗涤3 次。将沉淀层重悬,冷冻干燥。
同时,按照上述方法制备未载药纳米粒PEGPLGA NPs 以及CMCS-NPs,作为空白纳米粒,并冷冻干燥,供进一步使用。
1.2.2 Nile red-RES-PEG-PLGA NPs 和Nile red-RES-CMCS NPs的制备
用尼罗红(Nile red)作为荧光探针标记纳米粒。将50 μL 尼罗红丙酮溶液(1 mg·mL-1)加入含40 mg PLGA-PEG和5 mg RES的300 μL丙酮溶液中。然后,采用上述纳米粒沉淀法制备Nile red-RES-PEGPLGA NPs。将120 uL 1 mg·mL-1尼罗红溶液(三氯甲烷为溶剂)滴加入已溶解5 mg RES 的0.2 mL 三氯甲烷中,混匀,将有机溶液缓慢滴入CMCS 溶液中,超声乳化10 min,得到初乳。磁力搅拌下将适量0.5 wt%CaCl2溶液逐滴滴加乳液中,35℃磁力搅拌过夜至三氯甲烷完全挥发。溶液以6 000 rpm 离心30 min,去除大颗粒和未包封的RES。最后,将纳米粒悬浮液以16 000 rpm转速,在4℃条件下离心1 h。沉淀用去离子水洗涤3 次,得到Nile red-RES-CMCS NPs。将Nile red-RES-PEG-PLGA NPs 和Nile red-RES-CMCS NPs 悬浮液冷冻干燥,供进一步使用。
2 RES-PEG-PLGA NPs 和RES-CMCS NPs的表征
2.1 粒径、zeta电位的测定
粒径和Zeta 电位通过动态光散射法(DLS)测量。待测试纳米粒子水溶液浓度为1 mg·mL-1,设置散射角为90°,测试温度为25℃,每个样品重复测试3次。
2.2 形态观察
将1滴纳米粒混悬液(1 mg·mL-1)滴在200目的铜网上,室温下自然干燥后在透射电镜(TEM)下观察。
2.3 包封效率(EE)和载药量(DL)的测定
用紫外可见光谱法测定了纳米粒子的包封率和载药量。将1 mg RES-PEG-PLGA NPs 粉末溶于1 mL DMF 中,对有机溶液定量稀释,进行含量测定。另外,
表1 平均粒径(PS)、多分散系数(PDI)和Zeta电位(n=3,±s)
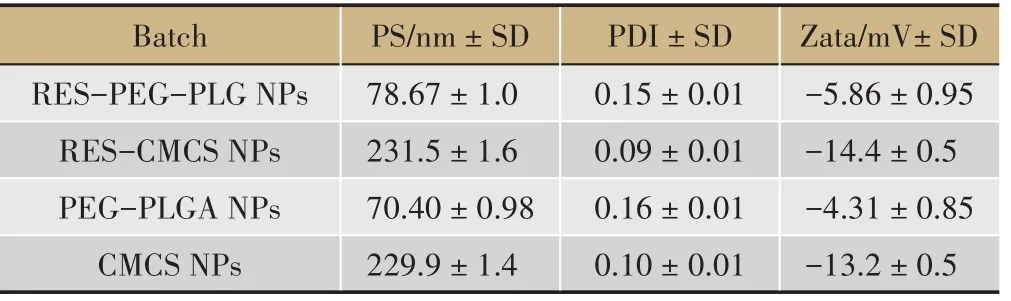
表1 平均粒径(PS)、多分散系数(PDI)和Zeta电位(n=3,±s)
Batch RES-PEG-PLG NPs RES-CMCS NPs PEG-PLGA NPs CMCS NPs PS/nm±SD 78.67±1.0 231.5±1.6 70.40±0.98 229.9±1.4 PDI±SD 0.15±0.01 0.09±0.01 0.16±0.01 0.10±0.01 Zata/mV±SD-5.86±0.95-14.4±0.5-4.31±0.85-13.2±0.5
1.2.1 中搅拌过夜的10 mL RES-CMCS NPs 溶液在6 000 rpm 转速、4℃下离心30 min,沉淀用去离子水冲洗两次。沉淀用DMF 完全溶解,定量稀释,在306 nm处用紫外可见光谱法对上述两种稀释溶液进行分析,并参照校准曲线(标准溶液范围为2-20 μg/mL,R2=0.9992)计 算。 EE% 和DL% 按下列公式计算,(1)和(2):

2.4 RES-PEG-PLGA NPs 和RES-CMCS NPs 体外释药研究
采用动态透析法测定两种纳米粒以及游离RES(free RES)的体外释药情况。制备了两种不同pH(pH7.4 和pH5.8)的磷酸缓冲液(PBS)作为释放介质,精确称取RES 原药以及纳米粒子冻干粉,分别溶解于5 mL 缓冲液中,装入透析袋(MWCO3500),扎紧后置于50 mL PBS 中,在(37±0.5)℃、100 r·min-1条件下恒温振荡,定时取样,并立即补加相同量的释药介质。样品过滤后用紫外可见光谱法测定白藜芦醇的含量,计算累积释放量。
2.5 体外抗肿瘤活性研究
以SW480结肠癌细胞为研究对象,运用CCK-8检测法考察纳米粒子对结肠癌细胞的抗增殖活性,从而评价其体外抗肿瘤的作用。取对数生长期的SW480细胞,用PBS 洗涤两遍以后,经胰蛋白酶消化,离心后在细胞培养液中重悬。将SW480 细胞悬液接种于96孔(5 000个细胞/孔)培养板中,于37℃,5%CO2细胞培养箱内孵育24 h,使细胞贴壁。每孔分别用不同浓度(0.1、0.5、5、10、20、40 μg·mL-1的RES)RES-PEGPLGA NPs 和RES-CMCS NPs 孵育24 h 和48 h。同时用不同浓度(0.1、0.5、5、10、20、40 μg·mL-1的药物载体)的空白纳米粒子PEG-PLGA NPs 和CMCS NPs 孵育24 h、48 h。每个浓度设置6 个复孔。培养24 h 和48 h后,弃去培养液,用无血清培养基洗涤3次。每孔加入100 μL 培养液(10%CCK-8,90%培养液),继续孵育4 h,用酶标仪于450 nm 波长处测定光密度值(OD),细胞活力可根据下列公式计算,(3):
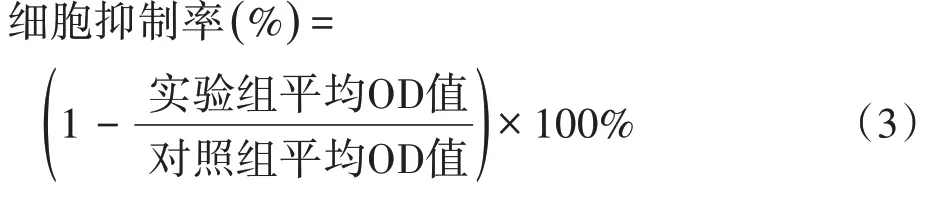
2.6 体外细胞摄取研究
用共聚焦激光扫描显微镜(CLSM)研究了纳米粒子在SW480 细胞中的摄取。将SW480 细胞分别接种于共聚焦培养皿中(1 × 106个细胞/孔),用2 mL 培养液孵育24 h。弃去培养液,加入分别含Nile red-RESPEG-PLGA NPs 和Nile red-RES-CMCS NPs 的 培养 液2 mL(Nile red浓度为5 μg·mL-1),于37℃、5%CO2细胞培养箱内孵育0.5、1、2 和4 h。在规定时间间隔内,弃去培养液,用PBS 洗涤3 次。用4%甲醛固定20 min后,用PBS 洗涤3 次。随后,用适量的DAPI 处理细胞15 min,用PBS 洗涤3 次。用CLSM 技术观察细胞荧光图像。
3 结果和讨论
3.1 平均粒径(PS)、多分散系数(PDI)和Zeta电位
RES-PEG-PLGA NPs 的 平均 粒 径为78.67 ± 1.0 nm,PDI 为0.15 ± 0.01。RES-CMCS NPs 的平均粒径为231.5±1.6 nm,PDI为0.09±0.01(表1)。两种纳米粒子分散体系均为典型的单分散体系,在图1 中呈单峰分布。RES-PEG-PLGA NPs 的粒径明显小于RESCMCS NPs,这可能是由于PEG-PLGA 两亲性共聚物能够在水中自组装形成粒径较小的胶束纳米粒子[27]。
3.2 形态观察
图3 为RES-PEG-PLGA NPs 和RES-CMCS NPs的TEM 图,均呈圆形或者类圆形,透射电镜下,RESPEG-PLGA NPs 粒径约为60 nm,RES-CMCS NPs 粒径约为180 nm。两者均小于DLS 法测得的平均粒径。可能是因为TEM 法是在干燥状态下测定粒径,而DLS法是在水溶液中测定,会受到溶胀效应的影响。
3.3 包封效率(EE)和载药量(DL)的测定
依据2.3 方法测定RES-PEG-PLGA NPs 和RESCMCS NPs 的包封效率(EE)和载药量(DL),结果如表2所示,
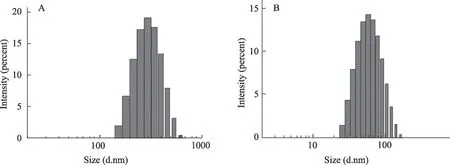
图1 粒径分布(A)Res-PEG-PLGA NPs和(B)Res-CMCS NPs
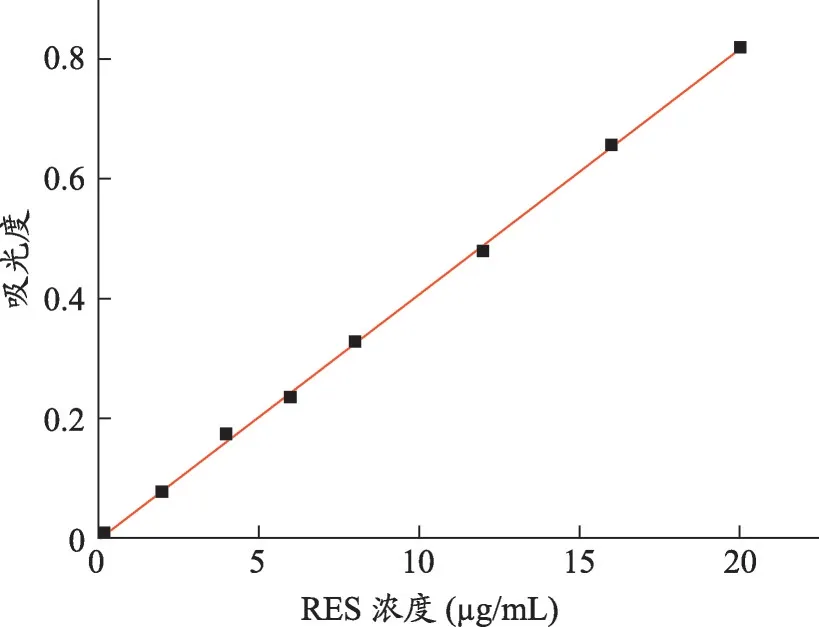
图3 RES在306 nm处的标定曲线
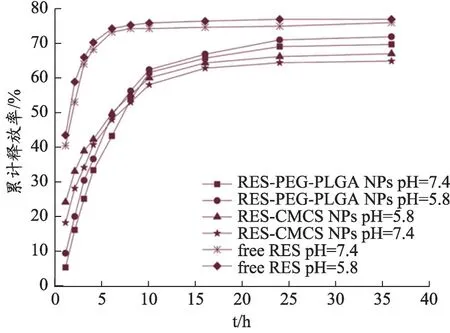
图4 体外药物释药曲线
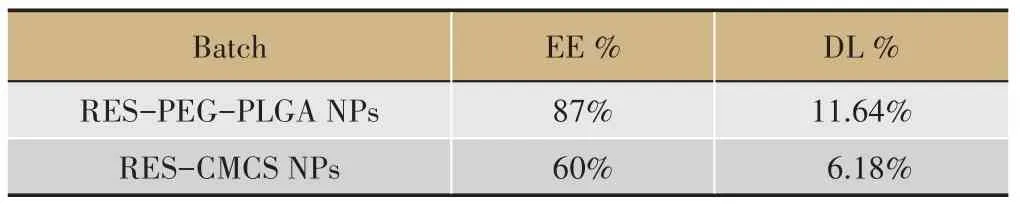
表2 包封效率(EE)和载药量(DL)
3.4 体外释药研究
图5 为RES-PEG-PLGA NPs 和RES-CMCS NPs在两种不同释药介质中的累积释放曲线。根据图4的校准曲线计算,在2 h,游离RES 的累积释放量达到了约55%,RES-PEG-PLGA NPs 和RES-CMCS NPs 的释放量分别约为15%和34%。在4h,游离Res 释放量达到了70%,RES-PEG-PLGA NPs 和RES-CMCS NPs 的释放量分别是32%和40%,结果表明两种纳米粒均具有一定的缓释作用,能显著延长RES 的释药时间,从而达到提高RES生物利用度的目的。
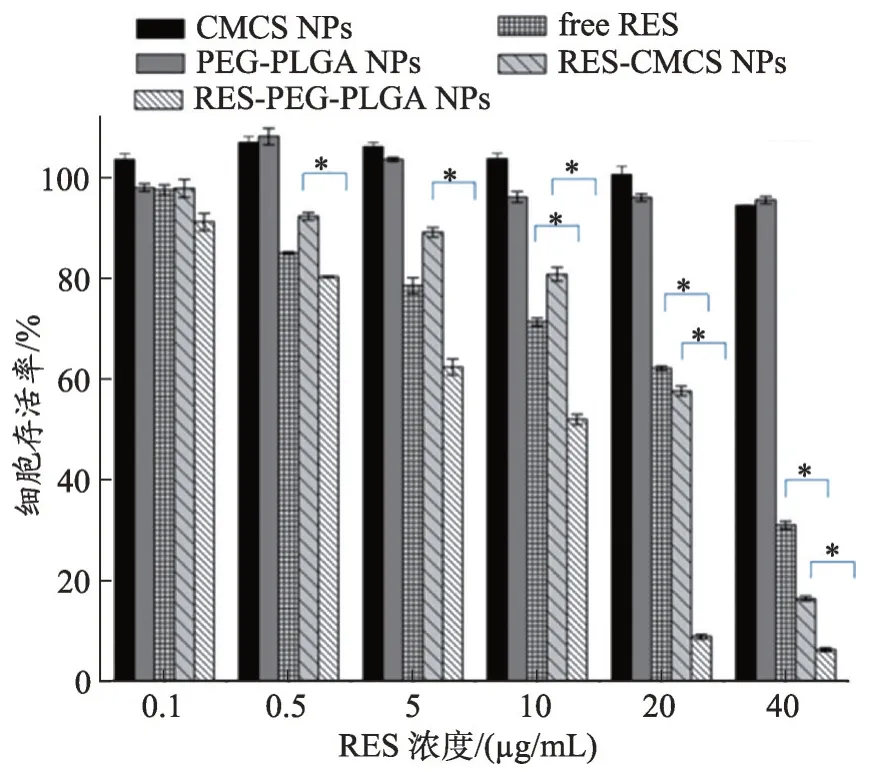
图5 不同浓度(0.1、0.5、5、10、20、40 μg·mL-1)游离RES、RES-CMCS NPs、RES-PEG-PLGA NPs、CMCS NPs、PEG-PLGA NPs对SW480细胞活力的影响。将S W480细胞孵育24 h,用CCK-8法测定细胞活力。
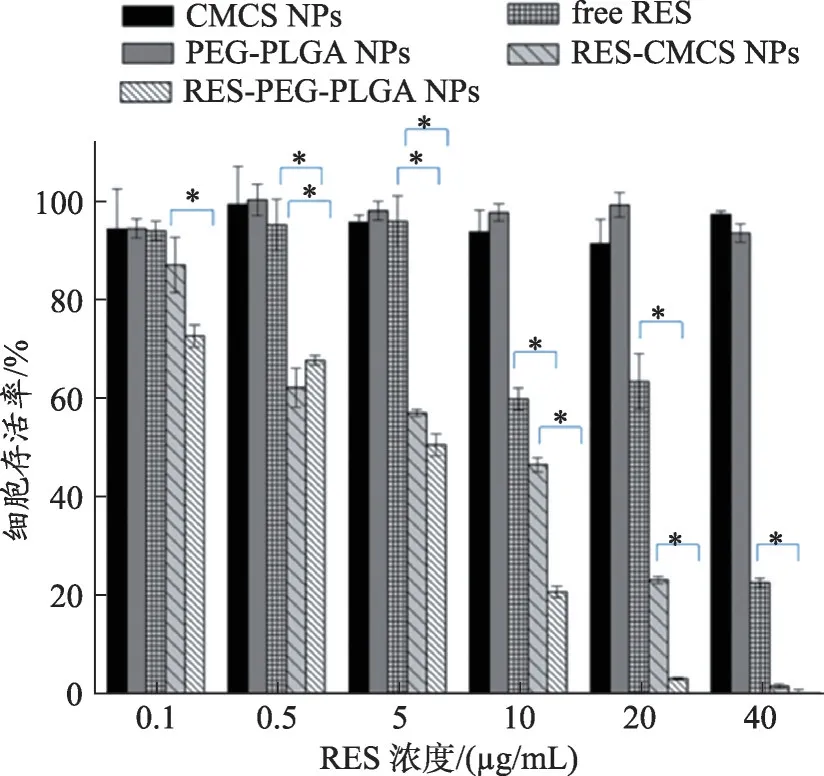
图6 不同浓度(0.1、0.5、5、10、20、40 μg·mL-1)free RES、RES-CMCS NPs、RES-PEG-PLGA NPs、CMCS NPs、PEG-PLGA NPs对SW480细胞活力的影响。将SW480细胞孵育48 h,用CCK-8法测定细胞活力
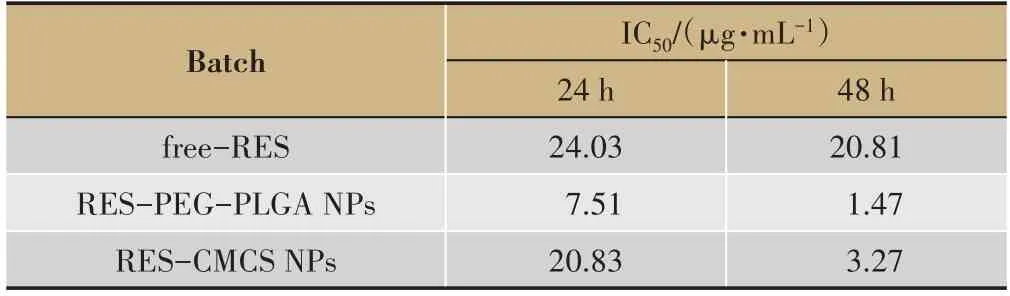
表3 RES-PEG-PLGA NPs和RES-CMCS NPs对SW480细胞的IC50值
3.5 体外细胞毒性
采用CCK-8法检测空白纳米粒子,游离RES 以及载药纳米粒子对SW480细胞体外细胞毒性。如图5和图6 所示,不同浓度的空白纳米粒PEG-PLGA NPs,CMCS NPs 对SW480 细胞几乎无毒性,该结果表明,CMCS 和PEG-PLGA 具有良好的生物相容性,可以用作理想的药物载体。当20 μg·mL-1游离RES、RESCMCS NPs和RES-PEG-PLGA NPs分别与SW480细胞孵育24 h 后,细胞存活率分别为61.84%、57.36%和8.73%。当浓度增加到40 μg·mL-1时,RES-CMCS NPs和RES-PEG-PLGA NPs 的细胞存活率分别下降到16.25%和6.13%。与游离药物相比较,RES-CMCS NPs 和RES-PEG-PLGA NPS对SW480 细胞表现出较高的细胞增殖抑制作用,并且对肿瘤细胞的抑制作用呈剂量依赖性和时间依赖性。同时,这些结果也表明,相 比RES-CMCS NPs,RES-PEG-PLGA NPS对SW480 细胞表现出更高的细胞毒性。这可能是由于纳米粒径大小之间的显著差异,RES-PEG-PLGA NPs粒径为78.67 ± 1.0 nm,与RES-CMCS NP(S231.5 ± 1.6 nm)相比,更易于被细胞摄取;另一方面,带有表面负电荷的CMCS与携带负电荷的肿瘤细胞膜之间的排斥作用可能导致纳米粒子在细胞内的摄取减少。
半数抑制浓度(IC50)计算结果如表3 所示,与SW480 细胞孵育24 h,游离RES、RES-CMCS NPs、RES-PEG-PL GANPs的IC50值分别为24.03 μg·mL-1、20.83 μg·mL-1和7.51μg·mL-1;孵育48 h 后,游离RES、RES-CMCS NPs、RES-PEG-PLGA NPs 对 应 的IC50值为20.81 μg·mL-1,3.27 μg·mL-1和1.47 μg·mL-1。结果表明,与游离RES 相比,RES-PEG-PLGA NPS和RES-CMCS NPS提高了RES 对结肠癌细胞的杀伤效率。
3.6 体外细胞摄取研究
用CLSM 研 究Nile red-RES-PEG-PLGA NPs 和Nile red-RES-CMCS NPs 分别与SW480 细胞孵育0.5、1、2、3 和4 h 后的细胞摄取。细胞核经DAPI 染色后呈蓝色荧光,荧光素尼罗红呈红色荧光。如图7 和图8所示,孵育0.5 h 和1 h 后,Nile red-RES-PEG-PLGA NPs 和Nile red-RES-CMCS NPs 组中细胞胞质和细胞核周围呈现微弱的红色荧光,继续培养2h 后,红色荧光明显增强。当孵育4 h 后,Nile red-RES-PEGPLGA NPs 组细胞核内的荧光强度明显高于Nile red-RES-CMCS NPs 组。原因可能是与Nile red-RESCMCS NPs 相比,粒径较小的Nile red-RES-PEGPLGA NPs 更容易被SW 480 细胞摄取;同时,Nile red-RES-CMCS NPs表面的负电荷可能通过排斥作用阻碍纳米粒在细胞中的摄取。这个结果与上述3.5 细胞毒性结果是一致的。图7 和图8 结果表明,这两种纳米药物给药系统在SW480 细胞中均可以有效内化并持续保留。
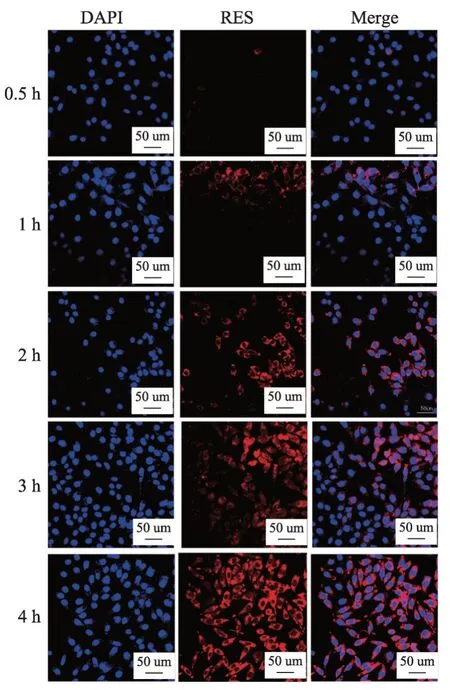
图7 RES-CMCS NPs的体外细胞摄取
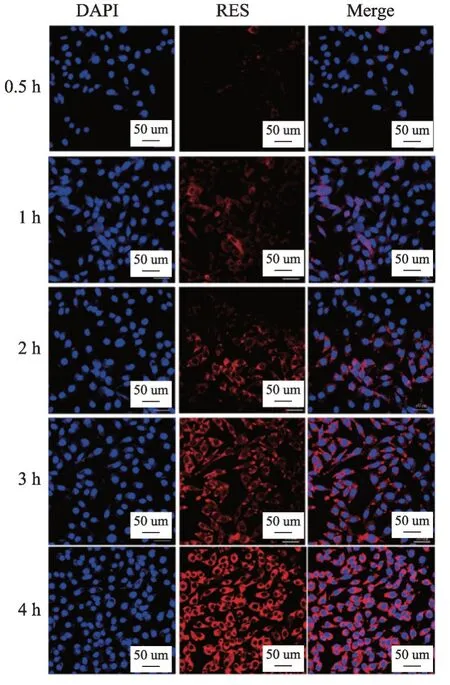
图8 RES-PEG-PLGA NPs的体外细胞摄取
4 总结
报道表明,用传统的化学疗法治疗恶性肿瘤时,小分子药物很容易被肾清除并在体内呈现非特异性分布,这样抗肿瘤药物就很难到达肿瘤部位;为了达到治疗浓度,抗肿瘤药物浓度被提高,这相应也会带来一系列的临床毒副作用[28]。考虑到以上情况,本文以生物相容性良好的CMCS 和PEG-PLGA 作为载体,成功制备了RES-PEG-PLGA NPs 和RES-CMCS NPs。综合实验结果表明,两种纳米给药系统RES-PEGPLGA NPs 和RES-CMCS NPs 对RES 均表现出较高的载药能力,分别为87%和60%。同时RES-PEG-PLGA NPs 表现出良好的平均水动力直径78.67±1.0 nm,可在实体肿瘤中被动聚集,通过增强通透性及滞留效应(EPR)增强药物的细胞毒性。与游离RES 相比,RESPEG-PLGA NPs 和RES-CMCS NPs 具有明显的缓释作用,同时可被SW480 细胞有效内化并抑制细胞增殖。另外,Yang S 等研究发现100 μM RES 作用于人结肠癌细胞HT29 细胞24 h 后,使HT-29 细胞的增殖减少了45.9%[29]。王纯忠等研究也表明RES 可诱导SW480细胞凋亡,将细胞阻滞于G1 期,其研究结果显示游离RES作用于SW480细胞24 h,IC50值为43.66 μg·mL-1;作用48 h,IC50 值为26.81 μg·mL-1[30]。而本课题实验结果表明,游离RES 与SW480 细胞共孵育24 h 和48 h后,其IC50 值分别为24.03 μg·mL-1和20.81 μg·mL-1;而RES 纳米粒子与SW480 细胞共孵育24 h 和48 h后,其IC50 值最低分别降低 至7.51 μg·mL-1和1.47 μg·mL-1,大大降低了RES 抗结肠癌治疗浓度。结合文献报道和本研究结果表明,RES 纳米粒子增加了水难溶性RES 的溶解度,增强了RES 对结肠癌细胞增殖的抑制作用,达到了药物缓释效果,提高了RES的生物利用度,为临床结肠癌治疗提供了一定的实验依据,同时也证明了纳米药物传递系统在肿瘤治疗有良好的应用前景。
