姜黄素治疗骨性关节炎药理的研究进展*
2019-01-18夏天卫刘金柱崔婧娴环大维沈计荣
夏天卫,刘金柱,崔婧娴,环大维,沈计荣
(南京中医药大学附属医院 南京 210029)
骨性关节炎(osteoarthritis,OA)是常见的骨关节疾病,尚无有效的治疗药物,造成极大的经济与社会负担。中医多将OA 称为“痹证”,自《黄帝内经》开始就有大量关于痹证的文献记载,故从中医中挖掘治疗OA的药物具有重要意义。
姜黄是中医常用药,为姜科姜黄属植物姜黄的根茎,性温味苦,归肝、脾经,有破血通经、行气止痛之效。《新修本草》曰:“主心腹结积,下气,破血,除风热,消痈肿,功力烈于郁金”。《杨氏家藏方》中蠲痹汤即用姜黄配伍当归、白芍等主治手足冷痹,腰膝沉重。
姜黄素[C21H20O6,1,7-二-(4-羟基-5-甲氧基苯基)-1,6-庚二烯-3,5-二酮](图1)是姜黄的主要活性成分(含量3-5%),为橙黄色结晶粉末,相对分子质量368。联合国食品添加剂联合专家委员会和欧盟食品安全委员会联合评定认为姜黄素不对人与环境构成任何威胁。研究发现姜黄素类具有抗氧化[1]、抗炎[2]、抗癌[3]、抗阿尔茨海默病[4]、治疗糖尿病等多种活性[5]。现主要介绍姜黄素治疗OA 基础药理与临床药理的研究进展。
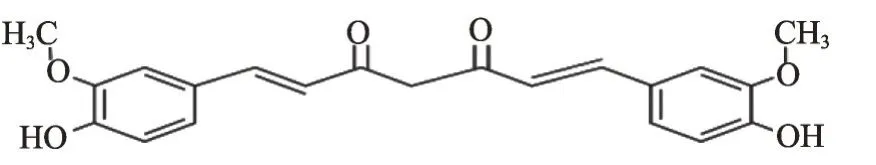
图1 姜黄素化学结构
1 基础药理研究进展
1.1 抑制关节炎症
1.1.1 结构特点
姜黄素抗炎的活性基团是苯丙酞基,1,3-酮基是其发挥抗炎活性的必需基团,而苯环上的4-酚羟基和侧链α、β-不饱和羰基中的双链可增强其抗炎活性。
1.1.2 机制
核因子-κB(nuclear factor-κB,NF-κB)信号通路在OA 进程中发挥重要作用。当细胞受到外环境刺激时,丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)途径、核因子-κB 诱导激酶-1(NF-κB inducingkinase-1,NIK)等相继激活,进而激活κB 抑制蛋白激酶(inhibitoryκB protein kinase,IKK),导致κB抑制蛋白(inhibitoryκB proteins,IκB)磷酸化、与NF-κB分离。NF-κB 入核与炎症介质靶基因启动子区的κB位点相结合,增强炎症反应相关基因的表达。姜黄素能够抑制人软骨细胞中IKK 的激活,抑制IkBα磷酸化,抑制NF-κB 信号通路,进而抑制环氧化酶2(cyclooxygenase-2,COX-2)基因和一氧化氮合成酶(inducible nitric oxide synthase,iNOS)基因的转录(图2)。
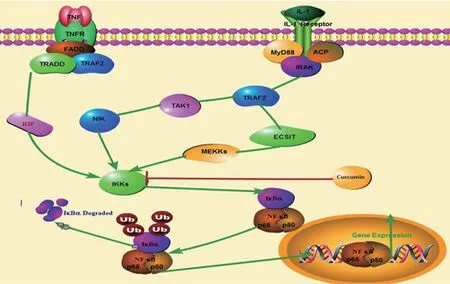
图2 抗炎NF-κB信号通路作用机制示意
NOD样受体3(NOD-like receptor protein 3,NLRP3)是在胞浆内广泛表达的模式识别受体,在病原/损伤相关分子模式(pathogen/damage-associated molecular pattern,P/DAMP)的刺激下,NLRP3 可以和凋亡相关点状蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)、半胱天冬氨酸蛋白酶(Caspase-1)形成炎症小体。Toll 样受体激动剂[如脂多糖(lipopolysaccharide,LPS)]和细胞因子[如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)]能激活NLRP3 基因的转录,进而激活非活性状态的Caspase-1(pro-Caspase-1)、活性状态的Caspase-1,促进炎症。OA 时NLRP3 表达增高[6],NLRP3 激活Caspase-1,后者参与白介素-1β(interleukin-1β,IL-1β)、IL-18 的产生与分泌,加剧OA 进程。Yufeng Sun 等用LPS 和三磷酸腺苷(ATP)诱导人单核巨噬细胞系发现,姜黄素能够抑制NLRP3 的表达、活化与释放,抑制pro-Caspase-1、Caspase-1、炎症因子的表达,延缓OA进程[7]。
激活蛋白-1(activator protein-1,AP-1)是一种促炎转录因子,参与调控ILs 和金属蛋白酶(matrix metalloprotease,MMPs)的表达。姜黄素能够抑制AP-1的激活,抑制炎症。
姜黄素还能抑制炎症反应上游磷脂酶A2(phospholipase A2,PLA2)、COX-2、5-脂氧化酶(5-lipoxygenase,5-LOX)、iNOS的活性,进而抑制中游IL-1β、IL-6、IL-8、TNF-α等炎症因子的产生,再进而抑制下游MMP-3、MMP-9等对软骨基质的分解作用[8-10]。
1.1.3 相关实验简介
Yufeng Sun 等构建了小鼠内侧半月板不稳定(destabilization of the medial meniscus,DMM)的模型,实验组每天腹腔注射50 mmol·L-1姜黄素,发现姜黄素能够降低IL-1β、干扰素-γ(interferon-γ,IFN-γ)、IL-17α、IL-18、TNF-α、血管细胞粘附分子1(vascular cell adhesion molecule 1,VCAM1)的表达,抑制小鼠OA 的炎症反应[7]。Zhuo Zhang 等发现小鼠口服姜黄素能够减缓OA 进程。免疫荧光显示局部外用的姜黄素纳米微粒可渗透进小鼠的髌下脂肪垫。组织学染色显示姜黄素微粒能够减轻小鼠滑膜炎;实时定量聚合酶链式反应(RT-qPCR)检测显示姜黄素微粒能够减少其髌下脂肪垫内脂肪因子(脂肪酶、脂联素、瘦素)、炎症相关转录因子(转录因子CCAAT 增强子结合蛋白β、过氧化物酶体增殖物激活受体-γ激动剂)、促炎因子的表达[11]。
1.2 抑制氧化
1.2.1 结构特点
姜黄素具有酚羟基、甲氧基、β-二酮3个抑制氧化的活性部位。Chen 等证明在pH6.8 的环境下,姜黄素抗氧化活性由酚羟基决定;而在pH8.0的环境下,则由酚羟基、甲氧基与1,3-二酮结合形成的双烯系统共同决定[13]。
1.2.2 机制
自由基是一种强氧化基团,病理状态下机体产生大量活性氧自由基(reactive oxygen species,ROS)与活性氮自由基(nitrous oxide systems,NOS),造成一系列损伤。OA 中,ROS 和RNS 升高,能够抑制Ⅱ型胶原、蛋白多糖等软骨基质的合成,同时加速其分解。姜黄素活性部位在抗氧化过程中提供质子,可有效清除自由基[12]
姜黄素可通过调控转录因子核因子E2 相关因子
2(nuclear factor-E2- related factor 2,Nrf2-ARE)、NF
κB、MAPK、Notch、AMP 相关蛋白激酶(AMP-activated protein kinase,AMPK)、还原型烟酰胺腺嘌呤二核苷酸 磷 酸/活 性 氧(nicotinamide adenine dinucleotide phosphate-oxidase/ROS,NADPH/ROS)等信号通路增加抗氧化酶活性、调控氧化应激。姜黄素能够促进Nrf2-Keap1 解偶联,导致Nrf2 入核,上调血红素加氧酶(HO-1)表达,抑制NF-κB 活化,抑制炎性因子分泌,降低氧化应激损伤[14-15]。在Notch1 信号通路中,姜黄素能够下调发状分裂相关增强子(hairy enhancer of split,Hes1)、Notch、Caspase-3的表达,上调Bac-2的表达,减少ROS 和乳酸脱氢酶(lactate dehydrogenase,LDH)的释放,增加抗氧化的丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathioneperoxidase,GSH-Px)活性[16]。
1.2.3 相关实验简介
李旭升等给OA 小鼠腹腔注射100mg/kg 姜黄素,发现姜黄素治疗组软骨细胞中p-两面神激酶2(pjanus kinase 2,p-JAK2)、p-信号转导及转录激活蛋白3(p-signal transductors and activators of transcription 3,p-STAT3)表达升高,促凋亡的Bax 蛋白表达降低,线粒体琥珀酸脱氢酶(succinodehydrogenase,SDH)和细胞色素C 氧化酶(cytochrome c oxidase,COX)表达升高。提示姜黄素激活JAK2/STAT3信号通路,增强软骨细胞线粒体抗氧化应激能力,延缓其退变[17]。Nora M.Aborehab 等使用含有姜黄混合物喂养大鼠后,发现软骨中SOD、MDA 水平升高,提示潜在活性成分姜黄素具有抗氧化作用[18]。
1.3 抑制软骨基质分解和促进软骨基质修复
1.3.1 抑制软骨基质分解
IL-1β、IL-6、TNF-α等炎症因子通过促进mRNA的表达增强各种MMPs(MMP-1、3、13 等)的合成、分泌,MMPs 参与降解软骨基质蛋白。含有血小板凝血酶敏感蛋白结构域的解聚素与金属蛋白酶5(a disintegrin and metalloproteinase with thrombospondin motifs,ADAMTS-5)能降解蛋白多糖,亦造成软骨损伤。刘巍等用IL-lβ刺激兔软骨细胞,发现姜黄素显著抑制IL-8 和可溶性黏附分子l(soluble intercellular adhesion molecule 1,sICAM-l)的分泌,对软骨有保护作用[19]。Shakibaei 等发现姜黄素抑制IL-1β/TNF-α诱导的人软骨细胞MMP-3、MMP-9的表达[20]。孙达锋等发现关节腔注射姜黄素能显著缓解软骨的退变[21]。Zhuo Zhang 等发现局部外用姜黄素纳米微粒抑制MMP-1、ADAMTS-5 的表达,减少Ⅱ型胶原和蛋白多糖的分解,减轻软骨损伤[11]。关节软骨损伤时,软骨寡聚基质蛋白(cartilage oligomeric matrix protein,COMP)分泌增加。Nora M.Aborehab 等使用含有姜黄混合物喂养大鼠后,发现大鼠软骨组织中IL-1β、COMP、透明质酸(hyaluronic acid,HA)水平明显降低,提示潜在活性成分姜黄素发挥软骨保护作用[18]。
1.3.2 促进软骨基质修复
整合素介导的力化学通道参与OA 软骨细胞外基质的合成,多种应力刺激均可通过激活细胞表面的整合素发挥软骨修复作用。Shakibae 等发现姜黄素显著增强软骨细胞Ⅱ型胶原、软骨特异性糖蛋白(chondroitin sulfate proteoglycans,CSPGs)、β1整合素的表达[20]。
1.4 影响细胞凋亡
1.4.1 抑制软骨细胞凋亡
正常情况下,浅表层的软骨细胞高表达微管相关蛋 白1轻链(microtubule-associated protein 1 light chain 3,LC3)和Beclin1,参与维持软骨细胞自噬与稳态。LC3在核内经去乙酰化等修饰后,转运至胞质内,变成胞浆型LC3(LC3-Ⅰ)。自噬时LC3-I 被酶解为LC3-Ⅱ并定位于自噬体膜上,直到与溶酶体融合。同时Beclin1 参与形成Beclin1-Ⅲ型磷脂酰肌醇-3 激酶(PI-3K)复合体,促进自噬。中晚期OA 软骨细胞的自噬水平下降,LC3Ⅱ等表达水平下降,凋亡增加,退变明显[22]。细胞衰老退变时线粒体内细胞色素C 外漏,Caspase级联激活,导致细胞凋亡,而抗凋亡蛋白Bcl-2能够阻止线粒体里细胞色素C的释放。
体外实验发现姜黄素一方面增强细胞外信号调节 激 酶1/2(extracellular regulated protein kinases,ERK1/2)磷酸化、激活MAPK/ERK1/2 信号通路,促进自噬相关蛋白LC3-Ⅱ和Beclin1 的表达、促进自噬;另一方面增加Bcl-2 的表达、抑制参与裂解DNA 并执行细胞凋亡的Caspase-3酶的活性,共同抑制IL-1β诱导的软骨细胞凋亡(图3)[23,24]。姜黄素还能增加抗凋亡蛋白Bcl-xL的表达[25]。
1.4.2 促进滑膜细胞凋亡
姜黄素能够增强塞来昔布促进OA 滑膜细胞凋亡的效果。但体外促进滑膜细胞凋亡所需的姜黄素局部浓度远高于口服姜黄素时血浆中最高浓度[26]。
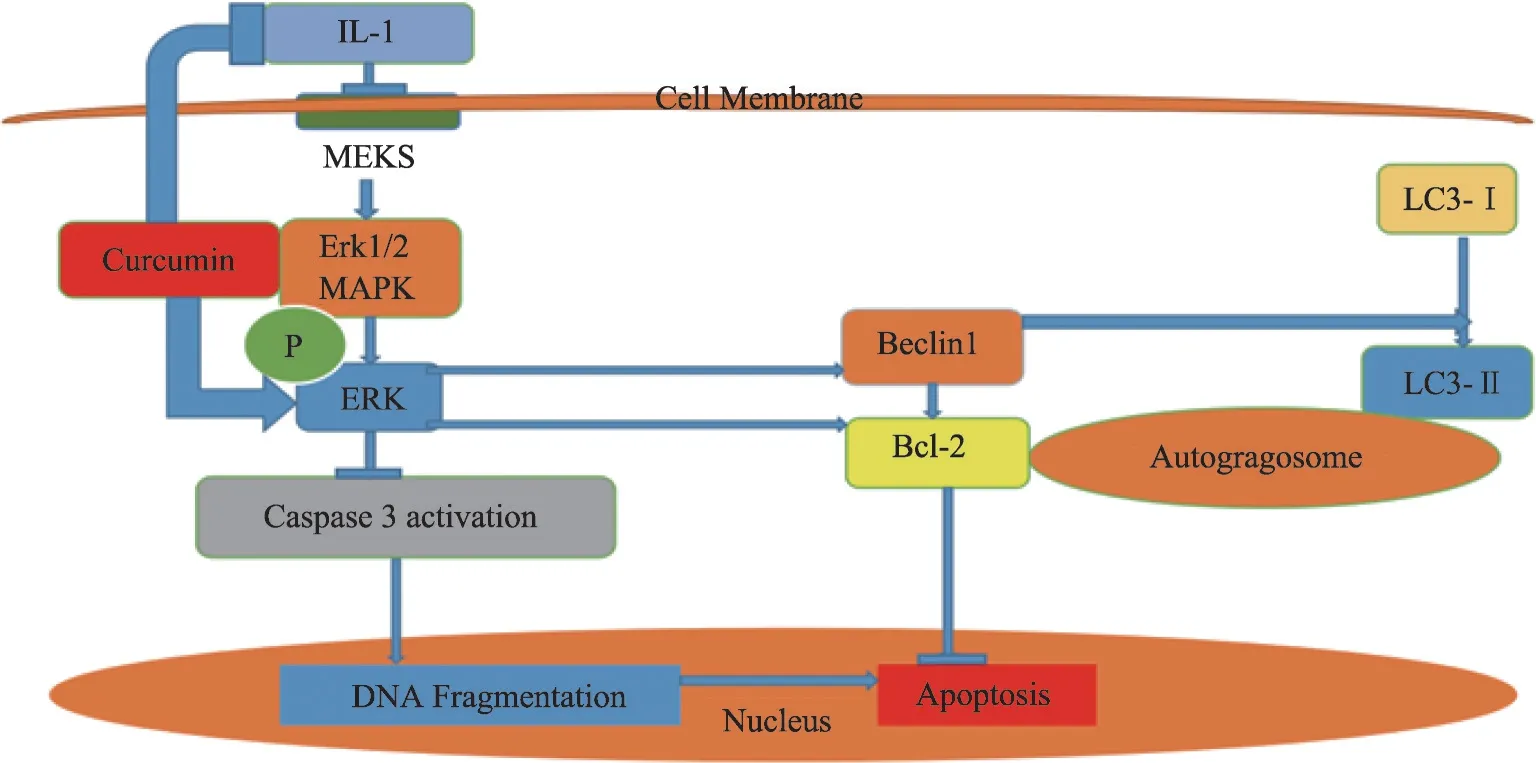
图3 抗凋亡作用机制示意
1.5 调节软骨细胞增殖
体外细胞培养发现姜黄素低浓度时促进软骨细胞增殖,高浓度时抑制软骨细胞增殖。马勇等发现:①姜黄素通过促进Wnt 信号分子与细胞膜上Frizzled蛋白结合,激活胞内散乱的蛋白,使糖原合成酶激酶-3β(glycogensynthase kinase-3β,GSK-3β)失活,使胞质内β-环连蛋白(β-catenin)积累,继而更多的入核诱导基因转录,产生促进细胞增殖分化的蛋白,发挥保护软骨的作用。②姜黄素对正常软骨细胞具有促增殖作用,在10 μmol·L-1浓度、作用24 h 条件下促增殖效果最显著[27]。陈琼等发现姜黄素对软骨细胞增殖的抑制作用具有特异性:40 μmol·L-1以上姜黄素对OA 软骨细胞有抑制效应,而80 μmol·L-1以上姜黄素对正常软骨细胞才发挥抑制效果[28]。
1.6 维持成骨活性与抑制破骨活性
姜黄素脂质体能下调炎症因子的表达维持成骨细胞的活性,上调骨保护素(osteoprotegerin,OPG)/核因子kB 受体活化因子配体(receptor activator of NFκB ligand,RANKL)的比例抑制破骨细胞的活性,抑制OA 进程[29]。WEI SHANG 等发现姜黄素通过抑制MAPK/核因子κB 受体活化因子(receptor activator of NF-κB,RANK)/c-Fos/核因子活化的T细胞C1(nuclear factor of activated T-cells 1,NFATc1)信号通路,抑制破骨细胞活性[30]。
2 临床药理试验进展
通过Pubmed、Cochrane Library、Embase 等检索发现临床随机、对照试验(randomized controlled trial,RCT)8 篇。Nakagawa 的试验组每天口服Theracurmin(含180 mg 姜黄素),1 天6 片。治疗8 周后,试验组VAS评分和对塞来昔布的依赖性明显降低[31]。Belcaro的试验组每天服用500 mg Meriva(含100 mg 姜黄素)和500 mg 氨基葡萄糖,4 个月后试验组各项评分(WOMAC评分、Karnofsky指数评分、平板试验)显著改善[32]。Chandran 的试验组每天给予1000 mg 姜黄素,连续6 周[33];Pinsornsak 的试验组每天给予500 mg 姜黄素,连续8 周[34];Madhu 的试验组每天给予500 mg 姜黄素,连续6 周[35];Pannahi 的试验组每天给予1500 mg 姜黄素,连续6周[36];Kuptniratsaikul的试验组首次试验每天给予1000 mg 姜黄素,连续6 周,二次试验每天给予1500 mg 姜黄素,连续4 周[37,38],均取得较好疗效[33-38]。有学者对上述文献进行Meta 分析显示每天口服1000 mg 姜黄素有显著治疗OA 效果[39]。与非甾体类抗炎药不同,姜黄素对胃肠道黏膜有保护作用,但仍需长期大样本临床研究证实[40]。
3 问题、对策与展望
姜黄素不溶于水,在各溶剂中的溶解度偏低。口服姜黄素在小肠的吸收率低,在肝脏中代谢快,稳定性差,生物利用度仅1%。有学者认为在常规的药物化学筛选中姜黄素自身能散发荧光,是“泛筛选干扰化合物(pan-assay interference compounds,PAINS)”;同时能破坏细胞膜,干扰药物筛选试验。姜黄素渗透性低,剂量分布不均[41],缺乏专一靶向,代谢时降解成具有多种化合物。这些化合物自身也可能散发荧光,故有学者认为姜黄素是“无效的代谢万能药(invalid metabolic panaceas,IMP)”。有研究报道姜黄素不能抑制IKK 的激活,不影响IκBα的表达和降解。有实验报道姜黄素增加体外C-28/12 软骨细胞系表达MMP-3和ADAMTS5[42]。还有关于姜黄素螯合铁离子、影响铁代谢的报道。
目前已有大量研究试图解决姜黄素的前四点不足:有学者尝试用环糊精技术、制成胶束[43]、制成高分子共聚物[44]等手段提高姜黄素的溶解度、缓释性。有学者发现用环糊精加磷脂技术修饰姜黄素,能进一步提高其水溶性、生物利用度[45]。有学者发现通过脂质体的分子间自组装技术包裹姜黄素后,能减少降解和生物转化[46]。Michal Heger 等认为荧光筛选实验有不可低估的价值,在《Nature》上论证不认可姜黄素是“PAINS”[47]。有学者通过把姜黄素制成微乳、微球、纳米粒[48]来改善其稳定性、生物利用度,同时赋予其缓释和靶向性能。针对第五、六点问题,有学者认为这可能和体外软骨培养模型不同相关[42]。治疗OA 的姜黄素每日剂量一般小于2000 mg,该剂量下尚未发现影响铁代谢。
笔者认为研发与应用姜黄素治疗OA 具有广阔的前景,建议未来的研究可从以下3个方面深入:①探究姜黄素的不同给药途径(如口服、局部经皮外用、关节腔注射等)对其治疗作用的影响,寻找姜黄素治疗OA的最佳给药方式、给药浓度与给药剂量。②对如何提高姜黄素的稳定性、水溶性、生物利用度等进行研究(如以姜黄素为先导,研发其衍生物、类似物、全合成产物等)。③有学者研究发现姜黄的其他有效成分(如芳姜黄酮)也具有抗炎等活性[49],故未来还可以对姜黄的其他有效部位及成分展开研究。
