补阳还五汤调控小胶质细胞/巨噬细胞极化抑制大鼠脑缺血后炎症反应研究
2019-01-18甘海燕李琳杨琰诸葛陆杰储利胜
甘海燕李琳杨琰诸葛陆杰储利胜
1.浙江中医药大学药学院 杭州 310053 2.浙江中医药大学基础医学院
缺血性脑卒中是中枢神经系统最常见的疾病,也是成年人致死致残的主要原因之一。脑缺血损伤的发病机制非常复杂,其中继发性炎症反应在脑缺血损伤中发挥重要作用[1-2]。小胶质细胞(microglia)是脑内固有的免疫细胞,早期研究认为脑缺血后小胶质细胞迅速被激活,并聚集到损伤部位,释放炎症介质并募集其他炎症细胞,加剧脑损伤[3-4]。
小胶质细胞有静息态和激活态,激活的小胶质细胞有经典激活的M1型和替代激活的M2型两种表型,与巨噬细胞在形态和表型上相似,两者很难区分。近年来研究发现,激活的小胶质细胞/巨噬细胞在脑缺血损伤中发挥损伤和修复的双重作用[5-6]。其中M1型小胶质细胞/巨噬细胞释放诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)以及促炎因子肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6) 和一氧化氮(nitrogen monoxide,NO)等加剧神经损伤,而M2型小胶质细胞/巨噬细胞释放抗炎因子白细胞介素-10(interleukin-10,IL-10)、转化生长因子-β(transforming growth factorβ,TGF-β)以及胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)等,促进炎症消退和神经修复。Hu等[7]研究发现脑缺血后激活的小胶质细胞/巨噬细胞表型呈动态改变,早期以M2型为主,随后逐渐向M1型转化。激活的小胶质细胞/巨噬细胞具有损伤和修复的双重作用提示脑缺血治疗应从单纯抑制小胶质细胞/巨噬细胞激活转向调控M1/M2表型的平衡。
补阳还五汤(Buyang Huanwu Decoction,BYHWD)具有益气活血通络的功效,是中医治疗脑缺血的代表方剂。大量临床和动物实验证实BYHWD对脑缺血损伤具有保护和修复作用,机制包括抗氧化、抗凋亡、抗炎、促进血管生成和神经发生等[8-10]。本研究旨在从调控小胶质细胞/巨噬细胞极化角度探讨BYHWD对脑缺血后神经炎症的影响。
1 材料和方法
1.1 实验动物 SPF级健康雄性SD大鼠30只,3~4月龄,体质量280~300g,由上海西普尔-必凯实验动物有限公司提供[实验动物生产许可证号:SCXK(沪)2013-0016],饲养于浙江中医药大学动物实验研究中心屏障实验室 [实验动物使用许可证号:SYXK(浙)2013-0184],环境温度(22±2)℃,相对湿度50%~60%,光照12h/12h明暗交替,自由饮食。
1.2 药物 补阳还五汤处方来自《医林改错·卷下·瘫痿》:“此方治半身不遂,口眼歪斜,语言蹇涩,口角流涎,大便干燥,小便频数,遗尿不禁。”[11]处方组成:黄芪 120g,当归 6g,川芎 4.5g,赤芍 4.5g,地龙 3g,红花3g,桃仁3g,以上药材均购自浙江中医药大学附属门诊部。将药物加水浸泡1h,水煎2次,每次40min,合并后浓缩为含生药2g·mL-1的水煎液,冷却后放置4℃冰箱保存。
1.3 试剂 兔抗Iba1购于日本Wako公司(批号:LKG5732);鼠抗CD16/32购于美国BD公司(批号:5342941);山羊抗CD206为美国RD公司产品(批号:WFT0116121);FITC 标记的羊抗兔二抗、Cy3 标记的羊抗鼠二抗、FITC标记的驴抗羊二抗均购自北京中杉金桥生物技术有限公司(批号:123962、131209、125606);Cy3 标记的驴抗兔二抗购自美国Jackson ImmunoResearch公司(批号:711165152);Triton X-100、DIPA、羊血清均购自上海碧云天生物技术有限公司(批号:13993V11、K172720E、C0205);RNAiso Plus、SYBR Premix Ex TaqTM、Prime ScriptTMRT Master Mix、RNase-free Water均购自宝生物工程(大连)有限公司(批号:AA4301-1、AKA8605、AK5402、A3801A)。
1.4 主要仪器 冰冻切片机(美国 Thermo Fisher公司,型号:MH550);倒置荧光显微镜(德国 Leica公司,型号:DMIL);实时荧光定量PCR仪(Applied Biosystems,型号:7500);高速冷冻离心机(德国 Eppendorf公司,型号:Centrifuge 5424R);RNA 反转录仪(美国BIO-RAD公司,型号:T100TMThermal Cycler);紫外可见分光光度计(美国Thermo公司,型号:Nano drop 2000c)。
1.5 方法
1.5.1 大鼠局灶性脑缺血模型的建立 参照Longa等[12]的方法建立大鼠大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)模型。采用10%水合氯醛以350 mg·kg-1的剂量对大鼠进行腹腔注射麻醉,依次分离右侧颈总动脉、颈外动脉、颈内动脉,结扎并游离颈外动脉主干,在颈外动脉剪一小口,经颈外动脉将栓线轻轻插入颈内动脉,当尼龙线插入距颈总动脉分叉18~20mm处时可感轻微阻力,停留90min后,将栓线轻轻拔出恢复血流灌注。结扎颈外动脉,缝合皮肤。术中用加热毯和白炽灯加热,维持大鼠肛温在37℃左右,术后将大鼠置于恒温箱中直至苏醒。假手术组,栓线只插入5mm左右。
1.5.2 大鼠分组与给药 采用完全随机法将大鼠分为假手术组、模型组、BYHWD 3组,每组10只。给药剂量按人与动物间体表面积折算的等效剂量,BYHWD 组在缺血后 24h每日灌胃 13g·kg-1,1次/d,共14d[10]。假手术组和模型组灌服等容量的0.9%氯化钠溶液。
1.5.3 免疫荧光双标染色检测小胶质细胞/巨噬细胞表型 缺血模型建立后第14天,将大鼠麻醉后插管,经左心室插管灌注0.9%氯化钠溶液快速冲洗,4%多聚甲醛灌流固定,分离脑组织,经后固定、脱水后,采用冰冻切片机制备8μm的切片。免疫荧光双标具体步骤:0.3%Triton X-100室温破膜,3%H2O2灭活内源性过氧化物酶,血清封闭,分别加入M1型小胶质细胞/巨噬细胞表面标记物兔抗Iba1/鼠抗CD16/32(1:200),M2型小胶质细胞/巨噬细胞表面标记物兔抗I-ba1/山羊抗 CD206(1:100),4℃过夜后加入 FITC-羊抗兔/驴抗山羊和Cy3-羊抗鼠/驴抗兔标记荧光二抗(1:100),室温避光孵育1h,用含有DAPI的封片剂封片,荧光显微镜下观察并拍照。每张切片任选不重复的3个视野,计数双标细胞数,取平均值作为测量值。
1.5.4 qRT-PCR检测小胶质细胞/巨噬细胞表面标记物 用Trizol法提取总RNA,根据TaKaRa公司SYBR PrimeScript RT-PCR试剂盒说明书将RNA逆转录为cDNA。按照Takara SYBR Premix Ex TaqTM试剂盒进行qRT-PCR检测。反应体系如下:2×SYBR Premix Ex TaqⅡ 5.0μL、10μmoL·L-1上下游引物各0.4μL、50×ROX Reference DyeⅡ 0.2μL、cDNA 1.0μL、ddH2O 3.0μL。反应程序:95℃预变性 30s,95℃ 5s,60℃ 30s,40 个循环;95℃ 15s,60℃ 1min,95℃ 15s。PCR反应结束后确认扩增曲线和熔解曲线,以GAPDH为内参,采用2-ΔΔCt法分析mRNA相对表达量。PCR引物引物均由上海生工生物工程有限公司合成,序列见表1。
1.6 统计学分析 应用SPSS 17.0统计软件进行统计学分析,计量资料以±s表示,组间比较采用单因素方差分析 (Student-Newman-Keuls)。以P<0.05为差异有统计学意义。
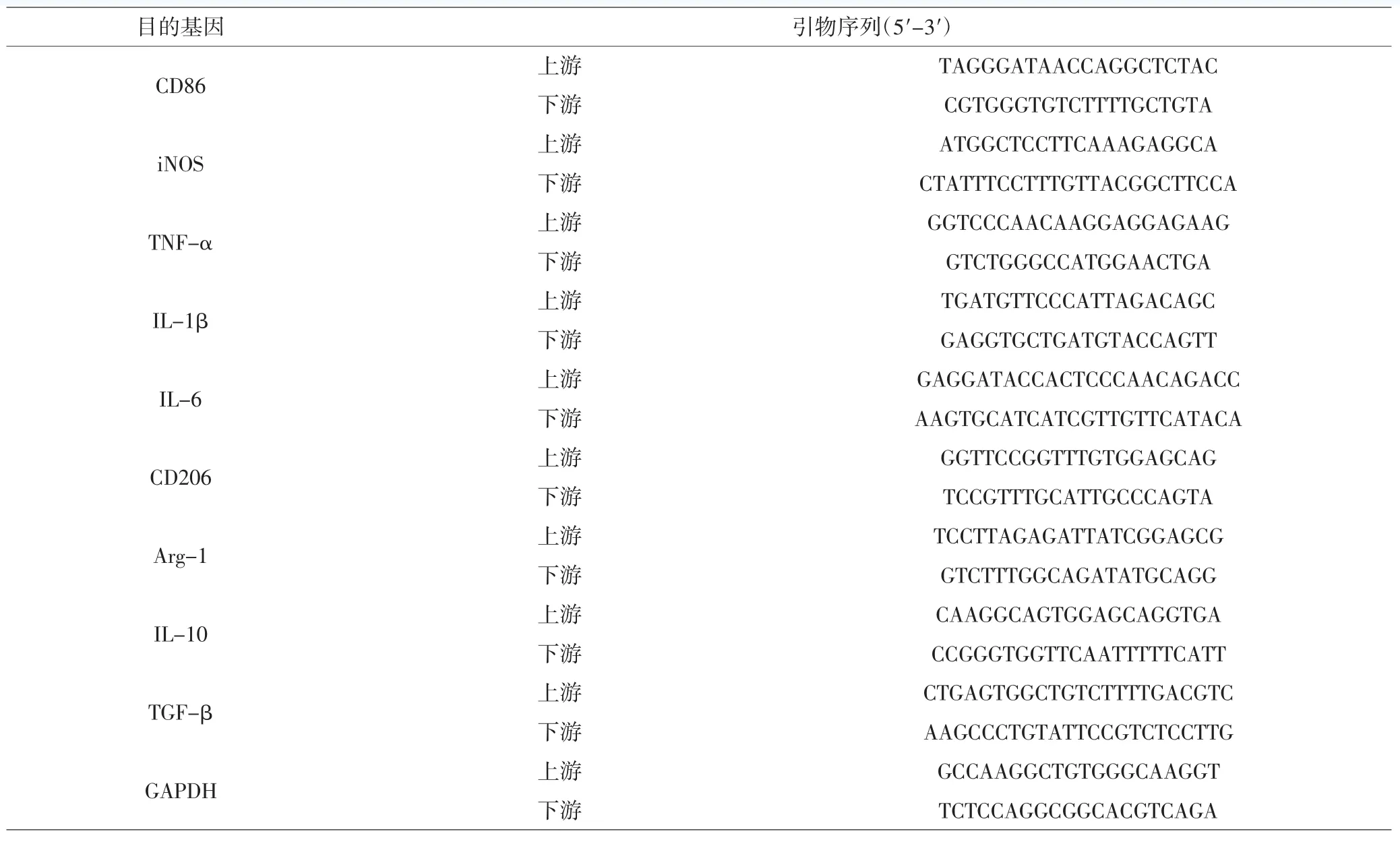
表1 引物序列Tab.1 Primer sequences
2 结果
2.1 BYHWD对大鼠脑缺血后小胶质细胞/巨噬细胞M1型极化的影响 免疫荧光双标染色结果显示,大鼠局灶性脑缺血后第14天,与假手术组比较,模型组小胶质细胞/巨噬细胞的M1型标记物CD16/32表达显著增加(P<0.01);BYHWD组小胶质细胞/巨噬细胞的CD16/32表达也显著增加(P<0.01)。与模型组比较,BYHWD组小胶质细胞/巨噬细胞的M1型标记物CD16/32表达显著减少(P<0.01)。见图1。
2.2 BYHWD对大鼠脑缺血后小胶质细胞/巨噬细胞M2型极化的影响 免疫荧光双标染色结果显示,大鼠局灶性脑缺血后第14天,与假手术组比较,模型组小胶质细胞/巨噬细胞的M2型标记物CD206表达显著增加(P<0.01);与假手术组比较,BYHWD组的CD206表达也显著增加(P<0.01)。与模型组比较,BYHWD组小胶质细胞/巨噬细胞的M2型标记物CD206表达显著增加(P<0.05)。见图2。
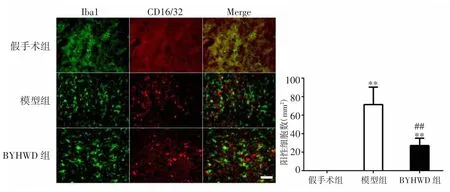
图1 BYHWD对脑缺血大鼠小胶质细胞/巨噬细胞M1型极化的影响(比例尺:50μm,400×)Fig.1 Effect of BYHWD on M1 polarization of microglia/macrophage after cerebral ischemia in rats(scale bar:50μm,400×)
2.3 BYHWD对大鼠脑缺血后M1型小胶质细胞/巨噬细胞标记物mRNA表达的影响 大鼠脑缺血后第14天,qRT-PCR检测提示,与假手术组比较,模型组 CD86、iNOS、TNF-α 和 IL-1β 的 mRNA 表达显著增加(P<0.01);BYHWD 组 CD86、IL-6的 mRNA表达显著减少(P<0.01),而 iNOS、TNF-α、IL-1β 的mRNA表达显著增加(P<0.01)。与模型组比较,BYHWD 组 CD86、iNOS、TNF-α、IL-1β 和 IL-6 的mRNA表达显著减少(P<0.01)。见图3。

图2 BYHWD对脑缺血大鼠小胶质细胞/巨噬细胞M2型极化的影响(比例尺:50μm,400×)Fig.2 Effect of BYHWD on M2 polarization of microglia/macrophageafter cerebral ischemia in rats(scale bar:50μm,400×)
2.4 BYHWD对大鼠脑缺血后M2型小胶质细胞/巨噬细胞标记物mRNA表达的影响 大鼠脑缺血后第14天,qRT-PCR检测提示,与假手术组比较,模型组CD206、IL-10 mRNA 表达显著增加(P<0.05,P<0.01),而Arg-1和TGF-β mRNA表达则无统计学差异(P>0.05);BYHWD 组 CD206、Arg-1、IL-10 和 TGF-β mRNA表达均显著增加(P<0.01)。与模型组比较,BYHWD组CD206、Arg-1、IL-10和TGF-β mRNA 表达显著增加(P<0.01)。见图 4。
3 讨论
BYHWD是中医临床治疗脑缺血及其后遗症的代表方剂。前期大量研究表明,BYHWD能够促进脑缺血后神经功能恢复,减少梗死体积,其机制与抑制神经细胞凋亡、抑制氧化应激和炎症反应以及促进神经发生和血管生成等有关[8-10]。本研究进一步发现BYHWD促进脑缺血后小胶质细胞/巨噬细胞从M1型向M2型转化,抑制神经炎症反应。

图3 BYHWD对大鼠脑缺血后M1型小胶质细胞/巨噬细胞标记物mRNA表达的影响Fig.3 Effect of BYHWD on the mRNA expression of M1 microglia/macrophage markers after cerebral ischemia in rats

图4 BYHWD对大鼠脑缺血后M2型小胶质细胞/巨噬细胞标记物mRNA表达的影响Fig.4 Effect of BYHWD on the mRNA expression of M2 microglia/macrophage markers after cerebral ischemia in rats
生理情况下,小胶质细胞呈分枝状,突起不断伸缩监视脑内微环境,维持中枢神经系统稳态。脑损伤后小胶质细胞迅速被激活,胞体变大,突起收缩呈阿米巴样,并向损伤区迁移[3-4]。与巨噬细胞一样,激活的小胶质细胞有M1和M2两种表型。M1型小胶质细胞高表达CD16/32、CD86、主要组织相容性复合体Ⅱ(major histocompatibility complexⅡ,MHCⅡ)和 i-NOS,释放促炎因子 TNF-α、IL-1β、IL-6、NO 和活性氧(reactive oxygen species,ROS)等加剧神经损伤;而M2型高表达CD206、Arg1、Ym1以及抵抗素样分子-α(resistin-like molecule-α,RELM-α),释放抗炎因子IL-10和TGF-β,同时释放IGF-1和脑源性神经营养因子(brain derived neurotrophic factor,BDNF)等神经营养因子,促进炎症消退和神经修复[5-6]。因此,本研究中选择 CD16/32、CD86、iNOS、TNF-α、IL-1β和IL-6等作为M1型小胶质细胞/巨噬细胞标记物,CD206、Arg-1、IL-10 和 TGF-β 等作为 M2 型小胶质细胞/巨噬细胞标记物。
Hu等[7]首次在大鼠局灶性脑缺血模型中发现,缺血后1~3d,M2型小胶质细胞/巨噬细胞数量开始增加,3~5d达到高峰,7d开始减少,14d恢复到损伤前水平;而M1型小胶质细胞/巨噬细胞数量在缺血后3d开始增加,持续到缺血后14d。在创伤性脑损伤和脊髓损伤中也发现类似现象[13]。因此,促进脑损伤后小胶质细胞/巨噬细胞从M1型向M2型转化为脑损伤的治疗提供了一个新思路[14]。随后大量研究发现,药物可通过促进脑缺血后小胶质细胞/巨噬细胞从M1型向M2型转换,以改善神经功能。如:姜黄素[15]、红景天苷[16]、二甲双胍[17]、西地那非[18]等。本研究中免疫荧光双标结果显示,缺血后第14天,与模型组比较,BYHWD组小胶质细胞/巨噬细胞的M1型标记物CD16/32表达减少,而M2型标记物CD206表达增加。qRT-PCR结果进一步显示,BYHWD抑制M1型小胶质细胞/巨噬细胞表面标记物CD86、iNOS以及其分泌的促炎因子TNF-α、IL-1β和IL-6的mRNA表达。相反,BYHWD促进M2型小胶质细胞/巨噬细胞表面标记物CD206、Arg-1及其分泌的抗炎因子IL-10和TGF-β mRNA表达,与免疫荧光双标结果一致。上述结果提示,BYHWD促进脑缺血后小胶质细胞/巨噬细胞从M1型向M2型转化,从而抑制炎症反应。
此外,近年来研究发现激活的小胶质细胞/巨噬细胞对神经发生也有损伤和促进的双重作用[5-6]。其中M1型小胶质细胞/巨噬细胞通过释放TNF-α、IL-1β和IL-6等促炎因子对神经发生起到损伤作用[19],而M2型小胶质细胞/巨噬细胞通过分泌IGF-1和TGF-β等神经营养因子促进神经发生[20]。进一步研究发现,二甲双胍、米诺环素和茶多酚等药物诱导脑缺血后神经发生与其促进小胶质细胞/巨噬细胞由M1型向M2型转化有关[17,21-22]。笔者前期研究发现BYHWD促进脑缺血后神经发生和神经功能恢复[9-10],机制是否与其促进小胶质细胞/巨噬细胞向M2型极化有关尚需进一步研究。
总之,本研究结果提示BYHWD可能通过促进脑缺血后小胶质细胞/巨噬细胞从M1型向M2型转化,从而抑制缺血再灌注炎症反应,但是BYHWD调控脑缺血后小胶质细胞/巨噬细胞极化的分子机制以及意义尚待进一步研究。
